STM:广州医科大学刘铭/谢茂彬合作发现肝细胞癌的新潜在治疗靶点 Claudin 6
肝细胞癌(Hepatocellular Carcinoma, HCC)是当前全球第六大高发癌症,在患者中发现时多为晚期,病程进展快,死亡率高。尽管索拉菲尼(Sorafenib)等多激酶抑制剂已获准用于晚期肝细胞癌的一线治疗,但极易产生耐药性 [1];另一方面,免疫检查点 PD-1/PD-L1 单抗虽然对部分肝细胞癌患者有不错的疗效,但仍面临响应率较低的问题 [2]。因此,亟需进一步揭示肝细胞癌的生物学特点,以寻找新的治疗靶点。2021 年 2 月 3 日,广州医科大学刘铭课题组与谢茂彬课题组于 Science Translational Medicine 杂志(STM)在线发表题为 Targeting tumor lineage plasticity in hepatocellular carcinoma using an anti-CLDN6 antibody-drug conjugate 的研究论文。这项研究揭示了细胞紧密连接(tight junction)蛋白 Claudin 6 通过调控肝癌细胞的谱系可塑性(lineage plasticity),促进肝癌进展与耐药的机制,并初步报道了其作为肝癌治疗靶点的潜力。图片来源:Science Translational Medicine
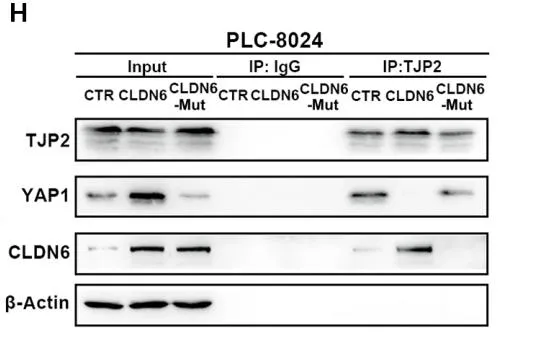
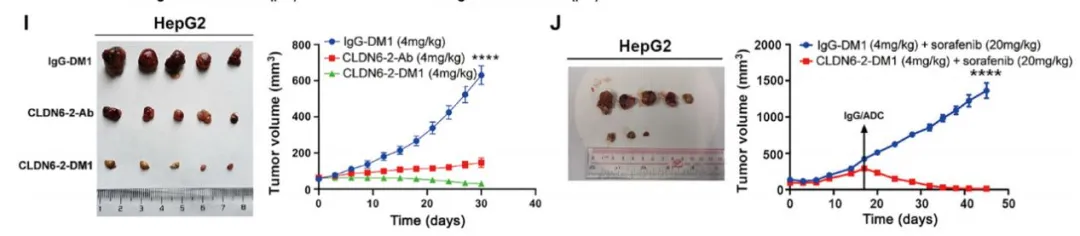
首先,作者发现 Claudin 6(CLDN6)表达量随着胚胎干细胞往成熟肝细胞的分化逐渐降低,但在患者的肿瘤样本和小鼠 HCC 索拉菲尼耐药模型中高表达,而在 HCC 癌旁组织中有一定表达量。且 CLDN6 的表达量与患者预后显著负相关。在功能层面上,CLDN6 显著促进肝癌细胞在体外及荷瘤模型中的生长,及肝癌细胞的成球(sphere-formation)能力,表明其可以通过维系肝癌细胞的干性,促进肝癌进展。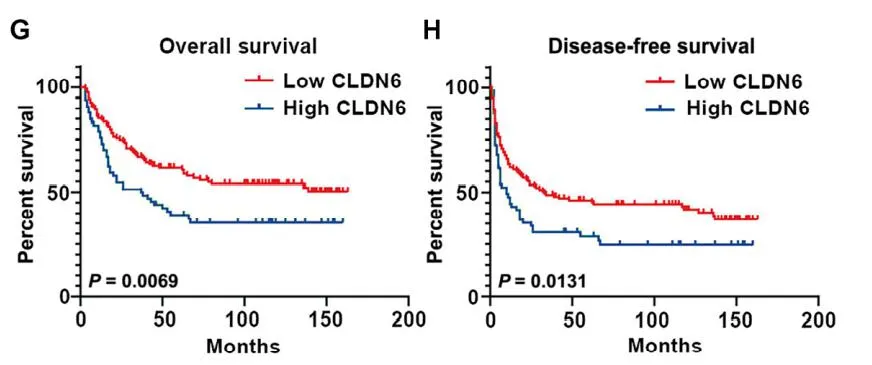 CLDN6 表达量与患者生存率显著负相关接下来,作者发现,不论在肝癌细胞还是正常肝脏组织中,CLDN6 均可以上调 EPCAM 和 KRT19 等胆道细胞标志基因和肝原始细胞(liver progenitor cell)标志基因的表达量,下调肝细胞标志基因表达量。这表明 CLDN6 可以使肝细胞和肝癌细胞转分化(transdifferentiate),产生类胆道谱系的特性。这一细胞亚群可耐受索拉菲尼,且低表达增殖标志物 Ki67。在耐药方面,CLDN6 可促进 ABCB1 等多重耐药基因的表达,索拉菲尼处理会上调 CLDN6 及相关谱系标志物的表达量,但下调增殖标志物 Ki67,表明上调 CLDN6 可能是肝癌细胞的一种应激策略,使自身进入低增殖速率的耐药状态。在分子水平上,CLDN6 可以上调 Hippo 通路转录因子 YAP1 和 TAZ 的表达量,并下调 YAP1 S127 和 S397 位点的抑制性磷酸化水平,从而活化 Hippo 通路。作者发现 CLDN6 可以与 YAP1 竞争性结合 TJP2,后者作为紧密连接复合体中的胞质支架蛋白,可以结合 YAP1 并诱导其降解。数据显示,CLDN6 可以稳定 YAP1,促进其核转位,从而活化 Hippo 通路。IP 结果显示 CLDN6 与 YAP1 竞争性结合 TJP2鉴于 CLDN6 是多次跨膜蛋白,但其不具有(或尚未发现?)配体结合结构域,难以设计小分子药物;而如果使用单抗的话,由于肝细胞癌具有复杂的微环境, T 细胞难以发挥足够的抗体依赖细胞毒性(ADCC)效应杀伤癌细胞。因此,作者设计了靶向 CLDN6 的抗体偶联药物(Antibody-Drug Conjugate, ADC),将细胞毒性药物 DM1 和 CLDN6 抗体通过 SMCC 分子偶联。该 ADC 对 CLDN6 高表达的肝癌细胞具有良好的选择杀伤作用,并且不会「误伤」表达其它 CLDNs 的细胞。在荷瘤小鼠模型中,该 ADC 不论单独使用还是与索拉菲尼联用,均展现了良好的疗效,有效抑制了肿瘤的生长,且无明显毒副作用。靶向 CLDN6 的 ADC 抑制 HCC 荷瘤小鼠中肿瘤生长综上,本文报道了 CLDN6 通过激活 Hippo 通路,诱导肝癌细胞的转分化,产生耐受索拉菲尼的胆道谱系细胞,从而促进肝癌的进展和耐药。作者提出,CLDN6 具有良好的成药潜力。由于生殖腺以外大部分组织均不表达该蛋白,且生殖腺中 CLDN6 的表达量远低于肿瘤细胞,因此靶向 CLDN6 具有良好的选择性。但肿瘤细胞亦可能通过下调 CLDN6 表达,重构信号网络以适应相应药物处理,因此,将靶向 CLDN6 的 ADC 与其它药物联用或许是更加可行的策略。另外,肿瘤如何上调癌旁组织中 CLDN6 的表达量亦值得探究,这一结果表明 CLDN6 可能在肿瘤的发生或侵袭过程中亦扮演了重要角色。https://stm.sciencemag.org/content/13/579/eabb6282
CLDN6 表达量与患者生存率显著负相关接下来,作者发现,不论在肝癌细胞还是正常肝脏组织中,CLDN6 均可以上调 EPCAM 和 KRT19 等胆道细胞标志基因和肝原始细胞(liver progenitor cell)标志基因的表达量,下调肝细胞标志基因表达量。这表明 CLDN6 可以使肝细胞和肝癌细胞转分化(transdifferentiate),产生类胆道谱系的特性。这一细胞亚群可耐受索拉菲尼,且低表达增殖标志物 Ki67。在耐药方面,CLDN6 可促进 ABCB1 等多重耐药基因的表达,索拉菲尼处理会上调 CLDN6 及相关谱系标志物的表达量,但下调增殖标志物 Ki67,表明上调 CLDN6 可能是肝癌细胞的一种应激策略,使自身进入低增殖速率的耐药状态。在分子水平上,CLDN6 可以上调 Hippo 通路转录因子 YAP1 和 TAZ 的表达量,并下调 YAP1 S127 和 S397 位点的抑制性磷酸化水平,从而活化 Hippo 通路。作者发现 CLDN6 可以与 YAP1 竞争性结合 TJP2,后者作为紧密连接复合体中的胞质支架蛋白,可以结合 YAP1 并诱导其降解。数据显示,CLDN6 可以稳定 YAP1,促进其核转位,从而活化 Hippo 通路。IP 结果显示 CLDN6 与 YAP1 竞争性结合 TJP2鉴于 CLDN6 是多次跨膜蛋白,但其不具有(或尚未发现?)配体结合结构域,难以设计小分子药物;而如果使用单抗的话,由于肝细胞癌具有复杂的微环境, T 细胞难以发挥足够的抗体依赖细胞毒性(ADCC)效应杀伤癌细胞。因此,作者设计了靶向 CLDN6 的抗体偶联药物(Antibody-Drug Conjugate, ADC),将细胞毒性药物 DM1 和 CLDN6 抗体通过 SMCC 分子偶联。该 ADC 对 CLDN6 高表达的肝癌细胞具有良好的选择杀伤作用,并且不会「误伤」表达其它 CLDNs 的细胞。在荷瘤小鼠模型中,该 ADC 不论单独使用还是与索拉菲尼联用,均展现了良好的疗效,有效抑制了肿瘤的生长,且无明显毒副作用。靶向 CLDN6 的 ADC 抑制 HCC 荷瘤小鼠中肿瘤生长综上,本文报道了 CLDN6 通过激活 Hippo 通路,诱导肝癌细胞的转分化,产生耐受索拉菲尼的胆道谱系细胞,从而促进肝癌的进展和耐药。作者提出,CLDN6 具有良好的成药潜力。由于生殖腺以外大部分组织均不表达该蛋白,且生殖腺中 CLDN6 的表达量远低于肿瘤细胞,因此靶向 CLDN6 具有良好的选择性。但肿瘤细胞亦可能通过下调 CLDN6 表达,重构信号网络以适应相应药物处理,因此,将靶向 CLDN6 的 ADC 与其它药物联用或许是更加可行的策略。另外,肿瘤如何上调癌旁组织中 CLDN6 的表达量亦值得探究,这一结果表明 CLDN6 可能在肿瘤的发生或侵袭过程中亦扮演了重要角色。https://stm.sciencemag.org/content/13/579/eabb6282本周推荐:
[1] Zhu YJ, Zheng B, Wang HY, Chen L. New knowledge of the mechanisms of sorafenib resistance in liver cancer. Acta Pharmacol Sin. 2017;38(5):614-622. doi:10.1038/aps.2017.5
[2] El-Khoueiry AB,. et al. Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040): an open-label, non-comparative, phase 1/2 dose escalation and expansion trial. Lancet. 2017;389(10088):2492-2502. doi:10.1016/S0140-6736(17)31046-2
![]()

 CLDN6 表达量与患者生存率显著负相关
CLDN6 表达量与患者生存率显著负相关