STM:傅阳心、侯玉柱等发现放疗与免疫治疗的交汇点,兵家必争之地竟是这群细胞
丁香学术
759
背景介绍
近期,癌症神经科学以及神经营养配体促进肿瘤恶性进展的相关研究越来越多,也逐渐成为领域内的热点之一。
其中,一种神经营养因子 —— Artemin (ARTN),被发现能够促进肿瘤进展,而 ARTN 主要是由肿瘤诱导产生的 CD45−Ter119+CD71+ 红系祖细胞分泌的,CD45−Ter119+CD71+ 细胞又被称为「Ter 细胞」,为晚期实体瘤动物脾细胞的主要组成部分。
放射治疗,简称放疗,广泛应用于各种癌症的治疗,最近的研究表明,免疫系统在介导放疗的抗肿瘤作用中扮演着重要的角色。放疗可通过诱导树突状细胞的成熟和增强 T 细胞活化来介导抗肿瘤免疫。
此外,免疫检查点抑制剂的研究,如程序性死亡 - 1 (PD-1) 抑制剂,也是肿瘤治疗领域内的热门研究,其主要目的在于增强 T 细胞的功能,也有是通过增加 II 型干扰素的产生而发挥抗肿瘤作用。
由于 Ter 细胞是由肿瘤细胞诱导产生的,而放疗和免疫疗法的目的又是消灭肿瘤细胞,那么 Ter 细胞、放疗和免疫疗法三者在肿瘤发生发展以及治疗中有着怎样的关联呢?目前仍未有明确的答案。
2021 年 2 月 24 日,来自中国西安交通大学、山东第一医科大学第一附属医院以及美国芝加哥大学、德克萨斯大学西南医学中心等单位的研究人员在 Science Translational Medicine 期刊上发表了题为 Radiotherapy and immunotherapy converge on elimination of tumor-promoting erythroid progenitor cells through adaptive immunity 的研究性文章。
该研究结果表明,放疗和抗 PD-L1 免疫治疗能够显著降低肿瘤模型和临床患者的 Ter 细胞数量和血浆 ARTN 浓度;另外,靶向 Ter/ARTN 轴能够增强放疗和免疫治疗的疗效,并且 Ter 细胞、ARTN 和 ARTN 信号通路的表达与接受放疗、免疫治疗或联合治疗的患者的预后相关。

图片来源:Sci. Transl. Med
主要内容
局部放疗可减少肿瘤诱导的小鼠脾脏内 Ter 细胞的积累
前期的研究已经证明,肿瘤诱导产生的红细胞祖细胞 (EPCs) 与不良预后显著相关,而靶向 EPCs 或其分泌产物可抑制肿瘤的进展。因此,研究人员首先观察了肺细胞癌 (LCC) 小鼠模型的脾脏及其细胞组成。
结果发现,LCC 小鼠发生了脾肿大,但是这种肿大能够在放疗后基本恢复正常。同时,Ter119+CD71+ EPCs 在放射治疗后,其比例也明显降低,基本恢复到基线水平。此外,在其他肿瘤模型,如 MC38 结肠癌和 B16-SIY 黑色素瘤模型,也观察到了类似的放疗后 Ter 细胞显著减少的现象,表明放疗诱导的 Ter 细胞减少并不局限于某种肿瘤类型。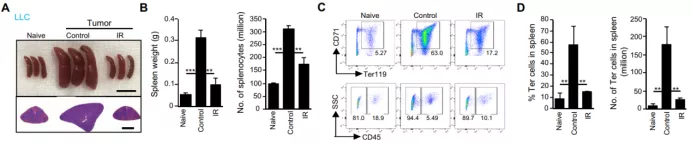

图片来源:Sci. Transl. Med
放疗通过干扰素和 T 细胞介导对 Ter 细胞的削弱
接下来,他们研究了肿瘤局部照射减少小鼠脾脏内 Ter 细胞积累的机制。有研究提到,放疗可通过 I 型干扰素和 T 细胞触发局部和全身抗肿瘤免疫,为了确定 I 型干扰素在 Ter 细胞减少中的潜在作用,研究人员构建了干扰素受体敲除小鼠 (IFNAR KO)。
结果表明,放疗可使野生型小鼠脾脏大小、脾细胞数量、Ter 细胞数量减少,但 IFNAR KO 小鼠中并没有这种现象,这表明宿主 I 型干扰素信号是放疗发挥作用所必需的。
为了进一步证实 I 型干扰素在放疗减少 Ter 细胞中的作用,他们比较了局部放疗或外源性注射干扰素治疗野生型小鼠肿瘤的效果。结果发现两者均可减少 Ter 细胞数量。综合上述实验结果可以发现,I 型干扰素对于放疗介导的 Ter 细胞减少是必需的。
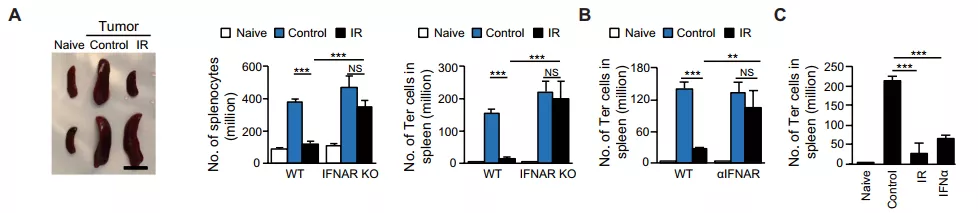 图片来源:Sci. Transl. Med
图片来源:Sci. Transl. Med考虑到 T 细胞也能介导放疗发挥抗肿瘤作用,接下来,研究人员探索了 T 细胞在 Ter 细胞减少中的作用。借助 T 细胞缺失小鼠模型 (RAG KO),他们发现放疗并没有降低 RAG KO 小鼠中 Ter 细胞的丰度,这一结果同样表明 T 细胞对于放疗诱导 Ter 细胞减少的必需性。
随后,为了研究究竟是哪些 T 细胞亚群发挥了上述作用,研究人员使用抗体清除 CD4 + 或 CD8+ T 细胞。结果发现,只有 CD8+ T 细胞的减少能够消除了放疗诱导的 Ter 细胞减少,这表明是 CD8 + 而不是 CD4+ T 细胞发挥作用。
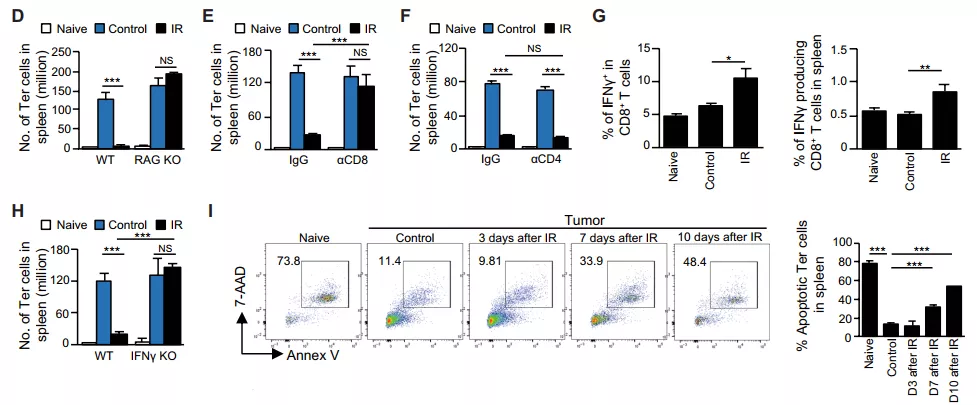
图片来源:Sci. Transl. Med
PD-L1 阻断治疗减少肿瘤诱导的 Ter 细胞积累
免疫疗法,包括 PD-L1 和 PD-1 阻断等,是有望治疗许多癌症的方法。PD-L1 阻断能够增强 CD8+ T 细胞的免疫功能,包括干扰素的产生和细胞毒活性的增强。那么 PD-L1 阻断是否以及通过何种机制控制肿瘤诱导的脾脏 Ter 细胞的积累现象呢?
首先,研究人员通过腹腔注射 PD-L1 阻断抗体或放疗治疗荷瘤小鼠,发现两种治疗都减少了肿瘤相关的脾肿大和脾细胞的数量。流式细胞术分析也显示 PD-L1 阻断降低荷瘤小鼠脾脏中 Ter 细胞的比例和数量。
与预期的一样,PD-L1 阻断治疗也降低了脾脏中 ARTN 的表达和血清中 ARTN 的浓度。因此,PD-L1 阻断亦可降低肿瘤诱导的 Ter 细胞积累和 ARTN 的产生。后续的实验也证实,PD-L1 阻断同样以一种 CD8+ T 细胞和干扰素依赖的方式减少肿瘤诱导 Ter 细胞的积累。
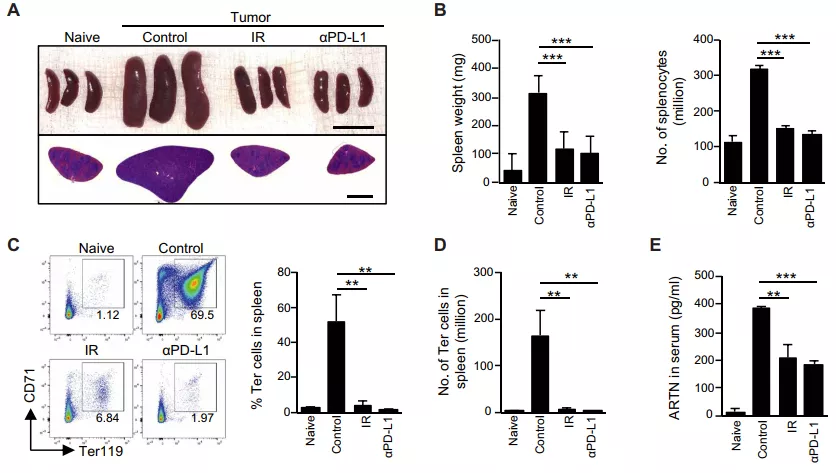
图片来源:Sci. Transl. Med
Ter 细胞和 ARTN 对放疗和免疫治疗的影响
接下来,他们探究了 Ter 细胞和 ARTN 对放疗和 PD-L1 阻断治疗肿瘤效果的影响。使用集落形成试验,他们发现肿瘤细胞与 Ter 细胞共培养,或着在细胞培养中加入 ARTN,均可增强小鼠肿瘤细胞的抗辐射能力;同时,Ter 细胞和 ARTN 亦可削弱 CD8+ T 细胞介导的肿瘤细胞杀伤能力。
在肿瘤模型中,通过移植 Ter 细胞或外源性注射 ARTN 同样可以减弱放疗和 PD-L1 阻滞的抗肿瘤作用。上述的结果表明免疫治疗和放疗的治疗作用部分依赖于它们对 Ter 细胞的抑制。
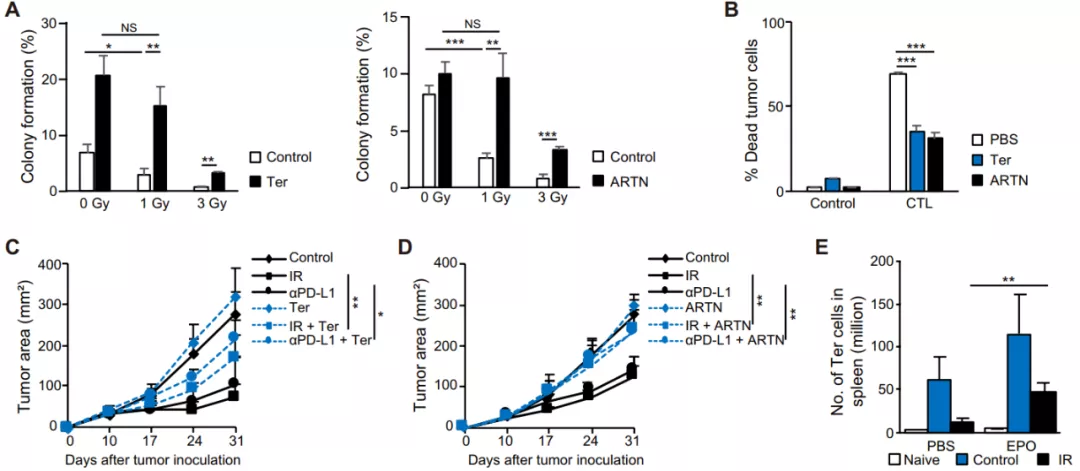
图片来源:Sci. Transl. Med
同样的,破坏 Ter/ARTN 轴能够恢复甚至增加放疗和抗 PD-L1 治疗的疗效。通过使用 anti-Ter119 抗体,将小鼠体内 Ter 细胞耗尽,这显著促进了放疗和抗 PD-L1 治疗的作用。接下来的研究也表明阻断 ARTN 能增强抗肿瘤治疗效果。因此,Ter 细胞耗尽、ARTN 中和都能够促进放疗和 PD-L1 阻断治疗的效果。
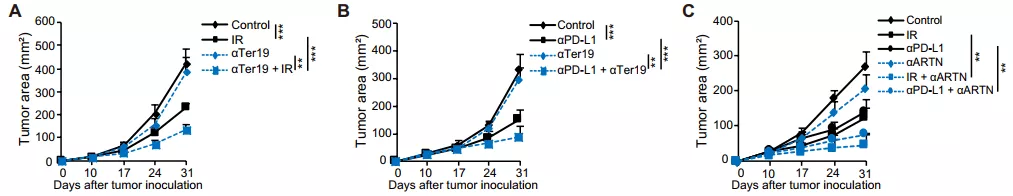
图片来源:Sci. Transl. Med
Ter/ARTN 轴与癌症患者对治疗的反应有关
最后,研究人员落脚到临床应用层面,他们分析研究了肿瘤治疗的不同反应是否与癌症患者的 Ter 细胞和 ARTN 浓度有关。结果表明,在接受放化疗的非小细胞肺癌患者中,那些治疗后没有复发的患者中,治疗后循环 ARTN 蛋白浓度显著降低,而那些复发患者的 ARTN 浓度则没有显著降低。
此外,在一项临床试验中,患者接受放疗后进行 anti-PD-1 免疫治疗,在该队列中,研究人员发现那些放疗后完全或部分缓解患者的 Ter 细胞丰度显著下降,而那些在治疗期间疾病仍发生进展(对治疗无反应)的患者中,Ter 细胞丰度没有显著变化。这些数据表明,患者的放射治疗和免疫治疗反应与 Ter 细胞和 ARTN 浓度相关。
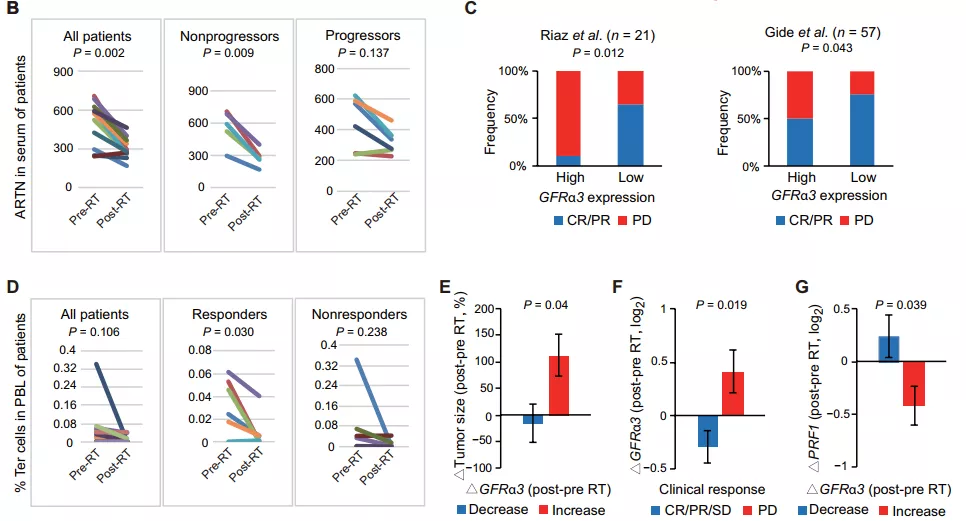
图片来源:Sci. Transl. Med
研究总结
综上所述,该研究报道了放疗和 PD-L1 阻断治疗能够降低肿瘤诱导产生的 Ter 细胞和 ARTN 水平,机制层面,放疗和 PD-L1 阻断治疗可使体内发生由干扰素、DCs 和 CD8+ T 细胞介导的先天和适应性免疫应答,这些应答也是治疗充分发挥疗效所必需的,同时,阻断 Ter 细胞 - ARTN 轴可以促进放疗和抗 PD-L1 治疗的效果。
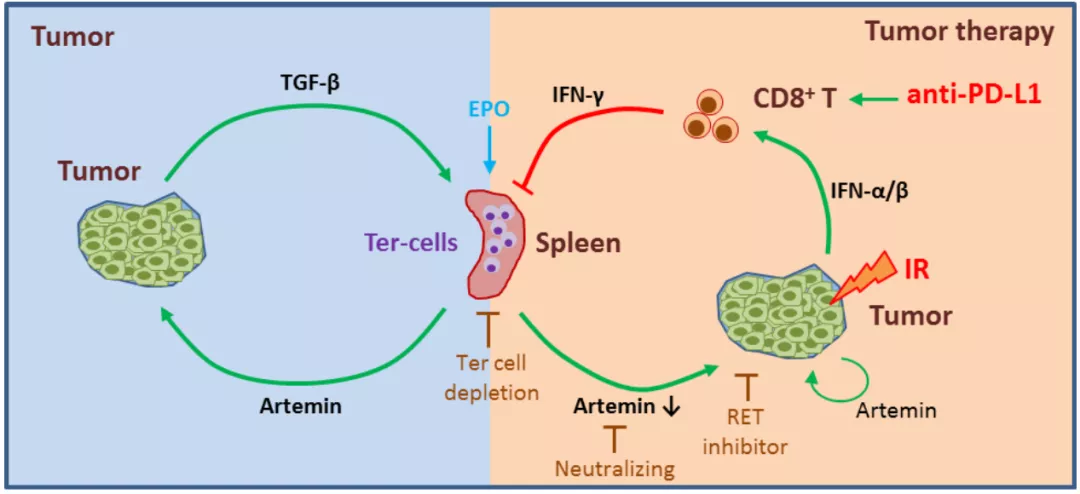
图片来源:Sci. Transl. Med
总之,该研究证明了放射治疗或免疫治疗与肿瘤诱导的脾 Ter 细胞介导的相互对立的调节作用关系,揭示了 Ter 细胞和 ARTN 在癌症治疗中的抑制作用,并为改善放疗和免疫治疗提供了多种可能的靶点,具体潜在的临床应用价值。
论文共同通讯作者、芝加哥大学放射与细胞肿瘤学主席 Ralph Weichselbaum 博士提到:「这些研究结果鉴定出了的几种靶标,潜在地改善放疗和免疫治疗后的结果。这些方法的应用前景是令人兴奋的」。
据悉,西安交通大学侯玉柱教授为本文第一作者及共同通讯作者,西安交通大学为第一完成单位,山东第一医科大学第一附属医院俞新爽副主任医师为本文共同第一作者。该项工作获得国家自然科学基金及西安交通大学「青年拔尖人才」项目的支持。
本周推荐:
三句话读懂一篇 CNS,鸟类迁移的秘密揭晓,绿色中药助力肥胖治疗,突破血脑屏障的递送技术...
NEJM 重磅报道,可以通过母婴传播的癌症!
Cell 子刊:遭遇寄生虫时,硬核海兔断头求生...
参考文献