Science:直击肿瘤命门,Shibin Zhou 等开发靶向 TP53 突变的双特异性抗体
丁香学术
379
p53 基因是人体内最重要的抑癌基因之一,扮演着人体基因组守护者的角色。
p53 缺失会使得表达致癌基因的细胞无限增殖,从而直接导致癌症发生;p53 缺失还会导致存活的子代细胞中基因突变负荷增加,间接地促进癌症的发生。编码 p53 的 TP53 基因也是人类癌症中最常出现突变的抑癌基因。因此,一般认为,TP53 基因的突变常常与癌症的发生和患者的不良预后相关 [1]。
关于 TP53 基因的研究一直是肿瘤治疗领域的热点,科学家们也一直在苦苦探寻靶向 TP53 的肿瘤治疗药物,但是至今还没有针对突变型 p53 的药物被批准用于治疗含有这些突变的肿瘤患者。
2021 年 3 月 1 日,来自美国的 Bert Vogelstein, Sandra B. Gabelli 和 Shibin Zhou 团队研制出了一种靶向 TP53 突变基因的双特异性单链抗体(bispecific single-chain diabody,scDb)。这种双特异性抗体在体外和小鼠体内都能有效识别呈递新抗原的癌细胞,并激活 T 细胞,发挥抗肿瘤效应。
从理论上讲,这种双特异性抗体可以用来针对含有传统方法难以瞄准的突变的癌症。该成果以 Targeting a neoantigen derived from a common TP53 mutation 为题发表在最新的 Science 上 [2]。

图片来源:Science
研究内容:
TP53 中的突变最常以单核苷酸变体的形式出现在 DNA 结合域中。来自突变的 TP53 等位基因的蛋白可以被蛋白酶体降解,被主要组织相容性复合体(MHC)加工和呈递,产生 T 细胞受体 (TCR) 可识别的新抗原(neoantigen)。
,时长00:20
R175H,其中 175 位的精氨酸被组氨酸取代,是 TP53 中观察到的最常见的突变,也是任何肿瘤抑制基因中最常见的突变。HMTEVVRHC (带下划线的为突变氨基酸) 来源于 p53R175H,与人类白细胞抗原 (HLA) 等位基因 (undefined02:01) 结合,该等位基因存在于超过 40% 的美国高加索人中。
近年来,TCR-Mimic (TCRm) 抗体已成为一类靶向肿瘤细胞内蛋白 pHLA(多肽 - MHC 复合物)的药物。与 TCR 相比,TCRm 抗体具有更高的亲和力,可以很容易地转化为各种治疗形式,如全长抗体、抗体 - 药物结合物和双特异性抗体。
另外,T 细胞重定向双特异性抗体具有肿瘤抗原和 TCR-CD3 复合物的双重特异性,是现成的试剂,理论上可以用于治疗任何肿瘤含有目标抗原的患者。
双特异性抗体的一端与肿瘤细胞结合,另一端以肿瘤选择性的方式触发 T 细胞的细胞毒作用和细胞因子的产生。这种形式主要是针对高表达的、非肿瘤特异性的、野生型 (WT) 细胞表面蛋白。基于以上理论,研究人员开发了本研究中靶向 TP53 突变和 CD3 的双特异性单链抗体(scDb)。
研究人员首先确证了 p53R175H 在三种人肿瘤细胞系(KMS26, TYK-nu, KLE)中表达,并以 p53R175H/HLA-undefined02:01 复合物的形式被呈递到细胞表面。通过噬菌体文库技术筛选得到了两个特异性靶向 p53R175H/HLA-undefined02:01 复合物的抗体克隆,分别命名为 H2-scDb 和 H20-scDb。这两个克隆可以特异性地与 p53R175H/HLA-undefined02:01 复合物结合,并激活 T 细胞,然而对 p53WT/HLA-undefined02:01 复合物并没有类似作用。

图片来源:Science
研究人员又评估了 H2-scDb 识别不同表达水平的 HLA-undefined02:01 和具有不同 p53 突变状态的癌细胞的能力。结果发现,H2-scDb 可以特异性识别靶抗原,并诱导和激活 T 细胞反应,且具有剂量依赖性。T 细胞释放颗粒酶 B、穿孔素、IFN-γ 等对靶细胞造成杀伤。
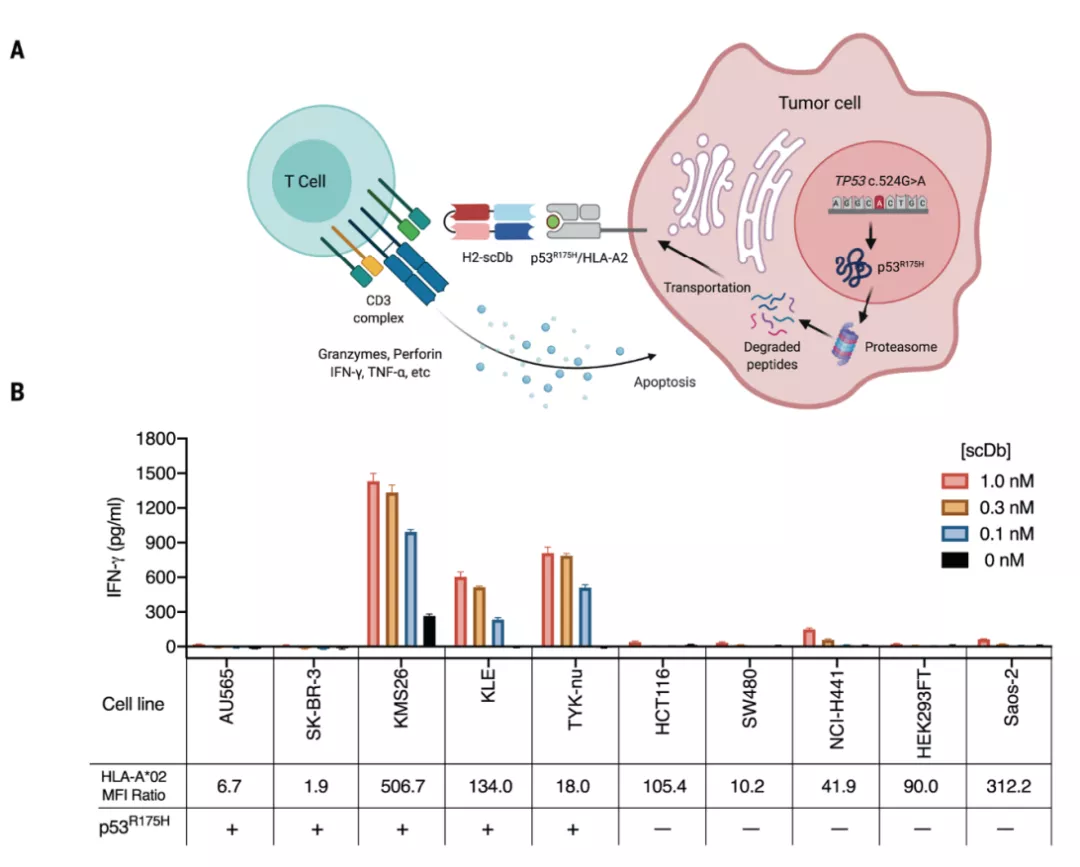
图片来源:Science
研究人员用三种不同的方法进一步验证了 H2-scDb 的特异性。
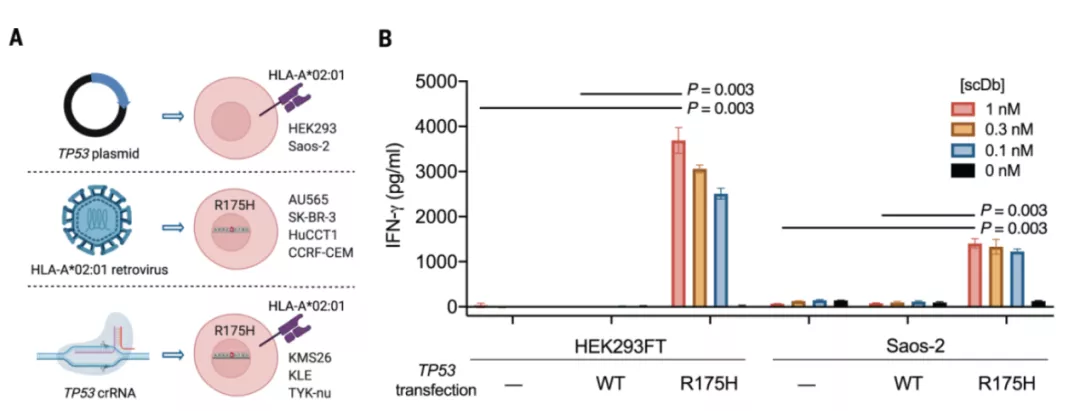
图片来源:Science
为了检测 H2-scDb 是否存在交叉反应,评估其安全性,研究人员基于抗体结构对可能的交叉反应表位进行了检测和验证。结果显示,H2-scDb 的特异性非常好,并不会诱导交叉反应。
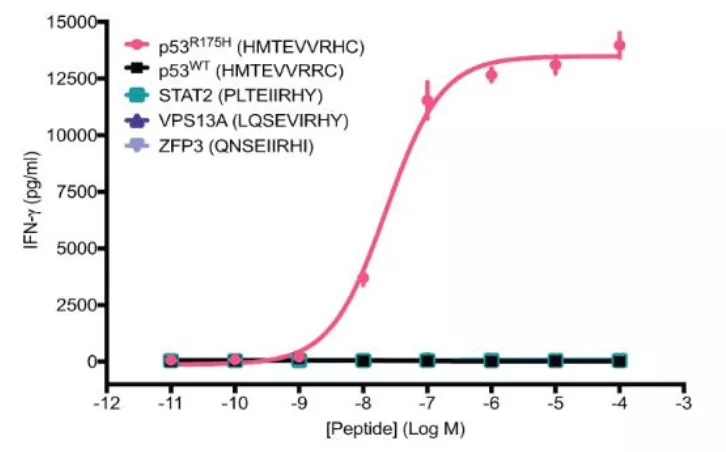 图片来源:Science
图片来源:Science
最后,研究人员在小鼠模型中进行了体内实验的验证,再次证明了 H2-scDb 可以特异性识别和激活 T 细胞,发挥良好的抗肿瘤作用。
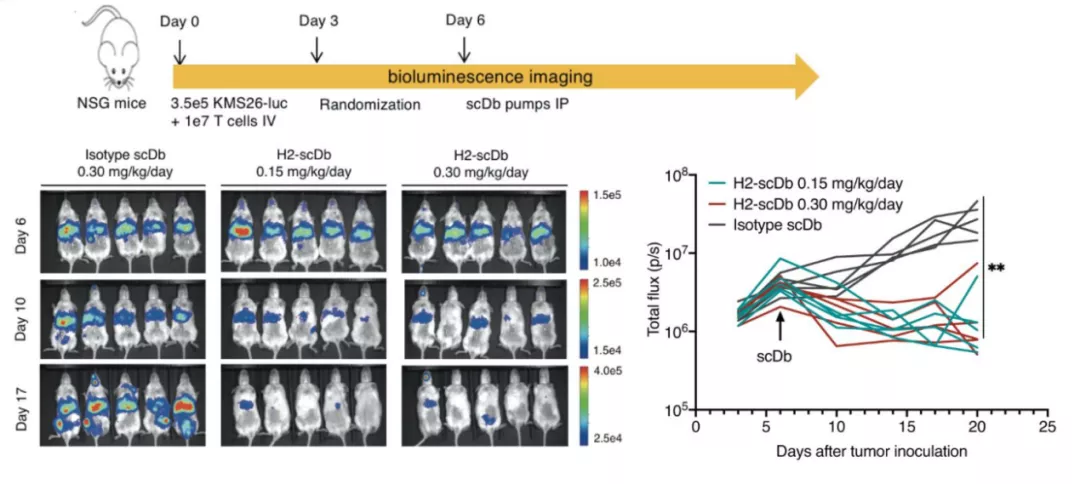
图片来源:Science
研究意义:
研究团队已经证明,他们研发的这一双特异性单链抗体 H2-scDb 可以特异性识别和激活 T 细胞,发挥抗肿瘤做用,且不会诱导产生交叉反应,具有良好的安全性。
虽然目前只是在动物模型上获得了验证,但是为后续的肿瘤治疗提供了很多的思路和选择,如与免疫检查点抑制剂的联合应用;TCR-T 细胞疗法的开发;「共同新抗原」为基础的通用疫苗研发等。
另外,常规的抗体治疗通常只能结合细胞表面的抗原,而肿瘤中大部分抗原是胞内抗原,这令抗体治疗常常束手无策。本研究中的抗体巧妙地识别了被呈递到细胞表面的抗原肽 - MHC 复合物,激活了 T 细胞的抗肿瘤效应。这为抗体的研发、靶向实体瘤的 CAR-T 细胞疗法研发等提供了新的思路和证据。
延伸阅读:
早在 2019 年 2 月,Rosenberg 团队就在 JCI 发表了一项 TP53 新抗原相关的研究 [3]。

图片来源:The Journal of clinical investigation
研究人员对 140 例上皮肿瘤患者中的 TP53 突变情况进行了检测,结果发现, 65%(91/140)携带 TP53 突变,其中 36%(33/140)含有 TP53 常见突变。
研究对 COSMIC 数据库显示的所有肿瘤类型中最常见的 12 种 TP53 突变:R175H, Y220C, G245S, G245D, R248L, R248Q, R248W, R249S, R273C, R273H,R273L, R282W 进行了检测和验证。
研究人员又对 28 例患者中分离出的 TILs 进行分析发现,有 11 例具有靶向 TP53 常见突变的 T 细胞反应,其中鉴定出的唯一共有的突变的 TP53 新表位是 HLundefined02:01 R175H(HMTEVVRHC)。
图片来源:The Journal of clinical investigation
也就是说, HLundefined02:01 R175H(HMTEVVRHC)这种新抗原突变并不是单一患者独有的,而是在某些患者中都具有的「共同新抗原」。
如果 Science 报道的双特异性单链抗体在人体试验中被证实安全有效,那么和 Keytruda(PD-1 单抗)被批准用于 dMMR/MSI-H 实体瘤治疗类似,这也许是又一种可以治疗 TP53-R175H 突变的广谱抗癌药物。
这对高度个性化、制备周期长的新抗原免疫疗法来说,无疑是一个好消息!也期待发现更多的「共同新抗原」!
本周推荐:
三句话读懂一篇 CNS,肝脏再生能力之谜被揭开,培养皿生长 300 天的「迷你人脑」,解析东亚地区人群形成史...
Science:学术「自嗨」还是开创性的发现?聚焦「相分离」研究引发的学术争议
你是否命里缺觉?午休是否有害健康?Nature 子刊给出答案
Nat Med:个体化肿瘤疫苗突破,特异性 T 细胞持续 4.5 年,患者存活率 100%
[1] Kastenhuber ER, et al. Putting p53 in Context. Cell, 2017, doi: 10.1016/j.cell.2017.08.028
[2] Emily Han-Chung Hsiue et al. Targeting a neoantigen derived from a common TP53 mutation. Science, 2021, doi: 10.1126/science.abc8697.
[3] Malekzadeh P, et al. Neoantigen screening identifies broad TP53 mutant immunogenicity in patients with epithelial cancers. The Journal of clinical investigation, 2019, 129(3): 1109-1114. doi: 10.1172/JCI123791
[4] Jon Weidanz. Targeting cancer with bispecific antibodies. Science, 2021, doi: 10.1126/science.abg5568
题图来源:Ludwig Cancer Research 官网截图