绝处逢生,靳令经/李华/叶克强等开发双靶点抑制剂,间接靶向EGFR来治疗胶质母细胞瘤
胶质母细胞瘤是一种较为常见的致死性恶性脑瘤,约占原发性恶性脑瘤的 45.6% ,平均存活时间仅有 12 个月。
胶质母细胞瘤常发生表皮生长因子受体(EGFR)过表达或突变,其中表皮生长因子受体 III 型突变体(EGFRVIII)是最常见的突变体。
目前临床常用的 EGFR 靶向抑制剂已有三代,主要用于肺癌等癌症的治疗(NEJM:提前 2 年揭盲!吴一龙联合全球 284 个中心团队,发现手术 + 精准分型靶向治疗降低早中期肺癌术后 83% 复发风险)。第一代靶向药主要有易瑞沙、凯美纳等。第二代抑制剂主要有阿法替尼、达克替尼等。第一、二代靶向药疗效显著,但副作用也比较大,且多数患者服用 1-2 年出现耐药性。第一代药物耐药后可用第三代靶向药,主要代表药有奥西替尼等,第三代靶向药亦出现耐药性。
然而,现有研究表明使用 EGFR 为靶点治疗胶质瘤仍有许多问题。靶向 EGFR 开发的抗体并未能改善患者的生存率。仅有Panitumumab(帕尼单抗)是唯一可以同时中和 EGFRvIII 和 wtEGFR 的抗体,减弱下游 p-S6 信号,具有良好的体外和体内的抗肿瘤活性。
如何发现新的可成药靶点,开发新型替代靶向药刻不容缓!
个体化治疗其中一个重要策略是充分利用致癌突变引起的下游反应激活。大量证据表明 EGFRVIII 的激活与细胞内氧化应激水平相关。而 NQO1 和 GSTP1 是重要的 II 相解毒酶,可以减少醌类直接转换成氢醌,并消除氧化还原反应产生的活性氧。因此 NQO1 和 GSTP1 是潜在的治疗靶点。
2020 年 10 月 21 日,埃默里大学医学院叶克强教授、华中科技大学药学院李华教授和同济大学医学院靳令经教授共同在 Journal of Hematology & Oncology 期刊上发表题为「Discovery of a dual inhibitor of NQO1 and GSTP1 for treating glioblastoma」的文章。
该项研究结果发现了一种 NQO1 和 GSTP1 双重小分子抑制剂 MNPC,它可以间接靶向 EGFR 来治疗胶质母细胞瘤。

研究内容
首先,研究人员利用高通量筛选方法筛选出能抑制 U87MG/EGFRVIII 细胞增殖的化合物。通过对 38000 多种化合物的比对筛选,最终发现潜在的 15 个小分子化合物。经过构效关系分析,最终选择化合物 MNPC 进行抗肿瘤功能评价。
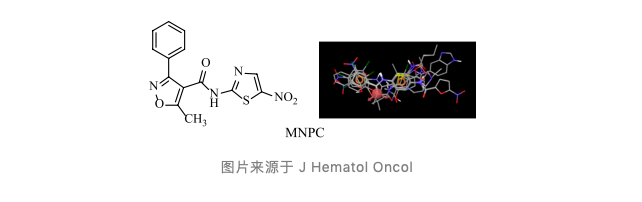
其次,研究人员发现 MNPC 主要结合的靶点是 NOQ1 和 GSTP1,可抑制细胞增殖,并通过抑制两种酶活性,调节细胞氧化还原平衡。

为了探究 EGFRVIII 细胞中 NQO1 和 GSTP1 的功能,研究人员采用 NQO1 和 / 或 GSTP1 过表达和敲除细胞和动物模型。U87MG/EGFRVIII 细胞单基因敲除后,细胞增殖能力减弱,双敲除降低更显著。单基因敲除裸鼠肿瘤的重量和体积都显著减少,双基因敲除裸鼠两者降低地更显著。U87MG/EGFRVIII 细胞中 NQO1 和 GSTP1 过表达消除了活性氧,同时促进细胞生长。

进一步探究细胞增殖和活性氧在 MNPC, NQO1 和 GSTP1 三者之间的关系。研究人员在 U87MG/EGFRVIII 细胞和 U87MG 细胞中过表达和敲除 NQO1 和 / 或 GSTP1,并用不同浓度的 MNPC 处理。结果显示 MNPC 可以抵抗 NQO1 和 GSTP1 介导的氧化还原。
本研究为了证实 MNPC 抗胶质母细胞瘤的作用,建立了小鼠颅内异种移植模型。结果显示 MNPC 高剂量组的小鼠生存期更长,体重更大、肿瘤减慢生长,也并未发现系统性毒性。

研究展望
文末作者对研究进行了展望。MNPC 通过利用 EGFR 特定的漏洞治疗 EGFRVIII 表达的胶质母细胞瘤,且无明显毒性,具有很大的潜在应用前景。
本研究虽在细胞水平和动物水平上验证了 MNPC 抑制胶质母细胞瘤的作用,尚未开展临床试验,但这也为未来提供了一种潜在的胶质母细胞瘤治疗策略。
衷心祝愿这种药物能够为胶质瘤患者带来新的希望!









