首次体外制造出人猴嵌合体胚胎!Cell 重磅发布季维智院士团队成果
丁香学术
205
自山中伸弥获得 2012 年诺贝尔医学奖以来,人们对干细胞在再生医学中的应用寄予厚望。可 9 年过去了,iPSC 的出现依旧未能解决干细胞研究领域最大的问题:如何获得大量的人类全能干细胞?
胚胎干细胞,作为另外一种全能干细胞的来源,由于伦理学原因同样进展缓慢。但为了规避这个问题,一些科学家「另辟蹊径」打起来了跨物种嵌合体的主意。

图片来源:Cell
2021 年 4 月 16 号,来自我国昆明理工大学的季维智院士、谭韬教授、牛昱宇教授携手索尔克生物研究所的 Juan Carlos Izpisua Belmonte,在 Cell 上刊登了题为 Chimeric contribution of human extended pluripotent stem cells to monkey embryos ex vivo 的研究 [1], 报道了人类首次在体外制造出了人猴嵌合胚胎,为体外大量制备人类多能干细胞提供了新的可能。
研究内容:
得益于昆明理工大学季维智院士团队所开发出的,能够使得猕猴胚胎在体外「超长待机」的新技术,Juan Carlos 教授团队与北京大学邓宏魁教授团队此前得到的人类扩展多能干细胞(hEPSC)有了全新的舞台。
研究人员首先向受精六天后的猕猴胚胎囊胚中注射了 25 个带有荧光标记的 EPSC。一天后,研究团队发现接受 EPSC 注射的 132 个猕猴囊胚都出现了荧光蛋白,表明 EPSC 注射极高的成功率。
图片来源:Cell
在移除透明带后,接近 93% 的 EPSC 囊胚成功在体外着床,着床率与此前报道相似。研究团队也观测到,这些囊胚在着床后持续生长,并形成了可见的胚盘。
图片来源:Cell
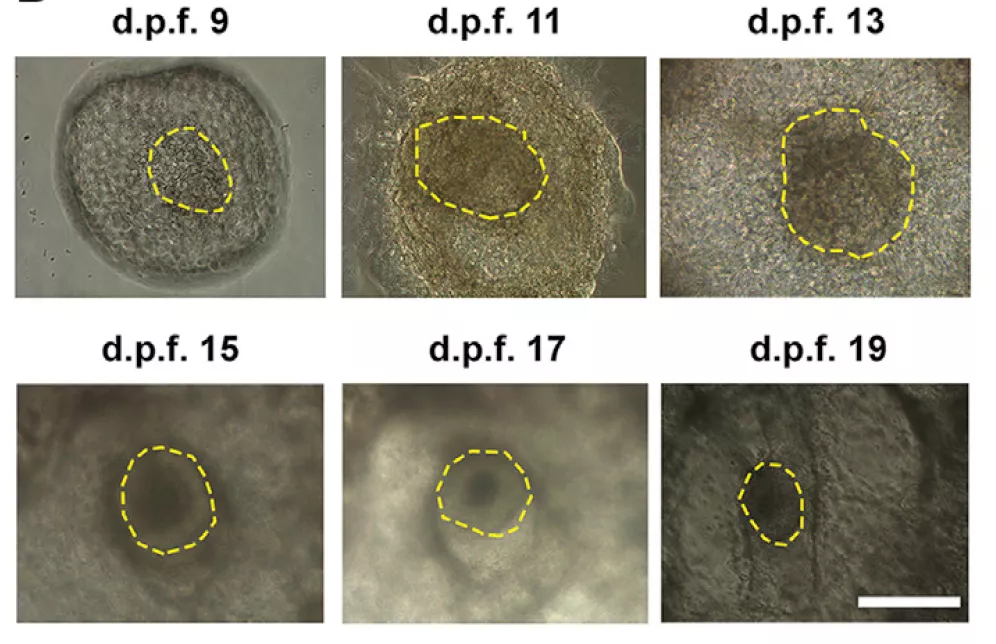
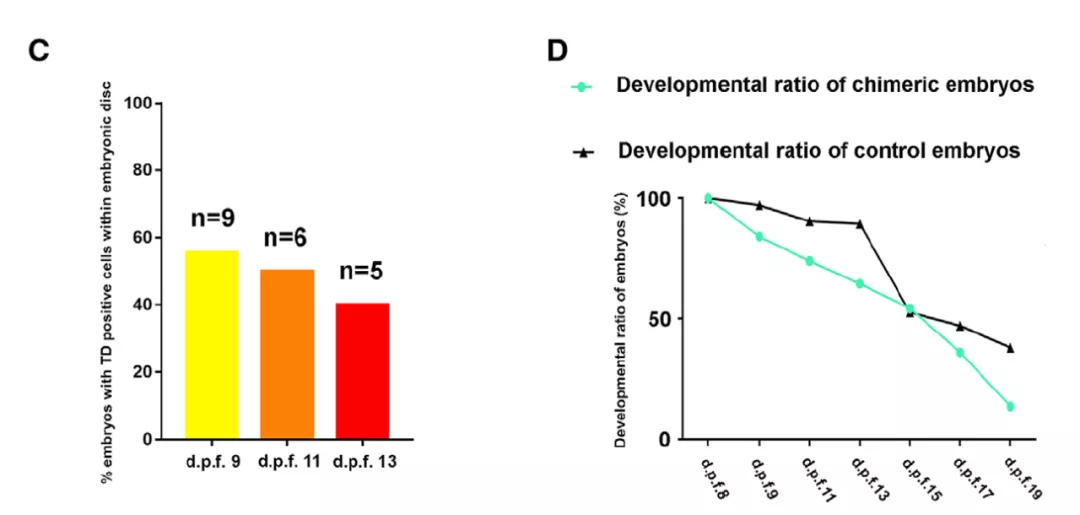
随后,作者观测了这些胚盘中 EPSC 的生存情况。尽管随着培养时间的增加,带有 EPSC 荧光蛋白的胚盘占比逐渐变低,但在受精 13 天后,依旧有接近 40% 的胚盘中存在 hEPSCs,这是一个鼓舞人心的比例。同时,作者也发现,与对照组相比, EPSC 引入导致的人猴嵌合仅仅稍微降低胚盘的存活率。
图片来源:Cell
通过对不同时间点的胚盘进行荧光染色,研究团队探究了 EPSC 在胚盘中的存活以及发育情况。
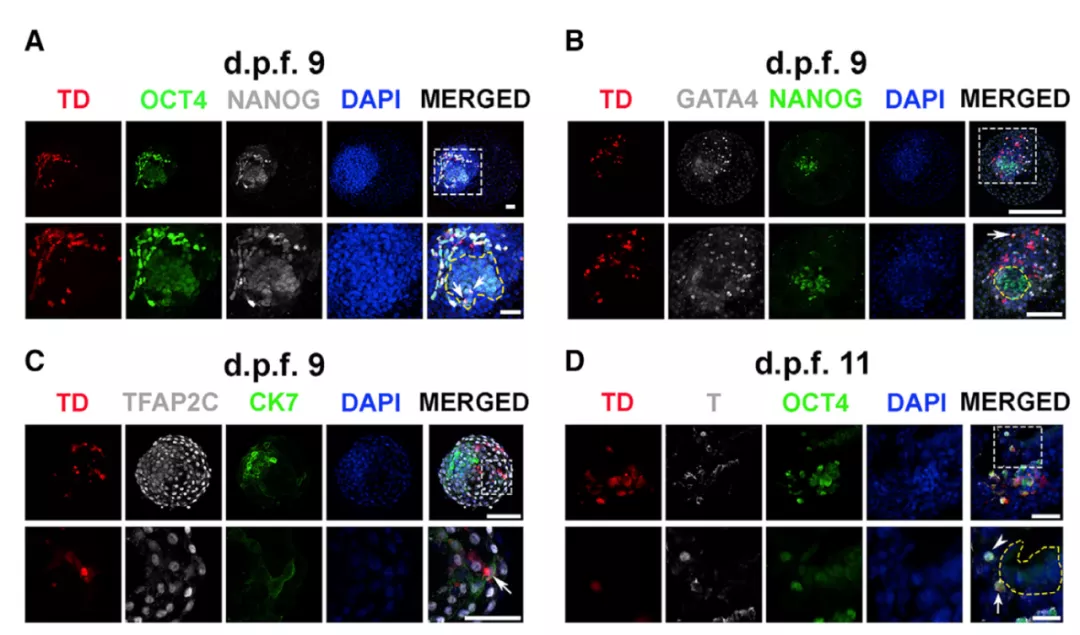
在受精 9 天后的胚盘中,研究团队观测到有平均约 10.2 个的 EPSC 被成功整合到猕猴胚胎的内细胞团(ICM)中。这些 EPSC 大多并不表达 NANOG,证明它们更接近于上胚层细胞。与研究团队此前观测到的人鼠嵌合胚胎不同,仅有极少量的 EPSC 出现在人猴嵌合胚胎的滋养外胚层中。
2 天过后,表达 OCT4 的 EPSC 开始出现在上胚层。同时,猴子胚胎下胚层中也开始混杂一些表达下胚层标记物 PDGFRa 的 EPSC。
图片来源:Cell
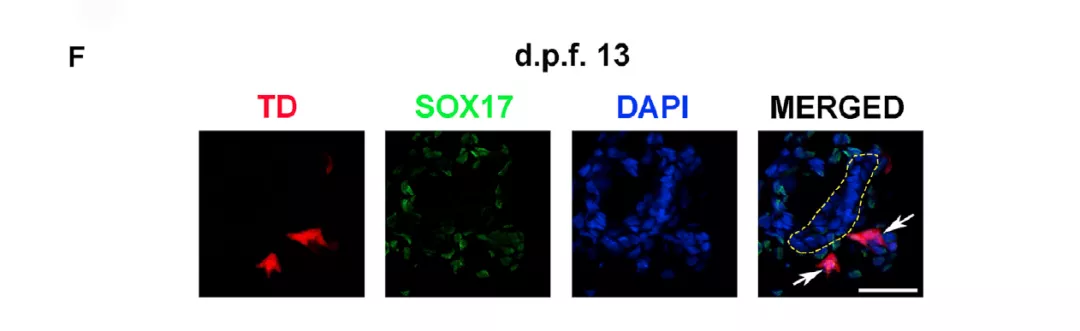
继续培养 2 天后,表达 SOX17 的 ESPC 开始出现,表明 ESPC 开始形成原肠胚。
整体而言,在整个猕猴胚胎的培养过程中,在上胚层与下胚层中都有着一定数量的 EPSC,表明了人猴嵌合现象的存在。
为了进一步探究人猴嵌合胚胎的发育轨迹。研究团队随后对这些胚胎进行了单细胞 RNA 测序(scRNA-seq)。

图片来源:Cell
通过对不同发育时间点的 227 个人类细胞与 302 个猕猴细胞进行 scRNA-seq,研究团队最终选取了 200 个人类细胞与 272 个猕猴细胞进行了进一步分析。
首先,作者进行了 T - 分布邻域嵌入算法分析(t-distributed stochastic neighbor embedding,t-SNE)。结果显示,与人或者猴的胚胎一样,人猴嵌合胚胎中的两个物种的细胞,都能够被分为 4 个细胞群,分别为上胚层(EPI)、下胚层 (HYP)、滋养外胚层 (TE) 以及胚外间充质细胞 (EXMC)。在人猴嵌合胚胎中出现全部 4 种的猕猴细胞群,表明猴子的正常胚胎发育基本没有受到 EPSC 的影响。与此同时,尽管人猴嵌合胚胎中人类细胞也呈现出了 4 个细胞群,但其上胚层细胞、下胚层细胞以及滋养外胚层细胞之间的界限并没有猕猴细胞那样明显。尽管如此,这依旧表明人类细胞能在人猴嵌合胚胎中,能够分化成不同的细胞种类。

图片来源:Cell
对细胞种类进行探索后,研究团队随即将目光转向了转录层面。
转录动力学研究显示了一个非常有趣的现象:那就是嵌合体中的人类细胞与对照组人类胚胎及猕猴胚胎分别比较得出的相关系数几乎一致。这意味着嵌合体中的人类细胞变得更像猕猴细胞了。进一步的谱系相关矩阵显示,嵌合胚胎中的人类下胚层与胚外间充质细胞同嵌合胚胎中的猕猴下胚层与胚外间充质细胞表现出了极高的相关性。这些数据证明在人猴嵌合胚胎中,两个不同物种的胚胎细胞可以互相影响对方的转录状态。对基因与信号通路的进一步分析也证明这种「人猴交互」的存在。
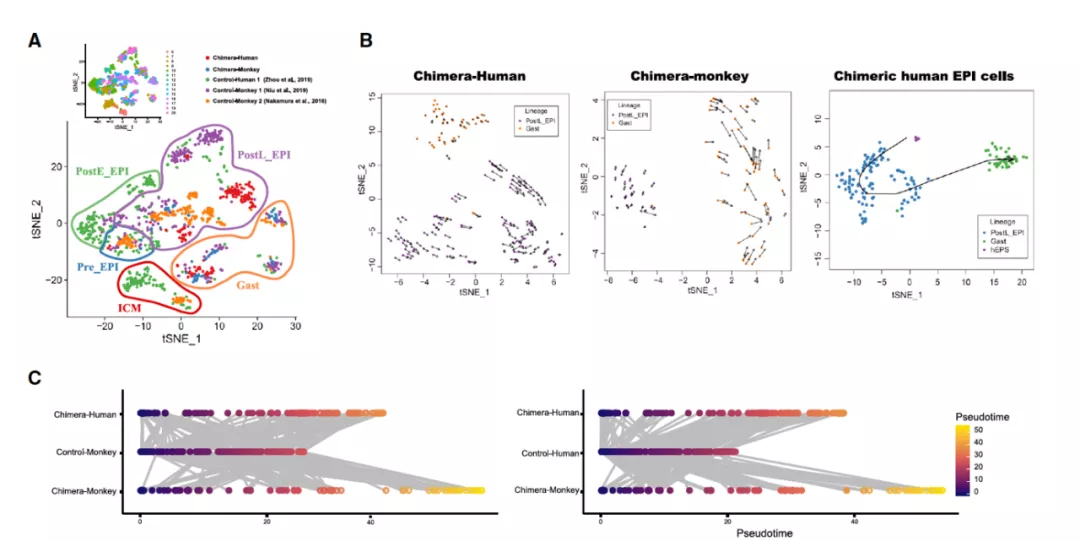
图片来源:Cell
最后,研究团队探究了人猴嵌合胚胎中,上胚层 EPSC 的发育轨迹。与人类胚胎、或者猴子胚胎中真正的胚胎细胞相比,EPSC 分化成类上胚层细胞的效率更低,速度更慢。
为了探究 EPSC 发育的进程,研究团队为这些细胞进行了详尽的转录研究,并识别出包括 PI3K-Akt, MAPK 与 PPAR 通路在内的,一系列可能使 EPSC 分化出来的类上胚层细胞更像猕猴上胚层细胞的通路。为人类 ESPC 在猕猴胚胎中的发育提供了转录水平上的见解。
研究意义:

图片来源:Cell
该研究突破性地结合了两项全球最先进的技术,不仅首次实现了人猴胚胎的嵌合,还利用大量的分析,对整个过程进行了详细的描述与解析。为以后该技术的进一步应用铺平了道路,是一项对干细胞领域以及胚胎发育学领域具有里程碑意义的重大突破。
延伸阅读:
人猴嵌合胚胎的出现,离不开季维智院士、谭韬教授、牛昱宇教授、Juan Carlos 教授以及邓宏魁教授等多个顶尖学术团队多年的积累。

图片来源:Cell
2017 年,北京大学小分子诱导 iPSC 的领军人物邓宏魁教授联手 Juan Carlos 教授团队在 Cell 上发表了题为 Derivation of Pluripotent Stem Cells with In Vivo Embryonic and Extraembryonic Potency 的论文 [2], 首次在体外建立了具有胚内和胚外发育潜能的干细胞系 EPSC,并实现了人鼠嵌合胚胎。

图片来源:Science
2 年后,季维智院士、谭韬教授、牛昱宇教授与 Juan Carlos 教授团队合作,首次在体外实现了长达 20 天的食蟹猕猴胚胎培养。相关论文以 Dissecting primate early post-implantation development using long-term in vitro embryo culture 为题 [3],于 2019 年 11 月 15 日刊登在 Science 之上,是中国科学家为灵长类研究的又一重大贡献。
此次两项技术的融合,为人类早期胚胎研究以及干细胞的应用,开启了一扇新的大门。
论文链接及参考文献:
1. Tao, T., et al ., Chimeric contribution of human extended pluripotent stem cells to monkey embryos ex vivo. Cell, 2021(184): p. 1-12.
2. Yang, Y., et al., Derivation of Pluripotent Stem Cells with In Vivo Embryonic and Extraembryonic Potency. Cell, 2017. 169(2): p. 243-257.e25.
3. Niu, Y., et al., Dissecting primate early post-implantation development using long-term in vitro embryo culture. Science, 2019. 366(6467): p. eaaw5754.