Nature 重磅:林圣彩院士团队七年攻坚!首次破解「神药」二甲双胍作用靶点之谜
丁香学术
导读
二甲双胍,一种自带「流量」的药物,亦被称为「神药」,这些光环主要是基于二甲双胍的多种神奇功效,尤其是近些年来,随着研究的不断深入,发现其在心血管保护、抗肿瘤以及抗衰老、延长健康寿命中均发挥着显著作用,以至于大家快要忘记二甲双胍最初是治疗二型糖尿病的一线药物。
上世纪 20 年代,二甲双胍首次在文献中被报道,随后发现其可降低兔子的血糖。之后沉寂了很多年,直到 50 年代法国糖尿病专家 Jean Sterne 在巴黎的实验室工作,重新研究了二甲双胍和几种双胍类似物的降血糖活性,并于 1957 成功用于糖尿病患者的治疗。因此他也成为第一个在人体上试验二甲双胍治疗糖尿病的人,此后二甲双胍意气风发,迅速走红,最早于 1957 年在法国上市,自此以后,多个领域也开启了吹「胍」模式。
尽管热火朝天研究了很多年,但关于二甲双胍发挥作用的分子靶点却一直是领域内的难题并且争论不休和含糊不清,换言之,我们并没有真正解码二甲双胍发挥作用的分子机制,因此也极大地限制了人们对二甲双胍的理解和应用。
2022 年 2 月 23 日,厦门大学林圣彩院士团队联合张宸崧、邓贤明团队在国际顶尖期刊 Nature 杂志发表了题为 Low-dose metformin targets the lysosomal AMPK pathway through PEN2 上的文章,通过化学合成二甲双胍的探针去「钓取」其结合靶点,然后再通过质谱分析进行解析,最终发现了治疗剂量的二甲双胍直接发挥作用的靶点及其内在分子机制,为糖尿病的治疗,乃至抗肿瘤、抗衰老的药物研发和应用提供了新的思路,这次历史性突破有望成为糖尿病药物治疗史上的里程碑事件。
图片来源:Nature
主要研究内容
PEN2 与二甲双胍结合
截至目前,二甲双胍发挥作用的多种机制被提出。比如说,二甲双胍可以抑制肝细胞线粒体电子传递链的复合物 I,从而降低线粒体氧耗,并抑制三磷酸腺苷(ATP)的生成,使 AMP/ATP 比值升高。增加的 AMP 还可以抑制果糖-1,6-二磷酸酶-1 和腺苷酸环化酶,从而阻止糖异生;二甲双胍也被认为可以改变细胞氧化还原状态,从而增加 NAD+/NADH 比值,抑制糖异生底物的利用。
在二甲双胍的各种潜在效应物中,腺苷酸活化蛋白激酶(AMP-activated protein kinase , AMPK)处于中心位置,其同时也作为机体代谢稳态的主要调控因子。目前,二甲双胍通过抑制线粒体电子传递链的复合物 I 而激活 AMPK 已被广泛接受。然而,在他们的研究中却发现能量水平的下降只存在小鼠服用高剂量二甲双胍的个体,也就是说,低剂量的二甲双胍不会引起线粒体呼吸链复合体 I 的抑制以及 AMP/ATP 比值的升高。
因此,有必要深入探讨临床相关剂量的二甲双胍是如何激活 AMPK 的。通过一系列的生化实验和观察,他们发现临床剂量的二甲双胍能充分抑制溶酶体的空泡 H+-ATPase(v-ATPase)。
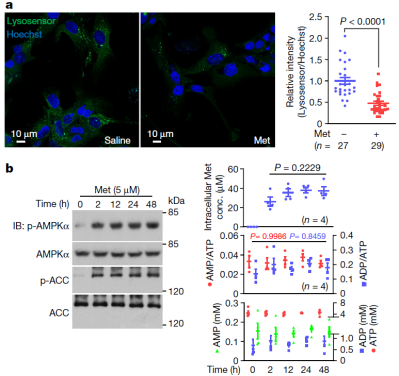
图片来源:Nature
因此,接下来,他们就使用了一种基于亲和力的方法来分析纯化的溶酶体蛋白提取物,以确定二甲双胍潜在的直接靶点。经过不厌其烦地逐一筛选,他们从 2000 多个获选靶点中锁定了 PEN2。他们发现 PEN2 的缺失使细胞对二甲双胍治疗不敏感。同样地,敲除 PEN2 也可阻断低剂量二甲双胍诱导的 AMPK 激活和 v-ATPase 抑制。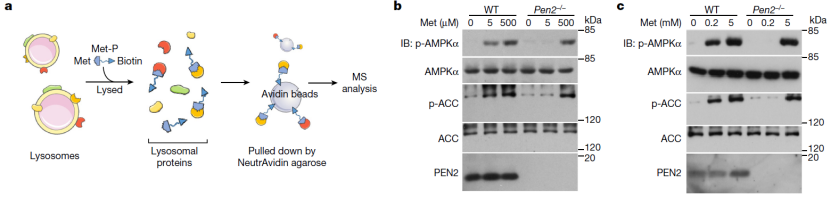
图片来源:Nature
ATP6AP1 辅助 PEN2 与 v-ATPase 结合
接下来,他们研究了二甲双胍是如何导致 PEN2 与 v-ATPase 结合并抑制它的。通过质谱分析 PEN2 与溶酶体蛋白提取物孵育后的免疫沉淀。结果共检测到 1881 个蛋白质,其中 889 个蛋白质在二甲双胍处理后发生了改变。在这 889 种蛋白质中,有 123 种是定位于溶酶体的蛋白质。
在这 123 个候选基因中,他们通过细胞和体外的免疫共沉淀试验来验证了 v-ATPase 的辅助因子 ATP6AP1 以二甲双胍依赖的方式介导 PEN2 与 v-ATPase 的相互作用。此外,PEN2 与 ATP6AP1 结合位点的突变,也会削弱 PEN2 和 ATP6AP1 之间的相互作用。总之,这些结果表明,在与二甲双胍结合后,PEN2 被招募并与溶酶体膜 ATP6AP1 结合形成复合体,以此抑制 v-ATPase 活性,从而激活溶酶体上的 AMPK。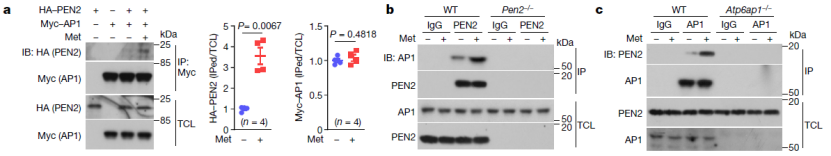
图片来源:Nature
动物模型验证上述发现
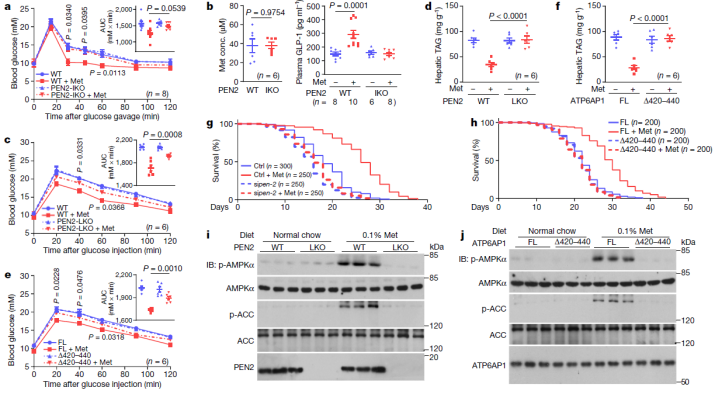
最后,他们探讨了 PEN2 和 ATP6AP1 在动物模型中介导二甲双胍有益作用的功能。他们观察到,那些在肠道中敲除 PEN2 老鼠的二甲双胍餐后降糖作用明显受损,这与在肠道特异性敲除 Ampka 小鼠中观察到的效应一直。此外,肝特异性敲除 PEN2 则会导致小鼠肝脏中 AMPK 激活的严重障碍。
除此之外,他们还检测了二甲双胍诱导的寿命延长是否依赖于 PEN2 和 ATP6AP1。敲除了线虫中 PEN2 的同源基因 T28D6.9 后,可阻断二甲双胍诱导的线虫寿命延长效应。
综上所述,PEN2 和 ATP6AP1 结合在一起,似乎负责了二甲双胍的三个主要生物效益:降低葡萄糖水平,减少肝脏脂肪含量和延长寿命。
图片来源:Nature
研究总结
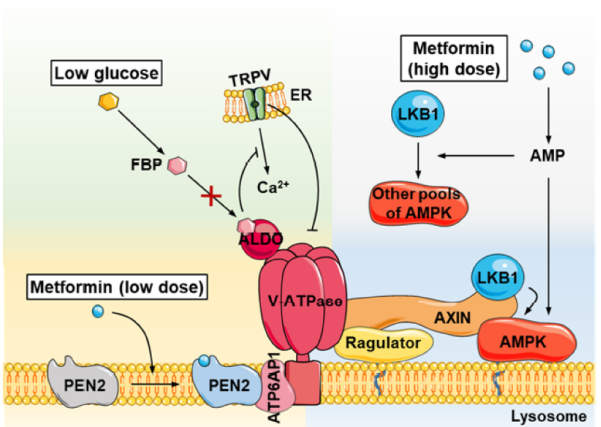
综上所述,经过层层解析,该团队发现 PEN2 是二甲双胍的分子靶点。具体而言,在二甲双胍存在的情况下,PEN2 结合到 ATP6AP1 亚基,进而抑制 v-ATPase 的活性,然后激活溶酶体 AMPK。
PEN2-ATP6AP1 轴构成了一个与溶酶体 v-ATPase-AXIN-AMPK 轴交叉的信号转导,这使得低浓度的二甲双胍能够利用 AMP 无关的 AMPK 激活途径;他们还发现 PEN2 -ATP6AP1 通路不参与低葡萄糖水平下 AMPK 的激活,这表明 PEN2-ATP6AP1 轴是一条与 v-ATPase 复合体平行的通路。总之,该研究强调了 v-ATPase 作为溶酶体 AMPK 激活信号通路节点的重要作用。
图片来源:Nature
林圣彩院士及其合作团队的这一发现无疑加深了我们对二甲双胍这一「神药」的理解,同时也在一定程度上揭开了该药物的神秘面纱。据悉,本研究首次从分子角度解析了二甲双胍发挥功能的分子通路和路线图,它发现了二甲双胍延长寿命等神奇功效的潜在原因,和卡路里限制(俗称「七分饱」),走的是同一条路线。
这为筛选治疗糖尿病或其他代谢性疾病的新型药物提供了潜在的靶点。同时,该研究还表明,深入认识基于细胞内亚细胞器的区域化精准信号通路调控,对揭示药物的作用靶点及其安全性、有效性都至关重要。
近年来,厦门大学林圣彩院士团队以细胞代谢稳态调控为研究核心,针对细胞对营养物质与能量的感知机制以及代谢紊乱相关疾病的发生发展的分子机制进行研究,并取得了一系列原创性成果。
从 2014 年起,他们开始了对二甲双胍作用机制的深入探讨,并于 2016 年在 Cell Metabolism 杂志发表文章报道了二甲双胍可能通过溶酶体途径激活 AMPK 的初步结论,为二甲双胍的功效行使指明了一个粗略的方向。
图片来源:Cell Metabolism
值得一提的是,溶酶体途径激活通路也正是林圣彩团队发现的,即在机体感应饥饿和葡萄糖水平下降时所用的一条通路。关于这条中国人自己发现的新通路,也被国际同行称为「林通路」。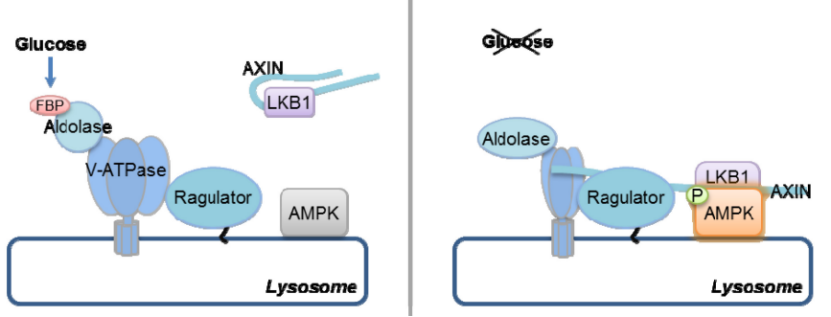
图片来源:Nature



![二甲双呱盐酸盐[1115-70-4]](https://img1.dxycdn.com/p/s14/2024/0922/556/2382746517108787381.jpg!wh200)