有效抑制肿瘤术后复发!浙大顾臻等开发神奇水凝胶,实现缓释型免疫疗法
丁香学术
671
2021 年 4 月 26 日,来自加利福尼亚大学、浙江大学药学院等单位的研究团队在 Nature Biomedical Engineering 在线发表了题为 Inhibition of post-surgery tumour recurrence via a hydrogel releasing CAR-T cells and anti-PDL1-conjugated platelets 的文章, 该研究报道了一种生物可降解的水凝胶储层,而且这种水凝胶可以创造一个有利的环境,可以在手术后清除残留的肿瘤细胞并防止肿瘤复发。
北卡 Gianpietro Dotti 教授与浙大顾臻教授是文章共同通讯作者。

图片来源:Nature Biomedical Engineering
背景介绍
当前,尽管有手术、放疗和化疗等多种治疗肿瘤的方式,但切除实体肿瘤的患者经常出现复发,同时术后炎症也可以触发肿瘤的生长和转移。近年来,免疫疗法通过阻断免疫检查点来激活肿瘤部位的 T 细胞,以此防止术后肿瘤复发。然而,只有在不到 20% 的免疫原性肿瘤患者中对免疫检查点抑制剂有持续的临床反应;此外,免疫检查点阻断在那些产生新抗原以及以体细胞突变为特征的肿瘤中是无效的,同时,它引起的自身免疫性疾病等副作用仍然令人担忧。
除此之外,那些经过体外编辑过的 T 细胞也是肿瘤特异性 T 细胞的来源。事实证明,那些表达嵌合抗原受体(Chimeric Antigen Receptor, CAR)的 T 细胞在某些恶性血液肿瘤患者中是特别有效的,而相比之下,在实体肿瘤中应用 CAR-T 细胞治疗仍然具有挑战性。这可能是因为实体肿瘤中的肿瘤微环境具有高度的免疫抑制作用,并可诱导 CAR-T 细胞衰竭。那么,结合 CAR-T 细胞和免疫检查点阻断可能是提高 CAR-T 细胞在实体肿瘤中作用的方式。
主要研究内容
新型水凝胶的开发
研究人员以丙烯酸酯基修饰的透明质酸 (HA) 为原料,通过交联剂和光引发剂在紫外光照射下进行交联,然后将靶向 CSPG4 抗原(黑色素瘤特异性抗原)的 CAR-T 细胞和抗 PDL1 阻断抗体结合的人血小板 (P-aPDL1) 装载到水凝胶中。为了支持 CAR-T 细胞在水凝胶中的生存能力和增殖,PLGA 纳米颗粒包装的细胞因子 IL-15 也被纳入。共聚焦显微镜和低温扫描电镜证实了 P-aPDL1 和 CAR-T 细胞在水凝胶中的分布,同时,水凝胶配方对 CAR-T 细胞没有毒性作用,也没有诱导 CAR-T 细胞的非特异性激活。因此,HA 水凝胶可作为携带 P-aPDL1 的 CAR-T 细胞和血小板的储层。
手术后的炎症会触发血小板的激活,导致血小板源性微粒的形成,血小板源性微粒则可以释放 aPDL1 抗体,进而与肿瘤细胞结合并阻断 PDL1。
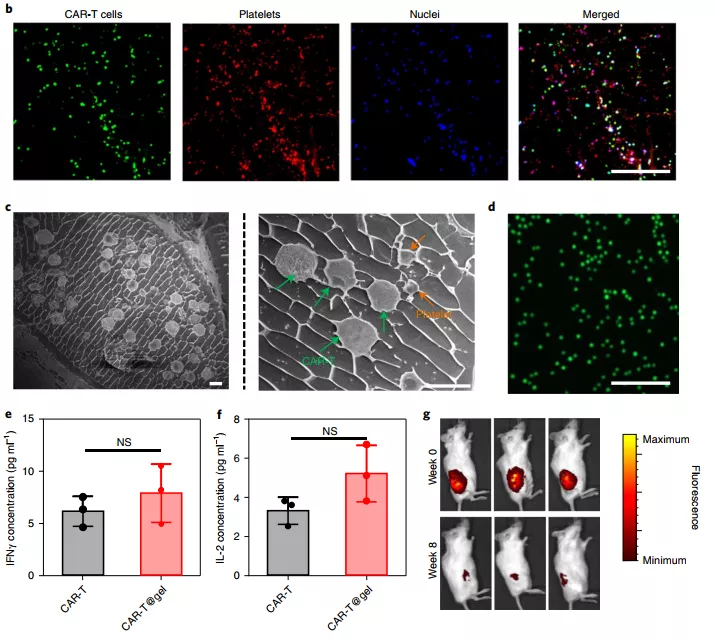
图片来源:Nature Biomedical Engineering
体外 CAR-T-P-aPDL1@gel 抗肿瘤作用
首先,研究人员检测了被包裹在水凝胶中的 CAR-T 细胞和血小板的释放,结果表明 CAR-T 细胞和血小板都是持续释放的。96 小时后,几乎所有的血小板都被释放,而 CAR-T 细胞的释放只有 50%。血小板的快速释放可能是由于它们在水凝胶内明显的运动,血小板的平均迁移距离是 CAR-T 细胞的四倍。
接下来,他们使用体外共培养实验评估了水凝胶内 CAR-T 细胞的抗肿瘤活性。结果发现,72h 后,WM115 黑色素瘤细胞和 T 细胞的百分比在 T@gel 和 T-platelet@gel 两种水凝胶中均无显著变化。相比之下,在水凝胶中携带 CAR-T 细胞时 (CAR-T@gel), 黑色素瘤细胞的百分比下降 12.7±5.8%,T 细胞的百分比上升 76.8±7.7%;而当 CAR-T 细胞与 P-aPDL1 结合后 (CAR-T-P-aPDL1@gel),黑色素瘤细胞的比例进一步降低,同时其释放 IFNγ、IL-2 和细胞因子水平进一步升高。
总的来说,这些数据的证明了 CAR-T 细胞和 P-aPDL1 的结合在体外表现出更高的 T 细胞活化和细胞因子释放能力。
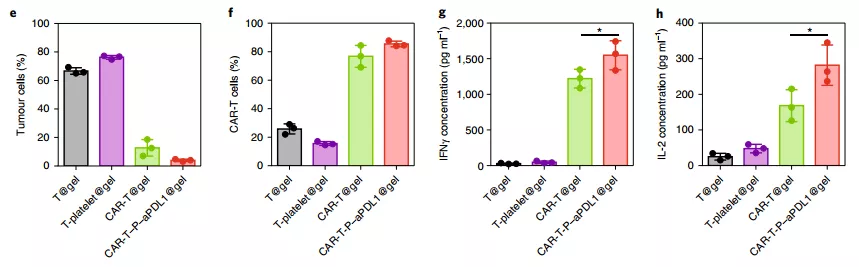
图片来源:Nature Biomedical Engineering
CAR-T-P-aPDL1@gel 的体内抗肿瘤效果
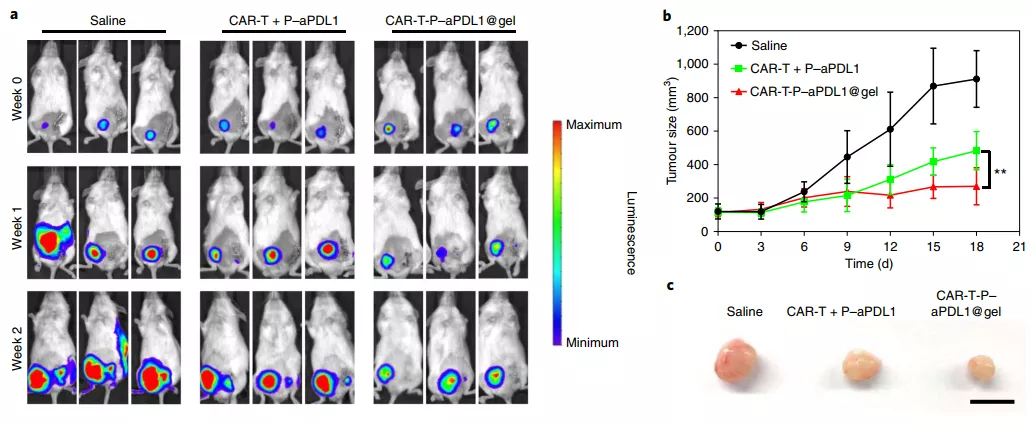
随后,为了验证 CAR-T-P-aPDL1@gel 的体内抗肿瘤作用,在免疫缺陷小鼠皮下接种荧光素标记的 WM115 黑色素瘤细胞。如下图所示,生理盐水组和 T-platelet@gel 组治疗效果可忽略不计。然而,用带有或不带有 P-aPDL1 的游离 CAR-T 细胞治疗的小鼠只能获得中等的抗肿瘤作用,而用 CAR-T@gel 联合 P-aPDL1 治疗的小鼠显示出较强的抗肿瘤作用。令人惊讶的是,CAR-T-P-aPDL1@gel 甚至比 CAR-T@gel 联合 aPDL1 表现出更高的抗肿瘤活性。肿瘤体积的直接测量显示,在第 3 周使用 CAR-T-P-aPDL1@凝胶治疗的小鼠,其肿瘤明显小于其他治疗组。
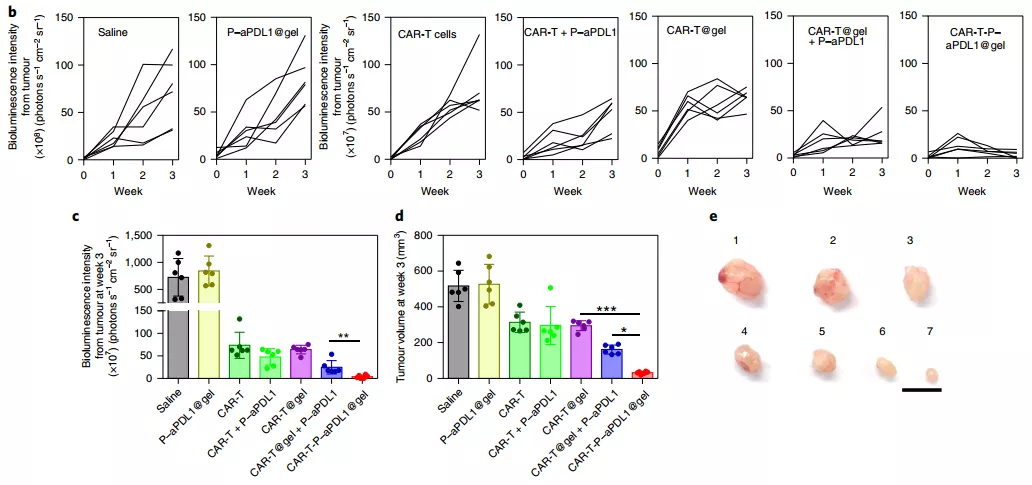
图片来源:Nature Biomedical Engineering
体内 CAR-T 增殖和体外治疗效果
为了研究 CAR-T-P-aPDL1@gel 显著抗肿瘤疗效的潜在机制,研究人员用荧光素酶标记 CAR-T 细胞,以追踪它们在体内的持久性,结果发现,装载在水凝胶中的 CAR-T 细胞的生物荧光持续存在,与其他治疗组相比,增加了超过三倍。此外,体内成像也监测到了 CAR-T 细胞的长期存在。肿瘤内细胞因子的水平高低也进一步证明 CAR-T 细胞在遇到抗原后局部释放 IFNγ 和 IL-2。
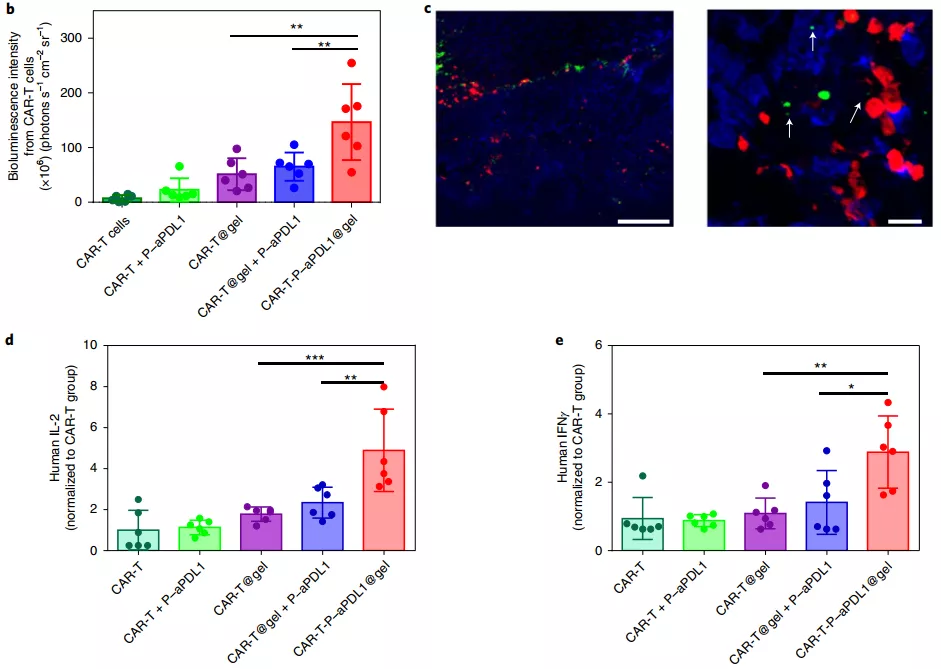
图片来源:Nature Biomedical Engineering
最后,为了研究通过 CAR-T-P-aPDL1@gel 在肿瘤局部传递的 CAR-T 细胞是否会引起全身的肿瘤保护,他们建立了双肿瘤模型,也就是将肿瘤细胞植入免疫缺陷小鼠的两侧。当肿瘤大小达到 100mm3 左右时,对右侧肿瘤进行手术,并植入水凝胶。结果发现,CAR-T-P-aPDL1@凝胶显示出一种剥离效应,导致对侧肿瘤生长受到抑制。在机制层面,研究人员发现手术切除后,肿瘤内良好的趋化因子环境和 CAR-T 细胞的再循环结合在一起,通过局部传递支持了对远处肿瘤生长的控制。
图片来源:Nature Biomedical Engineering
研究总结
综上所述,该团队开发了一种生物可降解的水凝胶储层,可作为体内储存 CAR-T 细胞和 P-aPDL1 的一个蓄水池,可以在手术切除肿瘤后浓缩并逐渐释放。此外,与抗 PDL1 阻断抗体 (aPDL1) 结合的人血小板也被包裹在水凝胶中,以阻断 PD1/PDL1 通路。手术后的炎症会触发血小板的激活,进而释放 aPDL1 抗体,使之与肿瘤细胞结合并阻断 PDL1。因此,这种新型水凝胶创造了一个有利的环境,使得 CAR-T 细胞可以在手术后清除残留的肿瘤细胞并防止肿瘤复发。后续体内外的实验也均证实了其保护 T 细胞免于衰竭及抗肿瘤的活性。
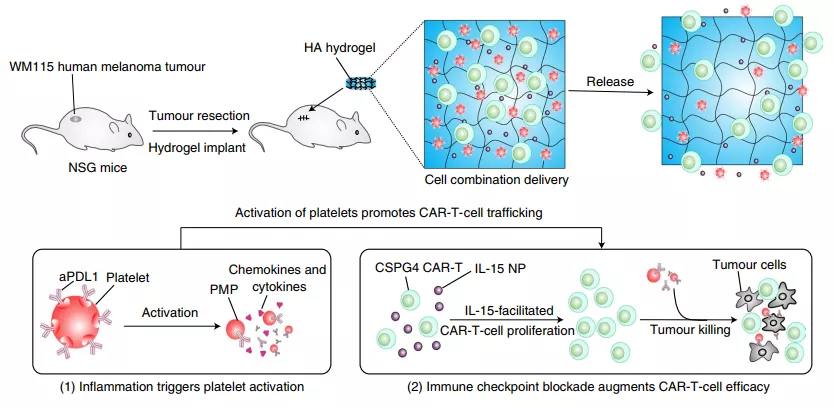
图片来源:Nature Biomedical Engineering
本周推荐:
美少女福音!Science 重磅报道,他们率先实现皮肤无疤痕愈合
眼看它就要封神了...Science 报道烟酰胺可增强胰岛素敏感性、促进肌肉重塑
参考资料
1、Quanyin Hu, et al. Inhibition of post-surgery tumour recurrence via a hydrogel releasing CAR-T cells and anti-PDL1-conjugated platelets. Nature Biomedical Engineering (2021).
2、Lukianova-Hleb, E. Y. et al. Intraoperative diagnostics and elimination of residual microtumours with plasmonic nanobubbles. Nat. Nanotechnol. 11,525–532 (2016).
3、Demicheli, R., Retsky, M. W., Hrushesky, W. J. & Baum, M. Tumour dormancy and surgery-driven interruption of dormancy in breast cancer: learning from failures. Nat. Rev. Clin. Oncol. 4, 699–710 (2007)