高脂饮食的危害又添实锤!用这种方式悄悄影响你的心脏,一种肠炎
丁香学术
708
导读
高脂肪饮食通常与心血管疾病有关,部分原因是高脂肪饮食中富含胆碱,而胆碱会被肠道微生物转化为三甲胺(Trimethylamine, TMA)。TMA 在肠道中被吸收后转运到肝脏中,进而被氧化为 TMAO(Trimethylamine N-oxide),TMAO 则是一种促进动脉粥样硬化的代谢产物。不过,TMAO 生成途径中仍然存在一个关键但尚未探索的难题:高脂肪饮食下宿主生理和微生物群落之间的相互作用是如何影响 TMAO 产生的?
专性厌氧梭菌科(厚壁菌门)和兼性厌氧肠杆菌科(变形菌门)中普遍存在产生 TMA 的调控基因,并且变形菌门在高脂肪饮食个体的粪便中大量增加。除了改变微生物群的组成,高脂肪饮食还可以改变宿主的生理功能,因为饱和脂肪酸通过诱导线粒体产生过氧化氢而损害线粒体功能。
值得注意的是,在结肠中,线粒体对氧的高消耗对维持上皮细胞的缺氧状态至关重要,这维持了专性厌氧细菌的优势,同时抑制兼性厌氧肠杆菌科的生长。但是,高脂饮食与肠道微生物以及由此而诱导产生的 TMAO 之间的关系及内在的分子机制等都还是未知的。
近日,美国范德比尔特大学医学中心微生物学和免疫学系的研究团队在国际顶尖期刊 Science 发表了一篇题为 High-fat diet–induced colonocyte dysfunction escalates microbiota-derived trimethylamine N-oxide 的文章。
该研究借助通过饮食诱发肥胖的小鼠模型,他们发现长期的高脂肪饮食会通过改变肠上皮生理功能而加速大肠杆菌的胆碱分解代谢,最终导致循环中的 TMAO 增加,进而影响机体健康。

图片来源:Science
主要研究内容
高脂肪饮食损害肠上皮的正常生理功能
首先,研究人员将不携带内源性肠杆菌科的小鼠分为两组,分别进行低脂肪或高脂肪饮食饲养(10% 或 60% 脂肪),结果发现高脂饮食会导致粪便中大肠杆菌的携带量显著增加,这也反映了高脂肪饮食的确能够驱动肠杆菌科的丰度。
此外,高脂肪饮食还与肠上皮细胞线粒体活性降低有关,从结肠上皮细胞的 mRNA 中线粒体标志物表达减少可以证实这一点,同时,三磷酸腺苷和丙酮酸脱氢酶水平的降低也可以佐证。
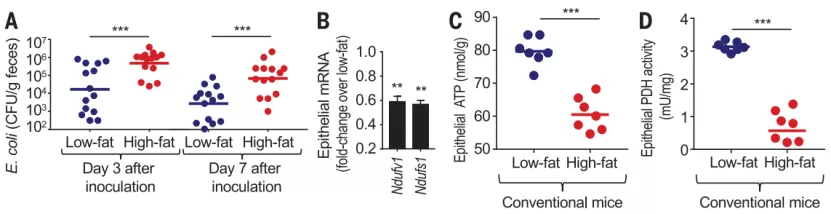
图片来源:Science
接下来,为了研究高脂肪饮食损害的线粒体生物能是否与结肠上皮细胞氧合增加有关,他们使用外源性缺氧标记物哌莫硝唑观察上皮细胞的缺氧状况,染色结果显示,低脂饮食小鼠的结肠上皮表面仍然是缺氧的,但高脂饮食小鼠的结肠上皮表面的缺氧状态被破坏。这些结果表明触发上皮细胞氧化状态变化的机制是由饮食结构驱动的。
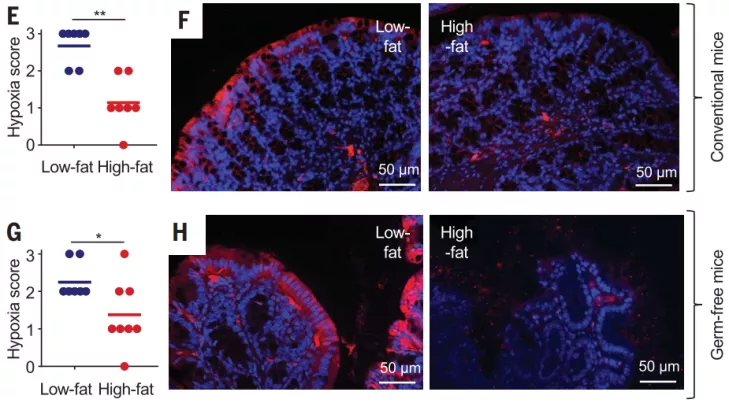
图片来源:Science
大肠杆菌胆碱分解代谢需要硝酸盐的存在
肠道中有害底物的分解代谢需要呼吸电子受体的存在,如四硫代酸盐、硝酸盐或氧气等。为了探究高脂饮食介导的宿主呼吸链电子受体的增加是否会促进大肠杆菌生成 TMA 这一问题,他们使用了大肠杆菌菌株 MS 200-1,该菌株带有 cutC 基因,可将胆碱转化为 TMA、醋酸盐和乙醇。
当在模拟肠道环境的条件下培养大肠杆菌菌株 MS 200-1 时,硝酸盐和低氧环境均可以增强 cutC 的表达,帮助 MS 200-1 利用胆碱作为碳源进行生长。这些体外实验结果表明,高脂饮食诱导下宿主硝酸盐浓度的增加将导致大肠杆菌胆碱分解代谢能力的升高。
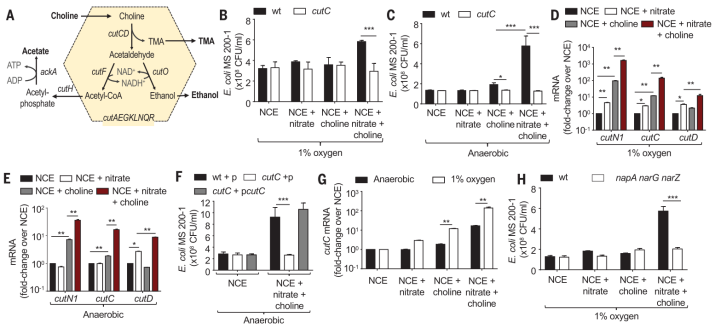
图片来源:Science
为了在小鼠体内验证上述的结论,他们在小鼠的饮食中添加了 1% 的胆碱,即对小鼠分别饲喂添加胆碱的低脂饮食(10% 脂肪)和添加胆碱的高脂饮食(60% 脂肪),然后再接种大肠杆菌菌株 MS 200-1。
通过比较 AG(Aminoguanidine Hydrochloride, 一氧化氮合酶抑制剂)处理组和对照组,作者发现,AG 处理小组的大肠杆菌丰度在高脂和低脂饮食条件下无显著差异,而在对照组中,高脂饮食条件下小鼠的大肠杆菌丰度更高,上述结果表明高脂饮食介导的宿主来源的硝酸盐的增加,会促进大肠杆菌分解代谢胆碱。
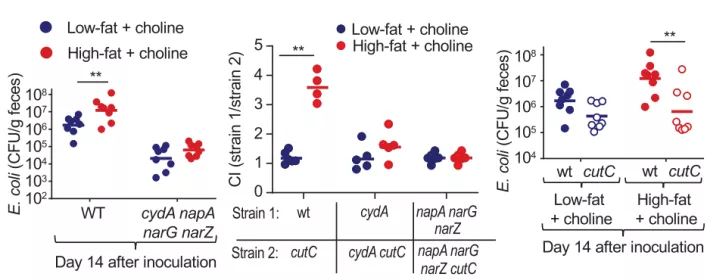
图片来源:Science
肠上皮生理功能的恢复能够抑制 TMAO 水平的持续增加
随后,为了研究大肠杆菌胆碱分解代谢是否会改变循环中 TMAO 的水平,他们对无菌小鼠接种大肠杆菌 ms200 -1 野生型或同基因突变体。结果发现,与其他组相比,接种野生型大肠杆菌组小鼠血浆中的 TMAO 水平显著升高,这一结果证实了高脂肪饮食可促进大肠杆菌体内胆碱分解代谢的观点。
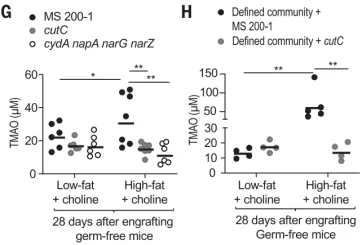
图片来源:Science
最后,他们使用 5-氨基水杨酸(5-ASA)靶向过氧化物酶体增殖物激活受体 γ(PPAR-g),5-氨基水杨酸是 PPAR-g 激动剂,可特异性激活肠上皮中的线粒体生物能,而 PPAR-g 是一种维持结肠上皮细胞缺氧并抑制 Nos2 表达的核受体。结果发现,在胆碱补充高脂肪饮食的小鼠中,5-ASA 处理恢复了上皮细胞缺氧状态,并降低了从结肠上皮细胞分离的 mRNA 中 Nos2 的表达。
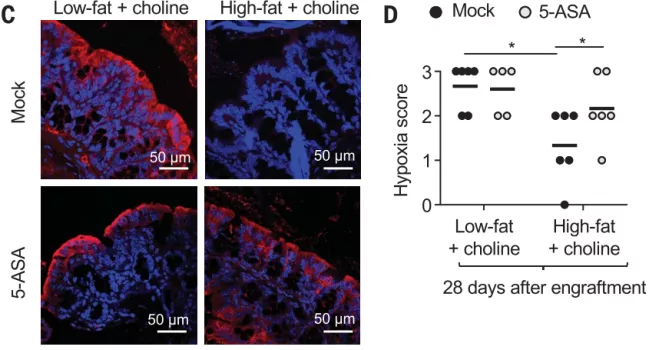
图片来源:Science
此外,5-ASA 处理的小鼠还降低了胆碱高脂饮食小鼠循环中 TMAO 的增加。
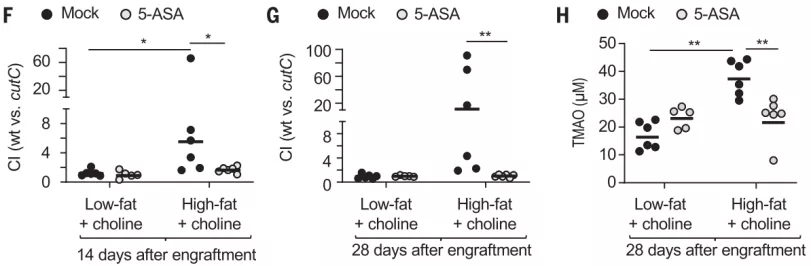
图片来源:Science
结语
综上所述,这项研究表明,高脂肪饮食会导致炎症,并损害动物模型中的肠道上皮细胞,从而消除了上皮细胞缺氧的状态。高脂肪饮食会损害线粒体的功能,导致肠道细胞产生更多的氧气和硝酸盐。
这些因素反过来又刺激了有害的肠杆菌微生物(如大肠杆菌)的生长,并促进了代谢物 TMA 的产生。肝脏将 TMA 转换为 TMAO,这与动脉粥样硬化的风险增加有关。
研究人员证明,目前批准用于治疗结肠炎的药物 5-ASA 可以恢复肠道上皮细胞的功能,并抑制了动物模型中 TMAO 的增加。该文章的通讯作者 Byndloss 说:「这有可能防止与高脂肪饮食相关的负面结果,5-ASA 可以与益生菌一起使用,既能恢复健康的肠道环境,又能提高有益的微生物水平。」
此外,Byndloss 和她的团队计划将他们的研究扩展到心血管疾病的动物模型当中,并在探索宿主-微生物关系与多种疾病发展的联系。
题图来源:站酷海洛
参考文献:
1. Yoo et al., High-fat diet–induced colonocyte dysfunction escalates microbiota-derived trimethylamine N-oxideScience 373, 813–818 (2021).
2. Z. Wang et al., Nature 472, 57–63 (2011).
3. Y. Litvak, M. X. Byndloss, A. J. Bäumler, Colonocyte metabolism shapes the gut microbiota. Science 362, eaat9076 (2018).