3 分钟 get 大热的 PD-L1 免疫疗法
丁香园
2015 年 12 月,美国前总统吉米 · 卡特在接受了靶向放疗和免疫抗癌新药 Keytruda(PD-1 抑制剂,MSD)治疗后,医生发现,在他的脑部磁共振扫描图像中,此前出现的黑色素瘤(Melanoma)与新生的癌细胞都彻底消失了。这种治疗效果引起了业内的广泛关注,也彰显了 PD-1/PD-L1 免疫疗法在肿瘤治疗中的巨大潜力。
PD-1/PD-L1 是什么?
1992 年,日本京都大学 Tasuku Honjo 教授首次报道并克隆了 PD-1 基因[1]。
1999 年,华人学者陈列平教授报道了 B7 家族的第三个成员 B7-H1(即日后的 PD-L1)[2]。
2000 年,Tasuku Honjo 教授等人证明了 PD-L1 能与 PD-1 结合,进而抑制 T 细胞的增殖与细胞因子的分泌,负调控淋巴细胞的激活,从此,B7-H1 被正式命名为 PD-L1(陈列平教授则继续使用「B7-H1」命名)[3]。
2003年,陈列平教授第一次成功地使用 PD-L1 封闭抗体联合 T 细胞回输技术治愈了约 60% 的头颈癌小鼠[4]。
2014 年 12 月,首个应用于肿瘤治疗的抗 PD-1 抗体药 Keytruda(MSD)获 FDA 批准,三个月后,Opdivo (BMS)获 FDA 批准(Opdivo 也将成为首个在中国大陆上市的 PD-1 单抗药)。
2016 年 FDA 批准首个抗 PD-L1 的抗体药 Tecentrip(Roche)应用于肿瘤治疗(图 1)。
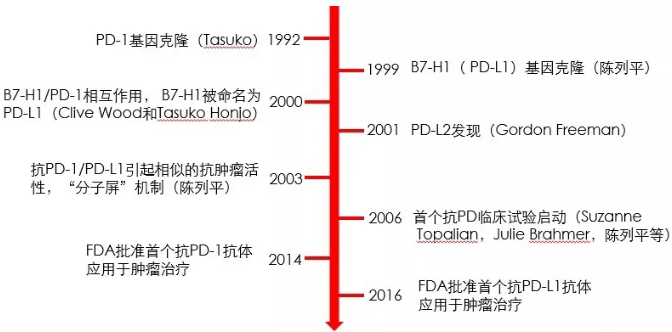
图 1:PD-1/PD-L1 发展历程中的部分关键节点
PD-1/PD-L1 工作机制是怎样的?
PD-1/PD-L1 免疫检查点抑制剂在癌症研究中倍受瞩目,而恶性肿瘤的十大重要标志之一就是免疫检查点参与的免疫逃避。
PD-1 与其配体 PD-L1 的结合会下调 T 细胞的活性,阻断体内免疫系统对肿瘤细胞的攻击。PD-1/PD-L1 单克隆抗体是目前临床研究与应用最广泛的免疫检查点抑制剂。
当阻断 PD-1 与 PD-L1 的结合时,负调控信号被阻断,T 细胞恢复活性,杀死肿瘤细胞,在多种癌症治疗过程中显示出卓越的疗效[5]。
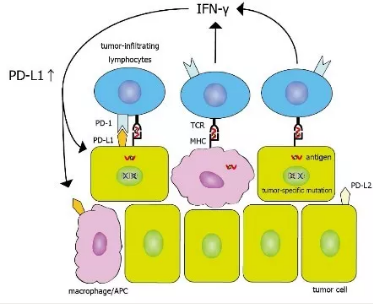
图 2:PD-1/PD-L1 抑制剂的工作机理[6]
TCR, T cell receptor; MHC, major histocompatibility complex;
APC, antigen presenting cell
具体如图 2 所示,PD-1 的生理功能简单来说就是免疫刹车:
当免疫系统发现外来入侵者,启动免疫攻击时,为了不误伤自身,同时也启动免疫「刹车」。因此,T 细胞被激活时会表达 PD-1,而攻击性炎症因子 IFN-γ 会刺激细胞表达它的受体 PD-L1 和 PD-L2。
当 PD-1 与它的受体结合,就会抑制免疫反应。但是狡猾的肿瘤细胞在与免疫系统的战斗中,逐渐学会了这一招:通过大量表达 PD-L1 实现免疫逃逸。而 PD 抑制剂,包括 anti-PD-1 或者 anti-PD-L1 单抗药,就是通过阻断 PD-1 与其受体的结合,重新激活免疫系统来攻击肿瘤细胞[6]。
为何要检测 PD-L1?
PD-L1 组成性低表达于抗原递呈细胞(APCs)、非造血细胞如血管内皮细胞、胰岛细胞以及免疫豁免部位(如胎盘、睾丸和眼睛)。炎性细胞因子如 I/II 型干扰素、TNF-α和 VEGF 等均可以诱导 PD-L1 的表达[7]。
大量研究表明,在癌症患者的样本中,PD-L1 在很多情况下呈现高表达趋势[8]。在肿瘤微环境中,免疫抑制分子如 PD-L1 的高表达意味着当 PD-1/PD-L1 的结合被阻断时,患者更可能从中获益。因此对于癌症患者而言,如果 PD-L1 的表达水平较高,则使用 PD 抑制剂的疗效更为显著。目前的临床结果也印证了这一推测(图 3,4)。正因为如此,PD 抑制剂药物的使用,大多需要伴随 / 补充诊断检测 PD-L1 的表达,而 PD-L1 的检测方法主要是基于蛋白水平的免疫组化。
那么为什么不选择检测 PD-1 呢?在使用抗 PD-1 抑制剂的条件下,PD-1 水平通常不会发生变化,此时检测 PD-L1 可以反映没有结合的 PD-L1 水平,从而反映药物的作用程度。而 PD-L1 在多种细胞表面表达,包括恶化的肿瘤细胞表面,所以高表达 PD-L1 的肿瘤细胞预示其免疫逃逸能力强,当使用 PD 抑制剂时可能更有效。当然也有报道,肿瘤浸润的 T 细胞中 PD-1 对于无进展生存期(PFS)也有一定的指示意义[10]。
实例 1
关于 OPDIVO(nivolumab,PD-1 单抗药),BMS 进行了将其应用于 NSCLC(非小细胞肺癌)的临床项目(图 3)。
数据表明:PD-L1 的表达与 OPDIVO 的疗效呈一定的正相关性。应用其伴随诊断抗体 28-8 (ab205921, Abcam) 的 IHC 染色信号越强,则使用 OPDIVO 所获得的总体生存率(OS)越高。PD-L1 阳性表达组(≥1%)的总体生存率较之 PD-L1 阴性表达组(<1%)有显著提升。当 PD-L1 的表达水平更高时(≥5%,≥10%),相应患者的死亡风险分别降低 57% 和 60%。而对于 Docetaxel(化学抗癌药)的使用,PD-L1 的表达与总体生存率并无显著相关性[9]。
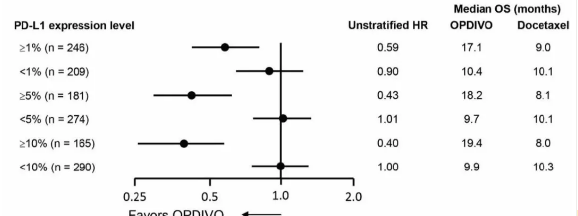
图 3:NSCLS 患者对 OPDIVO 药效(总生存期 OS)与 PD-L1 的表达呈正相关[9]
实例 2
2017 年马里兰大学 Greenebaum 癌症中心进行了针对多发性骨髓瘤(MM)的三联免疫治疗研究[10],即 PD-1 单抗药,pomalidomide(免疫调节药物)及低剂量地塞米松的联合用药。研究使用 PD-L1 抗体 28-8 (ab205921, Abcam) 对病人的组织样本进行 IHC 染色,根据信号强度分为阳性与阴性 / 弱阳性两组,并观察两组病人在联合用药下的治疗反应(sCR/CR,得到了严格的完全缓解 / 完全缓解;VGPR,有非常好的部分缓解)。PD-L1 阳性组 vs 阴性 / 弱阳性组的治疗反应(sCR/CR + VGPR)为 54% vs 20%。
同时,研究对骨髓浸润的淋巴细胞中 PD-1(ab52587,Abcam)的表达水平进行检测,发现其与客观缓解率(ORR)并无明显的相关性。目前,PD-L1 表达水平的检测已经写进了肺癌 NCCN 指南。此外,一些临床试验的研究显示,在其它肿瘤中,PD-L1 的表达水平与患者使用免疫检查点抑制剂的疗效亦存在相关性[8,10]。
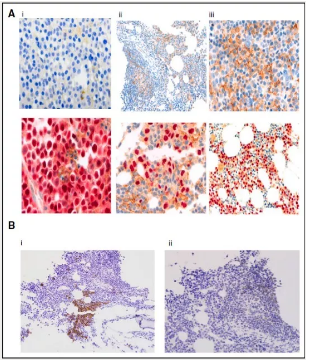
4:PD-1 和 PD-L1 的免疫组化分析[10]
(A) MM 患者组织样本中 PD-L1 的表达水平检测 (DAB),1% (i), 1% to 49% (ii), 50% (iii),下方为相应的骨髓瘤细胞标志物 MUM1 的组织染色(ACE)(B) T 淋巴细胞中 CD3 染色 (i) 和 PD-1 染色 (ii)。
适用于 IHC 检测的 PD-L1 抗体有哪些?
目前 FDA 批准了 2 款 PD-1 抑制剂(Opdivo 和 Keytruda)和 3 款 PD-L1 抑制剂(Tecentriq、Imfinzi、Bavencio)上市。同时,也分别批准了相应的伴随 / 补充诊断抗体:28-8、22C3、SP142、SP263(克隆号,其中 Bavencio 无指定 PD-L1 诊断抗体)这 4 个 PD-L1 单抗,用于 PD-L1 表达水平的 IHC 检测[11]。
目前在 NSCLC(非小细胞肺癌)治疗中,每个 PD 抑制剂都开发了相应的特异性 PD-L1 免疫组化(IHC)检测方法,以评估 NSCLC 中恶性肿瘤和 / 或免疫细胞上的 PD-L1 表达水平。前文已经提到 OPDIVO(nivolumab,BMS) 在 NSCLC 患者的治疗中获得了极大的成功,且疗效与 PD-L1 的表达水平呈现相关性,证明了补充诊断的重要性[9]。
下表列出了 FDA 以及在欧洲和日本批准的 PD-L1 单抗[12]:
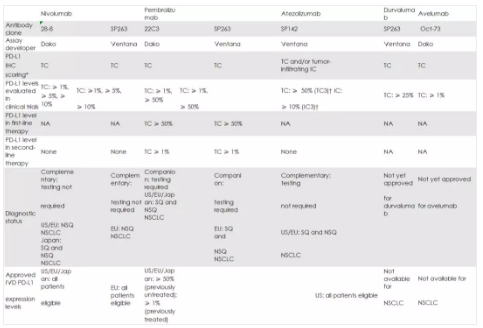
bbreviations: IC, immune cells; IVD, in vitro diagnostic; NA, not applicable; NSCLC, non–small-cell lung cancer; NSQ, non-squamous; PD-L1, programmed death-ligand 1; SQ, squamous; TC, tumor cells.
†TC0<1%, TC1 1% to<5%, TC2 5% to , 50%, <50%, TC3 ≥50%, IC0<1%, IC1 1% to<5%, IC2 5% to , 10%, IC3≥ 10%.
表 1:用于 NSCLC IHC 诊断的 PD-L1 抗体[12]
目前 PD-L1 检测仍然存在一些问题,包括:


NBF, neutral buffered formalin; TC, tumor cell; UC, urothelial carcinoma,From here
除了染色技术外,抗体的特异性也尤其重要。而目前我国 PD-L1 的检测比较混乱:

这些都导致患者检测 PD-L1 的价值降低。因此,选择合适的抗体至关重要。
推荐选择经 FDA 批准的克隆号 28-8、SP142,用于 IHC、WB、流式检测。