为什么得不到 IL-1β 结果?这 5 个关键点你要知道
丁香园

正文
炎症等免疫研究中 IL-1 家族的成员是重要的研究对象。这些促炎症和抗炎症因子在有机体应对病原感染和损伤时扮演了重要作用。IL-1β 有其自身鲜明的特点,实验前需要多了解。下面让我们来一一解读。
1. 靶标生物学特点
IL-1β 是 IL-1 家族众多成员中研究的最为深入的成员。包括免疫细胞(如单核细胞和巨噬细胞)在内的很多细胞都可以产生并分泌。IL-1β 的释放大致分为 3 个步骤:i)无活性前体的产生;ii)前体的成熟活化;iii)活化蛋白向胞外的分泌。众多刺激都会诱导这个过程,可分为病原相关分子模式(pathogen-associated molecular patterns,PAMPs)和损伤相关的分子模式 (damage associated molecular patterns, DAMPs)。通过识别侵入病原的 PAMPs(如 LPS,脂磷壁酸,鞭毛蛋白等)和内源的损伤或死亡细胞的 DAMPs(如 ATP,尿酸结晶,S100 等),胞膜上的 Toll 样受体(TLR)和胞内的 Nod 样受体(NLR)被激活。细菌的感染通常伴有组织的损伤释放的宿主内源成分。因而 PAMPs 和 DAMPs 会同时刺激 IL-1β 的释放。这个前体产生和成熟的过程受到多重调控。
基础特征
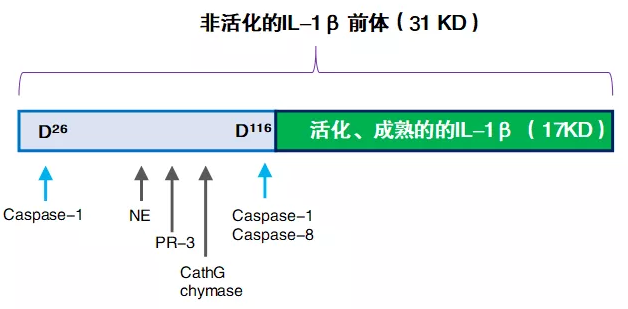
图 1. IL-1β 及活化裂解事件概览
IL-1β 初始产生时是一个 31KD 的前体,接着裂解活化产生 17KD 的成熟形式,这样才可以与 IL-1 受体结合。Caspase-1 是主要的裂解蛋白,其可以在 IL-1β 上两个位点进行切割(D26 位和 D116 位),从而得到一个小一点的 26KD 蛋白(功能未知)和主要的 17KD 成熟形式蛋白。此外,其他的一些蛋白酶如 PR-3,Neutrophil elastase 等也能切割 IL-1β。
IL-1β 的分泌
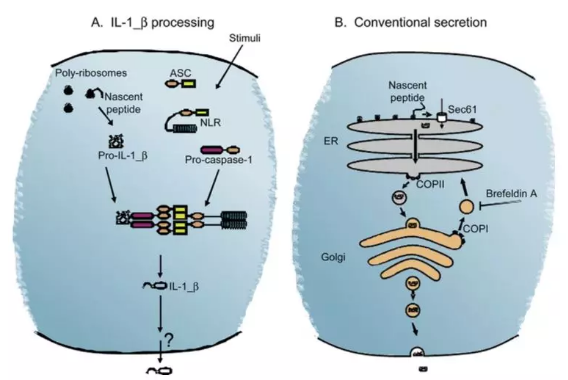
图 2. 分泌蛋白的经典分泌途径
早期的研究发现,IL-1β 蛋白的 N 端并没有大多数分泌蛋白具有的疏水信号区域,其是属于无导肽(leaderless)分泌蛋白。类似的蛋白还有 IL-18,IL-33,IL-16,FGF1, HMGB1 等。除了 IL-1ra 以外,IL-1 家族成员如 IL-1β 都不是借助经典的蛋白分泌途径(ER-Golgi 途径)进行分泌(图 2)。因此使用这个途径的常用阻断剂如 Brefeldin A(抑制蛋白从内质网到高尔基体)或 Monensin(抑制高尔基体内的蛋白运输)来处理细胞,无法达到富集胞内 IL-1β 的目的。研究显示,它的分泌借助了如下方式(图 3):A)外泌体的胞吐作用;B)分泌性溶酶体的胞吐作用;C)质膜上微泡的脱落; D)借助质膜上的特殊转运体。
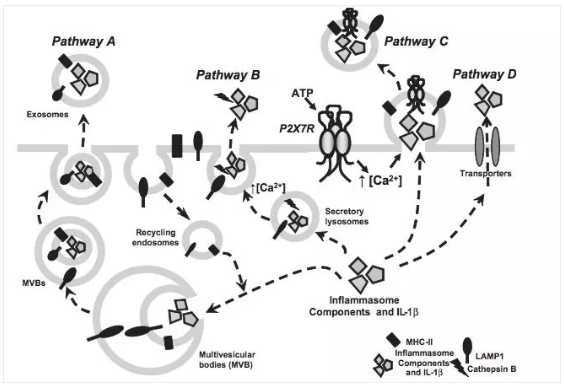
图 3. IL-1β 分泌的可能机制概览
如下图中结果显示,活化的 IL-1β 信号绝大部分在经过刺激处理的 THP-1 细胞培养基组中,而不是细胞裂解物组里面。
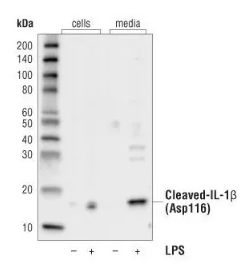
图 4. 刺激 THP-1 细胞检测活化的 IL-1β 表达
要点:因此若想检测培养细胞的活化 IL-1β,需要检测富含这些蛋白的细胞培养基。
2. 靶标刺激条件
IL-1β 的产生和加工
通常情况下,IL-1β 的 mRNA 或蛋白都不会在单核细胞、巨噬细胞、树突细胞中组成型表达。对于 IL-1β 的成功释放需要两步的信号刺激:i)mRNA 的表达和后续的翻译需要来自病原的刺激(PAMPs, 如 LPS 等);ii)前体快速有效加工和释放需要更进一步的刺激 DAMP(如 ATP)或 PAMPs(图 5)。
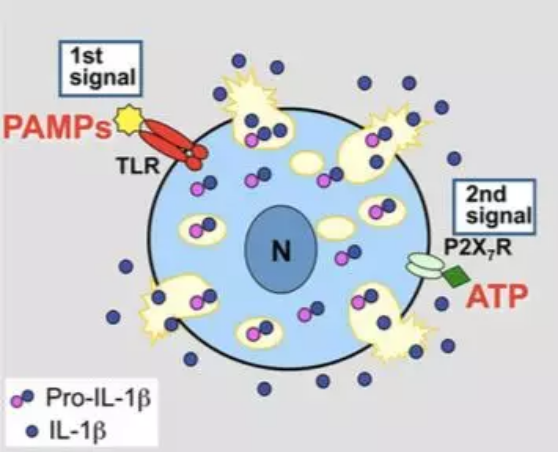
图 5. IL-1β产生、加工和释放过程概览
研究发现,若没有第二步的刺激,细胞只会非常慢地产生极少量的活化 IL-1β。在这个过程中,加工裂解 IL-1β 的 Caspase-1 起到了重要的作用。而 Caspase-1 的激活需要炎性小体的形成和激活。DAMP(如 ATP)或 PAMPs 会诱导炎性小体的形成。基于以往的研究,常见的影响 IL-1β 有效加工的刺激见下表。
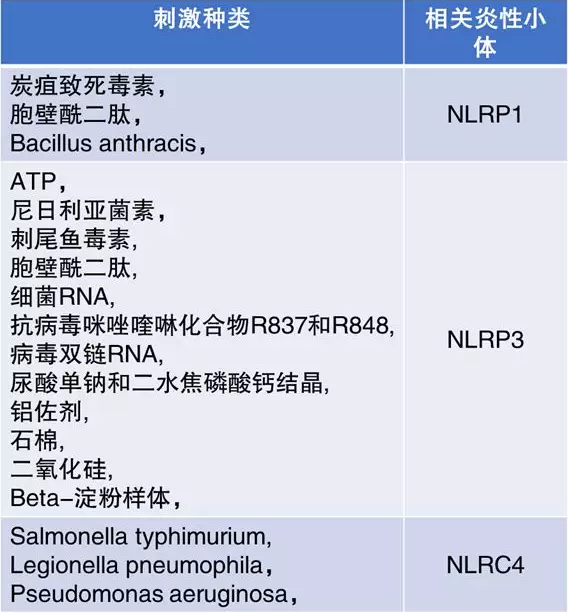
表 1. 影响 IL-1β 加工的相关炎性小体及刺激
在下图的 IL-1β 检测中,对未处理 (-) 或用 LPS(50 ng/ml,4 小时)处理,随后用尼日利亚菌素(15 μM,45 分钟)处理 (+) 的小鼠骨髓衍生的巨噬细胞的细胞提取物和培养基进行分析。可以看到在 LPS + 尼日利亚菌素处理的细胞培养基组别中,活化的 IL-1β 信号最强。对于不同研究背景及样本的情况下,研究者需要综合考虑众多因素如:细胞类型、种属、样本来源、PAMPs 和 DAMPs 的浓度、刺激的种类及时长、细胞微环境、温度和 pH 值、氧化还原平衡、渗透压、培养条件及时间,以便找到最合理有效的刺激条件。
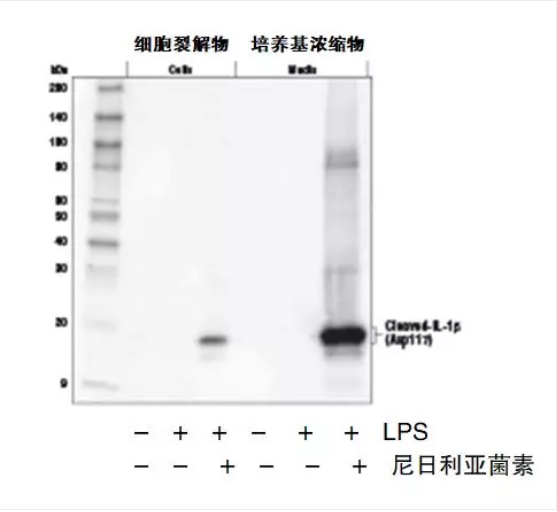
图 6. 不同条件组合刺激小鼠 BMDM 细胞后检测的活化的 IL-1β 表达
要点:通常条件下 LPS+ATP 或尼日利亚菌素可以有效的刺激活化的 IL-1β 的表达。可综合已有文献及预实验来摸索找到合适的条件。
3. 实验步骤
基于上述提及的靶标的特点,那么检测 IL-1β 时除了按照 CST 推荐的抗体使用方法外,还需注意一些细节。
细胞培养基样本的制备
活化的 IL-1β 主要分泌到细胞培养基中,那么需要用丙酮沉淀蛋白。方法如下:
1) 取一份体积培养基和 4 份体积的冷的丙酮混合, -80 度下过夜。
2) 10,000 g 离心 10 分钟。
3) 小心去除上清,期间防止取到蛋白沉淀。不要使沉淀干燥过度,否则后续不容易溶解。
4) 室温敞开管子放置 30 分钟以让丙酮挥发完全。
5) 1X SDS 上样缓冲液溶解沉淀,然后 WB 检测。
WB 步骤中需注意处
1) 使用 16.0%Tris-Glycine 胶或 4-20% 的梯度胶电泳。
2) 对于活化的 IL-1β,转膜时不要转膜过度而导致丢失。建议使用 0.2um 孔径的膜。 若是湿转,CST 一般使用条件是 70V/250 mAmps ,2 hours; 若是半干,使用 25V,7 分钟。
3)其它细节参见相应 CST 的各个 IL-1β 抗体产品页面上详细步骤。
要点:富集培养基中活化的 IL-1β,电泳 16% 胶,0.2 um 膜。
4. 样本因素
除此以外,还有些实验中会遇到但容易被我们忽略的问题。
支原体污染
Ekaterina 等人的研究显示支原体污染的 THP-1 细胞,响应 LPS 刺激的能力大幅受到影响,众多免疫相关基因表达受到抑制,其具体细节和注意事项可拨打 CST 免费技术电话:4006-GreatQ(473287)。。
细胞传代
细胞的基因表达和形态在低传代和传代较长的细胞中会有差别。因此传代时间较长的细胞系不能作为代表原始来源组织的模型。O’Driscoll 比较了低传代的(18 次)和较长传代(40 次)的 MIN-6 细胞。发现包括调节分泌,粘附和增殖的众多基因 mRNA 表达发生显著变化(图 7)。约 1,000 种基因的表达在这两种不同传代细胞存在表达差异。
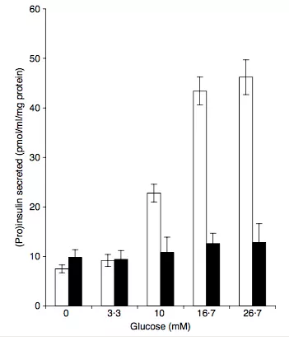
图 7. 低传代(白色柱)与高传代(黑色柱)细胞在葡萄糖刺激后胰岛素分泌水平的差异
为了得到可靠的结果,不要用传代太久的细胞来做实验。每次复苏细胞后记录传代次数。结合细胞类型和研究背景等特点,来决定你的研究中具体多少代传代是可以接受的。另外,实验前,培养的细胞不能太满,传代和实验时应使用合理生长密度的细胞。
要点:防止支原体污染,细胞不要过度传代。
5. 用对抗体
可靠的抗体是实验成功的关键。
一个蛋白在细胞中的生命周期中的时空分布、基因表达调控情况、生命周期都是需要考虑的。结合这些靶标自身的特点,使用正确合适的方法,借助可靠的试剂并排除实验以外的干扰因素来进行实验,才能得到可重复的实验数据。那么对于实验的样本,也要保证处于最佳状态,防止非实验因素带来的假象。实验开始前,把这些重要的问题弄清楚并处理好,实验就会事半功倍,成功的几率大大增加。实验遇到问题时,掌握分析和解决问题的思路和方法,也会让问题迎难而解。
参考文献
1.J Endocrinol. 2006 Dec;191(3):665-76.
2. Immunobiology. 2009;214(7):543-53.
3. PLoS Pathog. 2010 Feb 26;6(2):e1000661.
4. PLoS One. 2010 Mar 25;5(3):e9900.
5. Cytokine Growth Factor Rev. 2011 Aug;22(4):189-95.
6. Front Immunol. 2013 May 24;4:123.
7. Immunity. 2015 Jun 16;42(6):991-1004.
文章来源:CST 中国
题图来源:站酷海洛