4.11 丁香实验科研资讯早报(每日更新)
丁香园
4 月 11 日 丁香实验资讯早报
①《Neuron》摆脱坏情绪!科学家发现了一个关键的新神经通路
加州大学欧文分校的研究人员首次发现导致创伤后应激障碍(PTSD)的关键神经通路不平衡,该通路可以解释一些人是如何重新激活消极情绪记忆的。
这项研究发表于《Neuron》杂志。几十年来,科学家们一直把情感记忆视作一把双刃剑:有些事整体令人难忘,但事件的细节往往是模糊的。缺乏详细的记忆可能导致负面情绪的错误重激活。例如,有人被狗咬了,Ta可能会对各种品种,无论大小的狗都感到焦虑。
理解情绪记忆的本质对治疗创伤后应激障碍(PTSD)和其他精神障碍有影响。
“情感对我们如何生动地记忆经验产生了很强大的影响,”UCI生物科学学院神经生物学与行为学教授、医学院神经学和精神病学教授、学习与记忆神经生物学中心主任Michael Yassa说。“然而,我们在人类身上发现,情绪记忆的影响并非总是积极的。在许多情况下,情绪的觉醒会削弱一个人区分相似经历的能力。”神经的计算对情景记忆至关重要,精神疾病患者很容易因此受到伤害。
这项研究指出,大脑情感中心“杏仁核”与记忆中枢“海马”之间的不平衡交流可能导致人无法区分具有重叠特征的负面经验。另一方面,杏仁核和海马之间的平衡对话,使人能够将重叠的情感体验分离开来,并归类为独特的记忆。
此外,两种脑节律——快(每秒8个周期)α振荡和慢(每秒4个周期)θ节律——在很大程度上调节了杏仁核与海马之间的通信。从杏仁核到海马的α振荡过于复杂,导致类似经验记忆外推错误,同时,两个脑区之间的θ节律平衡,可以促进正确的辨别和准确的回忆。
“杏仁核与海马之间的团队合作就像阴与阳,可能是解开重叠情感体验和克服过度反应的关键,”文章一作Jie Zheng说。
“我们的发现为这种现象提供了一种神经机制解释,并为可能的神经心理治疗,如深部脑刺激、经颅交流电刺激和经颅磁刺激,提供了一个电路级框架,”文章共同通讯作者医学院神经学教授、工程学院生物医学工程教授Jack J. Lin博士说。
我们从7名抗药癫痫患者的植入电极上收集了测量结果,Lin说,电极的放置完全是由于这些患者的临床需要。
原文检索: Multiplexing of Theta and Alpha Rhythms in the Amygdala-Hippocampal Circuit Supports Pattern Separation of Emotional Information
② Nature首次发现:与细胞应激相关的蛋白也会调节细胞分裂
肝癌是全世界造成癌症死亡的第三大杀手,更是有中国特色的一种癌症。诱发肝癌的因素很多,包括病毒、环境和遗传因素的共同作用,然而研究多年,至今科学家们还没有找到治愈肝癌的可靠方法。
来自西班牙CNIC心血管研究中心的研究人员发现参与细胞应激反应的酶可能成为治疗肝癌的新药理学靶点,他们指出p38激酶四种类型之一:p38γ对肝细胞分裂影响重大,参与了肝细胞分裂的起始步骤。
这一研究成果公布在4月10日的Nature杂志上,领导这项研究的Guadalupe Sabio表示,这表明“p38γ可能是治疗肝癌的有效靶点,我们现在正开发这种蛋白质的抑制剂来测试癌症。”
2017年西班牙国家癌症发病率数据显示,每年估计有5862人患上肝癌(4252名男性和1610名女性),这使其成为男性中第7位最常见的癌症,西班牙的肝癌发病率约为每100,000名男性中的12名,每100,000名女性中就有3.5名。
Sabio对p38蛋白家族长期以来都兴趣浓厚,这些蛋白在暴露于压力的细胞中被激活。在Nature最新发表的这项研究中,她的团队已经发现了p38γ在肝脏细胞分裂开始的时候的重要作用。
“p38激酶家族的四个成员非常相似,似乎是重叠或冗余的功能,”Sabio说,“但是,通过与赫罗纳大学的Silvia Osuna等人的合作,经过三维结构的详细分析显示,这四个作用因子中的一个:p38γ也与另一个家族有着密切的相似之处,这个家族就是CDKs,这些蛋白质是众所周知的细胞分裂和细胞周期调节因子,在癌症的发展过程中发挥着重要的作用。”
在实验研究中,研究小组发现CDK2抑制剂也能降低p38γ的活性。研究人员还发现p38γ和CDK2均作用于肿瘤抑制蛋白,该蛋白在细胞周期的调节中起重要作用。
为了检测p38γ是否参与了细胞分裂,文章第一作者,AntoniaTomás-Loba研究了缺乏该酶的化学诱导肝癌小鼠,结果让人激动:“在缺乏p38γ或用抑制剂阻断活性的小鼠中,肝细胞癌的发展减慢了,”Tomás-Loba说。
这些结果“未来可以推进到人类患者。”事实上,这组研究人员与萨拉曼卡大学医院的研究人员合作,已经发现了随着肝纤维化增加的p38γ的量了,肝纤维化是癌症的前步骤,在肝癌患者中出现率很高。
这些结果表明,将来有可能用特异性靶向p38γ的药物治疗这类癌症。p38γ的优势在于这种酶似乎控制着应激反应引起的细胞周期的开始,因此抑制这一过程就不会影响不断增殖的组织。
③ 治疗儿童脑癌的新希望
儿童弥漫性固有桥脑胶质瘤(DIPG),可能会有新的治疗方法。
DIPG是一种破坏性的脑癌,它折磨着幼儿,目前无法治愈。最近在该疾病动物模型中进行的实验已经确定了一种能有效破坏DIPG细胞的实验药物。洛克菲勒的一组科学家刚刚发现了这种有前途的化合物是如何工作的。
该研究发表在PNAS杂志上,表明该药物作用于细胞胆固醇途径,并提示这些途径可能是治疗多种脑癌的有效靶点。
靶向肿瘤
DIPG肿瘤位于脑桥中,脑桥是一个连接大脑和脊髓的高度敏感的结构。手术切除肿瘤实际上是不可能的,因为它会造成致命的脑损伤。虽然辐射可以暂时减轻症状,但癌症不可避免地会增长,平均存活率不到一年。也就是说:迫切需要新的方法来治疗患有此病的儿童。
2014年,C.David Allis的实验室,Joy和Jack Fishman教授以及纪念斯隆凯特林癌症中心(MSKCC)神经外科主任Viviane Tabar进行了合作,取得了可喜的进展。研究小组发现,一种叫做MI-2的化合物可以阻止小鼠DIPG模型中的肿瘤生长。这种药物已经被科学家们用来治疗白血病,而且已知它通过与一种调节基因表达的蛋白质——menin相互作用而作用于白血病细胞。因此,当Allis团队开始研究MI-2对DIPG细胞的影响时,他们最初怀疑MI-2会以类似的方式起作用。
“我们的第一个假设是药物通过与menin相互作用关闭了基因,”MSKCC的一位神经肿瘤学家和Allis实验室的一位访问学者,这项研究的主要研究人员Richard Phillips说。“但是,当我们进一步探索时,我们希望看到的许多事情都没有成功。”
例如,当研究人员从胶质瘤细胞中敲除menin时,这些细胞仍然对MI-2敏感,这表明这种化合物通过一种与白血病不同的途径发挥作用。科学家们随后发现,暴露在Mi-2中的DIPG细胞不能维持健康的胆固醇水平,很快死亡;但这些细胞可以通过补充胆固醇来挽救——这表明,在神经胶质瘤的情况下,Mi-2通过消耗营养物起作用。最终,研究人员发现,Mi-2直接抑制了羊毛甾醇合成酶,一种参与胆固醇产生的酶。
研究人员还发现,尽管MI-2会破坏胶质瘤细胞,但这种药物不会损害正常的脑细胞。这一发现与其他研究一致,表明一些癌细胞特别容易受到胆固醇紊乱的影响。
制造更好的药物
越来越多的研究包括这项研究指出胆固醇干扰是治疗癌症的一种有前途的新方法。展望未来,Phillips和他的同事希望开发出针对脑癌的最佳化合物。作为一个起点,他们正在研究一些已经上市的降胆固醇化合物。
“一些现有的药物,最初是为高胆固醇的人制造的,被设计用来靶向羊毛甾醇合成酶,但他们从来没有真正被认为是抗癌药物。”他说,“其中一种甚至比Mi-2更有效,所以我们现在正在与一个化学生物学家团队合作,看看我们是否能改造药物,使其到达大脑。”
更广泛地说,这项研究强调了不仅要知道一种药物有效,而且要知道它如何有效的。在这种情况下,MI-2作用于羊毛甾醇合成酶的发现表明,DIPG肿瘤对胆固醇干扰很敏感,这一发现为获得更有效的化合物开辟了途径。
Phillips说:“你不能想当然地认为标签上写的是药物的工作原理。”
原文检索:Target identification reveals lanosterol synthase as a vulnerability in glioma
④ 著名的肿瘤抑制基因对胚胎发育竟如此重要
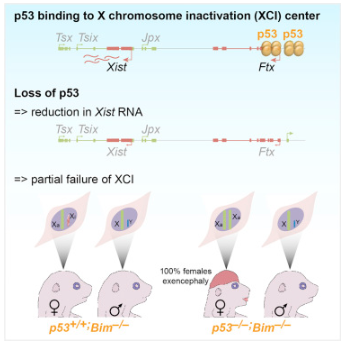
神经管的健康发育是大脑和脊髓正常形成所必需的,新研究揭示p53基因对雌性动物胚胎神经管发育也有重要作用。
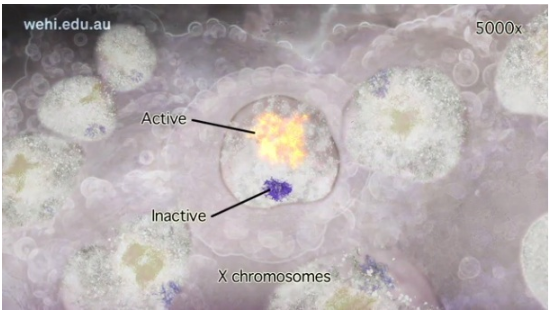
《Cell Reports》杂志解释了p53参与了一种雌性特有的分子过程——“X染色体失活”。这项新发现有助于阐明为什么女婴比男婴更容易患脊柱裂等神经管出生缺陷。
这项研究由来自Walter和Eliza Hall 医学研究所的Anne Voss副教授、Andreas Strasser教授和Marnie Blewitt教授领导,与Peter MacCallum癌症中心的研究人员合作。
合作研究组惊奇地发现,在科学文献和历史上非常著名的p53基因不仅在保护我们免受癌症侵袭方面有作用,而且对神经管健康发育也是关键。
Strasser教授说,研究证明了p53是如何促进和影响雌性胚胎神经管细胞健康过程中所需的功能基因。
“健康发育是一个非常精确和不稳定的平衡过程,p53通过产生正常水平的Xist RNA来帮助雌性胚胎平衡。Xist RNA是X染色体失活其中一个复杂分子过程的组成部分。反过来又导致了神经管的健康发育。简单来说,雌性胚胎要想有健康的神经管发育,需要p53的帮助。”
副教授Voss说,这项研究证实了一个长期存在的理论,即女性有额外的神经管缺陷风险,X染色体失活过程的崩溃有助于解释为什么女性比男性更可能患有神经管相关出生缺陷。
女性有两个X染色体拷贝,而男性只有一个。为了维持女性健康,其中一条X染色体必须在早期发育细胞中失活。如果不能有效失活,神经管就不能正常形成。“以前的研究表明,p53在正常的神经管发育过程中起到了作用,但直到现在还没有确切的证据证明它是如何起作用的。”
Strasser教授说,这些发现是一个很好的例子,说明了强大的合作研究可以推动非凡的发现。他说:“我们的研究团队共同发现了一个令人兴奋的新信息,这个信息是有关一个已经被深入研究并被很好理解的基因。”
原文检索:Loss of p53 Causes Stochastic Aberrant X-Chromosome Inactivation and Female-Specific Neural Tube Defects
⑤ 厦大韩家淮教授最新文章:利用SWATH-MS研究LPS通路中复合物的动态变化
研究人员用SWATH-MS定量质谱技术系统性地研究了LPS信号通路中关键蛋白TRAF6、MyD88和NEMO复合物中的动态蛋白相互作用和磷酸化,揭示了在LPS刺激下Myddosome复合物中IRAK家族蛋白存在不同的招募速度。
LPS(脂多糖)是细菌细胞膜外膜一个主要的成分,其会被哺乳细胞的受体TLR4识别,并激活细胞内一系列信号通路,导致促炎细胞因子的释放。LPS/TLR4信号通路已经研究多年,其中大部分关键的作用蛋白已经被鉴定,但是仍有一些问题尚未解决,比如复合物的动态组装是如何实现以及复合物中关键作用蛋白相对比例是多少。
来自厦门大学生命科学学院,细胞应激生物学国家重点实验室的研究人员发表了题为“Quantification of dynamic protein interactions and phosphorylation in LPS signaling pathway by SWATH-MS”的文章,用SWATH-MS定量质谱技术系统性地研究了LPS信号通路中关键蛋白TRAF6、MyD88和NEMO复合物中的动态蛋白相互作用和磷酸化,揭示了在LPS刺激下Myddosome复合物中IRAK家族蛋白存在不同的招募速度。
这一研究成果公布在Molecular & Cellular Proteomics杂志上,文章的通讯作者为厦门大学韩家淮教授和钟传奇副教授,第一作者为吴秀榕。
在这篇文章中,研究人员拟利用SWATH-MS技术去定量分析LPS信号通路中的关键蛋白复合物。为了纯化蛋白复合物,他们分别建立了Flag-knockin TRAF6、Flag-knockin MyD88和在NEMO敲除细胞中回补Flag-NEMO这三株RAW 264.7细胞系。
之后,研究人员利用LPS分别处理这三株细胞系十个时间点,然后用免疫亲和纯化(immunoprecipitation)的方法获得蛋白质复合物,并用SWATH-MS分析这些样品。
研究人员在30-40个IP样品中定量到2500-3000个蛋白,除此以外,他们还在这些样品中鉴定到2000个左右的磷酸化位点。从这些定量数据中,研究人员成功地获得了所有的已知LPS信号通路中关键蛋白的动态变化信息。
SWATH-MS结果显示,IRAK家族蛋白在招募到MyD88上时,有明显的时间先后之分,且与现有的报道不同。研究人员还分析了Myddosome中关键蛋白TIRAP和MyD88的比列,显示MyD88:TIRAP约为5:1,表明MyD88在复合物中以多聚的形式存在。此外,他们还鉴定到关键蛋白上的一系列磷酸化位点,发现NEMO上一个未报道的磷酸化位点,此位点的突变会影响NEMO激活NF-kB的能力。
这项研究系统地分析了LPS中蛋白复合物中关键蛋白动态变化和蛋白间的比例,且鉴定了一系列未报道的磷酸化位点,为后续的LPS信号通路研究提供了丰富的资源。
原文标题:
Quantification of dynamic protein interactions and phosphorylation in LPS signaling pathway by SWATH-MS
⑥ 下一代基因驱动技术问世
基于CRISPR的基因驱动和更广泛的主动遗传学技术正在彻底改变科学家们将某性状传递给另一代的方式。
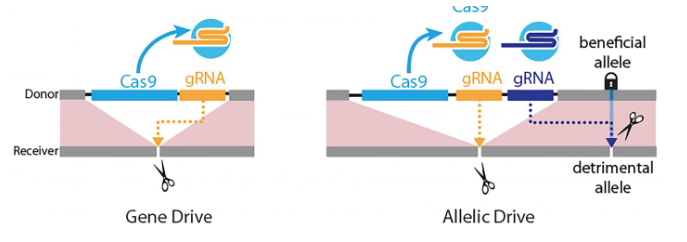
加州大学圣地亚哥分校的科学家们现在已经开发出了一种新的种群基因驱动方式(也被称为“等位基因,alleles”)。
4月9日《Nature Communications》描述了等位基因驱动,它配备一个引导RNA(gRNA),指导CRISPR系统切下一个不想要的基因变体,并用一个首选的基因版本取代它。这一新驱动力扩展了科学家通过精确编辑改变生物体种群的能力。如果拿文字编辑作比喻,基于CRISPR的基因驱动就像一句一句地编辑,而新的“等位基因驱动”可以提供逐字编辑。
举例一个潜在应用,选取对杀虫剂产生抗性的农业害虫的特定基因,用原始的天然基因取代回来,在等位基因驱动下,选择性地交换单个蛋白质残基即可实现。
除了农业,还适用于携带疾病的昆虫。“如果我们在一个基因驱动元件上加入这种正常化的gRNA,例如使蚊子免疫疟疾的基因驱动元件,所产生的等位基因驱动将在种群中扩大传播。当遇到抗杀虫剂等位基因时,它将使用野生型易感等位基因切割和修复,几乎所有的新生后代都对杀虫剂敏感,且会对疟疾传播不敏感,”文章通讯作者Ethan Bier说。
“利用等位基因驱动力迫使这些物种回归自然敏感状态,将有助于打破农药过度利用导致的日益增长的环境破坏恶性循环,”文章一作Annabel Guichard说。
本文描述来了等位基因驱动的两个版本:“复制切割”,利用CRISPR系统选择性地切割不想要的基因版本;“复制移植”,促进选择性保护的位点旁边的有利等位基因的传播。
“这项研究的一个意想不到的发现是,该等位基因驱动产生的错误并不会传播给下一代,”Guichard说。“突变会产生一种不寻常的致死,被称为‘致命镶嵌性’。该过程有助于通过立即消除CRISPR驱动所产生的不必要的突变,使等位基因驱动更加有效。”
尽管这项新技术已经在果蝇中得到证实,但在昆虫、哺乳动物和植物中也有广泛应用潜力。据研究人员称,等位基因驱动技术的几种变体可以通过将作物的有利性状结合起来,例如在贫瘠的土壤和干旱环境中生长。
除了环境,等位基因驱动还可以创建下一代动物模型,并回答基础科学中的重要问题。目前,基因驱动和主动遗传学系统正被开发用于哺乳动物。科学家们说,等位基因驱动可以加速人类新疾病动物模型,这将有助于开发新的治疗方法。
原文检索:Efficient allelic-drive in Drosophila
⑦ Nature子刊:单个T细胞如何决定它们将发挥什么功能?
在检测了众多的情况之后,研究人员得出结论:Tcf1和Lef1是意想不到的决定因子,包含它们自己的表观遗传调控因子。
白血细胞就像士兵一样搜寻和摧毁入侵的细菌、病毒和寄生虫。T细胞对于我们的免疫系统至关重要,它们不仅找到并杀死被感染的细胞,而且也产生抗体,自然消除癌细胞,并记得我们身体几十年前遇到的细菌。
但是,即使是最强的军队,有时也会发现自己被围攻了。当自身免疫性疾病和病毒感染攻击我们的身体时,它们通过靶定T细胞而蓬勃发展——或杀死它们,破坏它们的性能,或导致它们内部失衡。如果T细胞减弱或耗尽,人类就几乎无法抵抗有可能致命的攻击。
来自美国乔治华盛顿大学物理系副教授Weiqun Peng带领的一项新研究,可帮助我们的自然防御,并加强受损的细胞系统:研究人员解开了T细胞身份背后的一部分谜团——单个T细胞如何决定它们将发挥什么功能。
这一研究成果公布在Nature Immunology杂志上。这一发现,对于设计药物纠正T细胞的损耗或不平衡,是非常重要的,并可能有助于人体对自身免疫性疾病(如艾滋病)的防御。
Peng说:“许多疾病通过扰动不同类型T细胞之间的平衡,而发挥作用。从理论上说,通过了解这些细胞是如何形成的,我们可以操纵T细胞的产生,并对抗自身免疫性疾病。”
助手和杀手
T细胞大致分为两类:辅助性T细胞(也被称为CD4),协调入侵感染的免疫反应,和杀手细胞(CD8),实际上破坏受感染的细胞来对抗疾病。
辅助细胞发出化学信息,提醒免疫系统一种病毒已被检测到。辅助细胞指导杀伤细胞复制自己,从而创建了一支CD8军队,寻找并消除感染的细胞。
人体内有2500万到十亿个T细胞。人类需要辅助性和杀伤性细胞来维持一个健康的免疫系统。正常的比例是,每四个杀手细胞就有一个辅助细胞。自身免疫性疾病患者的辅助细胞/杀伤细胞比例往往有所增加,而病毒感染者的比例则有所下降。
直到现在,研究人员还没有完全破译是什么因素控制着T细胞的身份——本质上说一个细胞如何“决定”它是一个辅助细胞还是杀手细胞。
Peng的研究小组发现,一种称为转录因子的蛋白质之间的复杂相互作用,是构建独立的T细胞身份最重要的组成部分。把转录因子看作开关,‘打开’或‘关闭’我们细胞中的基因。”
不同类型的细胞有不同的转录模式(称为基因表达),从而使基因或多或少的活跃。在T细胞的情况下,彭博士的研究发现,两个特定的转录因子——称为Tcf1和Lef1,可以一种维持T细胞身份的模式,“打开”或“关闭”基因。
如果这种开/关模式被破坏,细胞反而会变成辅助性的细胞。研究人员发现,这一壮举取决于这些转录因子一个先前未知的功能。它们有内在的酶相关活性,可以直接影响细胞的表观遗传组成。
“这一重大发现是基因调控的一个新视角。很明显,CD4和CD8细胞在免疫系统中发挥重要的作用。如果在CD4/CD8混合出了错,我们对抗感染和疾病的能力就会受损。但如果生物医学科学家可以开发某种策略,打开/关闭T细胞分化途径,我们也许能够使药物击中分子靶点,并增强我们的免疫系统。”
研究人员表示,这项研究的结果是“出乎意料的”,因为根据传统的观点,转录因子和表观遗传调节因子总是被认为是独立的实体。
在检测了众多的情况之后,研究人员得出结论:Tcf1和Lef1是意想不到的决定因子,包含它们自己的表观遗传调控因子。
原文标题:
Tcf1 and Lef1 transcription factors establish CD8+ T cell identity through intrinsic HDAC activity
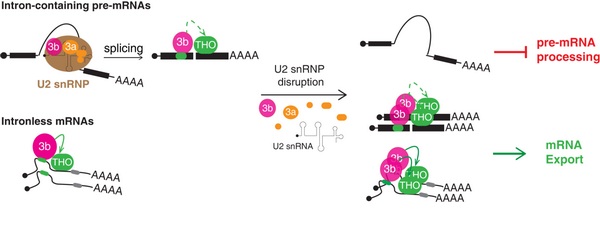
⑧ PNAS首次揭示SF3b协调mRNA加工与出核间平衡的新机制
SF3b作为核心剪接因子U2 snRNP的组分在pre-mRNA剪接和3' 端加工中发挥重要功能。
SF3b作为核心剪接因子U2 snRNP的组分在pre-mRNA剪接和3' 端加工中发挥重要功能。来自中国科学院生物化学与细胞生物学研究所程红研究组最新发表了题为“A U2-snRNP-independent role of SF3b in promoting mRNA export”的文章,首次揭示了SF3b调控mRNA加工与出核间平衡的全新功能机制。
这一研究成果公布在PNAS杂志上,文章的第一作者为王可博士。
程红研究组长期从事mRNA出核转运与pre-mRNA加工之间复杂关联的机制与功能研究。近期工作(Mol Cell 2019; EMBO J 2019)发现,处于基因表达下游的mRNA出核转运不仅受到上游转录和pre-mRNA加工步骤的影响,还可以通过mRNA出核因子和加工因子之间的相互作用,反向调控转录和pre-mRNA加工,这种反向调控可能对于基因表达的精准进行尤为关键。
截至目前,关于mRNA加工与出核间关联的研究多数集中在彼此偶联和协同的功能和机制上。为了确保基因表达的高效准确进行,细胞还需要维持mRNA加工与出核之间的平衡,然而这种平衡如何得以维持至今仍不清楚。
在最新研究中,程红研究组发现SF3b结合成熟mRNA,并与重要出核因子THO相互作用,将THO招募到mRNA上,促进mRNA出核转运。
有趣的是,SF3b以一种互斥的方式,或组装成U2 snRNP辅助pre-mRNA加工,或组装到成熟mRNP中促进其出核转运。
这项项研究揭示了SF3b促进mRNA出核的全新功能,阐释了SF3b协调mRNA加工与出核之间平衡的功能与机制。
原文标题:
A U2-snRNP-independent role of SF3b in promoting mRNA export
⑨ 利用双重sgRNA CRISPR方法纠正遗传性疾病
这种遗传性疾病是由基因COL7A1的突变引起的,该基因编码代表的7号胶原蛋白是黏连真皮和表皮所必需 的蛋白质。
隐性营养不良型大疱性表皮松解症是大疱性表皮松解症的一种烈性亚型,同时也是一种罕见的脆弱型皮肤疾 病,其特征是在皮肤和内部粘膜上不断形成溃疡、水疱、纤维化以及各种并发症如假性紊乱(手指黏连), 并有发展转移成鳞状细胞癌的高度倾向。该疾病的控制和治疗对医疗专业人员是一个很大的挑战,而对病患 及其家属而言更是艰难和痛苦。
这种遗传性疾病是由基因COL7A1的突变引起的,该基因编码代表的7号胶原蛋白是黏连真皮和表皮所必需 的蛋白质。
在西班牙,基因的外显子80存在着极高的突变可能性(存在于大约50%的西班牙患者基因中 ),这证明了针对该基因区域的精确疗法发展是正确的。
一组研究人员使用CRISPR/Cas9工具对基因进行重组编辑,纠正患者细胞比例 (超过80%)高得异常的一个基因,结果证明这一工具可准确、安全地去除来自患者皮肤干细胞致病突变基因COL7A1外显子80,使重新编辑的细胞产生胶原蛋白7的功能变体。
这一研究成果公布在Molecular Therapy杂志上,文章作者,Marcela del Río表示,“ 该研究为治疗迅速进入临床阶段奠定了基础。”
在进行这项研究之前,CRISPR/Cas9分子工具还未能达到在成体干细胞(如造血干细胞或皮肤干细胞)中进行实际临床应用所需的功效水平。 因此,此类方案之前并不能与使用病毒载体添加的常规基因疗法抗衡 。
“直到对隐性营养不良型大疱性表皮松解症非病毒基因重组编辑的开发和成功验证,并超过了载体添加的 常规基因治疗效果打破沉寂。”研究人员之一,CIEMAT的Fernando Larcher表示。此外,由于对基因组的其余部分没有不良影响,该疗法被证明是安全的。
原文标题:
Clinically-relevant correction of Recessive Dystrophic Epidermolysis Bullosa by dual sgRNA CRISPR/Cas9-mediated gene editing