4.12 丁香实验科研资讯早报(每日更新)
丁香园
4月12日 丁香实验科研早报
① Science公布太空双胞胎实验结果之一:如何改变大脑
美国宇航局NASA完成了双胞胎研究,这首次提出了处于太空中的人体的多组学变化,其中加州大学圣地亚哥分校的团队分析的是微重力和其他因素如何改变大脑中的液体压力。
2017年,美国宇航局(NASA) 以一对双胞胎宇航员为对象,展开了个基因研究项目,想看看太空环境会对人的基因产生什么影响。4月Science公布了相关的一系列研究成果。
其中加州大学圣地亚哥分校医学院的研究人员分析了长期太空飞行如何影响体内蛋白质和代谢物的调节,以及对心血管健康和视力的影响。
宇航员斯Scott Kelly和Mikhail Korniyenko送到国际空间站生活一年,从2015年3月开始,一共342天。他们的兄弟则在地球上工作,这是迄今为止最全面的针对人体太空飞行生活的多组学研究。
Scott,他在国际空间站生活了将近一年,右边是他的双胞胎兄弟Mark,在地球上工作)
“这项首次调查了长时间太空飞行如何改变体内分子调节,以及这些变化与由于空间飞行引起的身体生理变化(如血管重塑和视觉)的关系,“加州大学圣地亚哥分校医学院,文章的同作者Brinda Rana博士说,“这项研究通过同时研究宇航员的同卵双胞胎兄弟,作为我们的‘地面对照’,不仅提供了身体对太空飞行的反应的新观点,而且我们还得到了两年地球生活的个体,其体内分子,行为和生理变化的综合新解。”
这项研究由十支调查小组组成,他们一直在观察和评估双胞胎宇航员的情况。
“宇航员在太空中的主要问题是太空相关的神经眼综合症(Space-Associated Neuro-ocular Syndrome,SANS,生物通注) ,许多宇航员会出现SANS相关的视力损害,这可能是血管系统多次撞击的结果。”
“在长时间飞行后,在宇航员身上也观察到类似于动脉粥样硬化的心血管变化,SANS和心血管问题都是美国宇航局完成长期太空飞行任务之前需要解决的主要生理障碍,例如拟议的21世纪30年代火星任务。”
这项研究的挑战之一是在全年的多个时间点内收集国际空间站上足够的生物流体,以便所有10个调查小组对太空中的人体进行全面的组学分析。空间中的血量下降,宇航员长期脱水。这些因素增加了在太空中获取样本的难度。“我们的研究建立了收集和运输样本的指南,可以用于未来宇航员的多组学研究。”
Rana研究小组的一大发现是太空飞行中尿中胶原蛋白的增加,这与太空飞行期间血管重塑的生理指标有关。
“整个双胞胎研究表明了人体如何适应太空飞行环境引起的多种变化,如微重力,辐射,昼夜破坏,二氧化碳浓度升高,与朋友和家人隔离以及饮食限制,”Rana说。
“这些结果将成为未来跨学科研究的路线图,有助于更好地了解长期任务的潜在健康风险,并制定个性化的对策。”
② Science公布太空双胞胎实验结果之二:便携式DNA测序技术
与短途旅行相比,长期航天飞行生活会导致基因表达发生更多变化,尤其是免疫系统和DNA修复系统
2015年,宇航员斯Scott Kelly和Mikhail Korniyenko送到国际空间站生活一年,从2015年3月开始,一共342天。他们的兄弟则在地球上工作,这是迄今为止最全面的针对人体太空飞行生活的研究。
4月,Science公布了一系列研究成果,其中Weill Cornell医学院负责的研究表明长期太空飞行会导致基因表达发生变化,这些变化比短途旅行要多得多,特别是免疫系统和DNA修复系统。
Christopher Mason博士领导了这项研究,作为十个调查小组之一,Mason博士等人分析了Scott和Mark Kelly这对双胞胎的遗传,生理和行为变化。
研究表明,在将近一年的太空生活中,Scott发生了颈动脉增厚,视网膜增厚,体重减轻,肠道微生物移位,认知能力降低,DNA损伤和基因表达发生改变等变化,并且染色体末端的端粒也延长了,但返回地球后,端粒延长则变成了加速缩短和损伤。
这一研究能帮助科学家更好地了解宇航员在长期太空旅行中所经历的变化。还可以帮助他们更好地治疗或预防长途太空飞行对宇航员健康造成的损害,未来美国宇航局准备对火星进行为期三年的探索。
“它为我们提供了未来宇航员的生物医学和分子路线图,”Mason博士说。
包括Mason等人在内的这十个调查研究小组是2014年3月被选中,他们只用了几个月的时间准备分析方案。
Mason等人也分析了Scott和Mark在Scott返回地球前6个月,返回地球后9个月的样品,他们希望能寻找造成DNA突变或损伤,哪些基因被打开或关闭的表观遗传变化。他们还观察了男性细胞产生的蛋白质的变化,评估这些变化如何影响健康。
众所周知,宇航员的基因会发生一些变化,例如涉及骨形成或DNA修复的变化,这是因为在重力作用下会发生骨密度降低,而且太空旅行会增加辐射暴露,导致DNA损伤。但这项研究也发现了一些新的变化,如线粒体基因活动的变化,这种变化会增加机体产能,还有免疫系统基因也出现了变化,这表明长期太空飞行可能会增加身体的压力。
此外,研究人员还还观察到血液中无细胞DNA部分会出现更多的线粒体DNA,这是细胞应激的指标。
“基因表达发生了巨大变化,在最后6个月,基因表达的变化比前半部分多出六倍,”Mason说。虽然Scott返回地球后许多变化有出现了逆转,但仍有些变化无法逆转,包括认知缺陷,DNA损伤和T细胞激活。
“我们还不知道这些变化是好还是坏,这可能只是身体的反应,但基因受到了干扰,所以我们跟踪它们,看看会存在多长时间,了解作用机制。”
这项研究还可以帮助地球上的患者,特别是那些经常发生显著遗传变化,和辐射照射的癌症患者。在地球上研究一个健康的人类,以及一个暴露在太空中巨大压力因素的人,可以让科学家们对压力的正常反应以及身体能适应压力的阈值有更深的了解。这可能有助于科学家区分身体的正常应激反应与癌症,感染或其他压力因素相关的病理变化。
同时,这项研究还提供给了大家一种有用的新工具,Mason博士团队创建了一种便携式DNA测序技术,宇航员利用这些技术对自己的DNA进行了测序。
2016年,在美国宇航局为期一年的生物分子测序仪任务期间,Mason博士及其同事证明DNA测序仪可以在国际空间站上运行。基于这一发现,他的研究小组在Nature Communications上发布了一种机器学习算法,介绍了这一技术的优势。
这种可在现场使用的便携式测序工具,现在正在帮助控制疾病爆发,包括西非的埃博拉和巴西的Zika。康奈尔科技公司的一家名为Biotia的公司,Mason作为联合创始人和股权持有人,将DNA测序仪推送到了几家国际医院,追踪感染,帮助开发更快的DNA检测方法。
“你不再需要等待数天或数周进行DNA测序和分析,你可以在几个小时内完成任务,无论是在地球上还是在国际空间站上。”
③ Science公布太空双胞胎实验结果之三:肠道微生物的变化
美国宇航局双胞胎研究发现太空飞行会影响肠道细菌
美国航空航天局(NASA)标志性的双胞胎研究(Twins Study)今日在Science封面上公布了最新的结果,其中一项研究表明长期的太空飞行会影响人体肠道微生物。
研究指出,在国际空间站(ISS)长达一年的时间里,宇航员Scott Kelly肠道微生物组经历了两种主要细菌比例的转变。但是他微生物组中的细菌多样性在太空飞行期间没有改变。
肠道健康会影响消化,新陈代谢和免疫力,而且近年来的越来越研究表明肠道微生物组的变化与骨骼,肌肉和大脑的变化有关。
“我们不能在不清楚太空飞行如何影响身体的情况下将人类送到火星,”西北大学领导微生物组研究的Fred W. Turek说,“我们需要尽早深入研究,因为计划是在2035年将人们送到火星。”
西北大学的肠道微生物组研究是十项调查中的一项,这十个项目分别探讨了太空飞行对人体影响的各个方面,包括基因表达,骨密度,免疫系统反应和端粒动力学的变化。
双胞胎研究
从2015年到2016年,Scott成为第一位在太空中度过近一整年时间(340天)的美国宇航员。与此同时,他的弟弟Mark则待在地球上,不过他在2001-2011年期间在太空度过了54天。为了明白在太空一年时间里身体发生了什么,当Scott还在太空时,NASA研究员就开始研究这对双胞胎。
Turek等人主要分析了他们肠道中细菌的组成随时间和空间的变化。
“我们将Scott与Mark进行了比较,这很有意思,”Turek说,“但真正的比较是看着Scott在飞行前,飞行中和飞行后的样本。这可能是我们所拥有的最有价值的信息。”
肠道健康的重要性
肠道微生物组被称为“新器官系统”,这个复杂的微生物群落,包括细菌,病毒和真菌生活在消化道中。在过去的10年里,科学家们开始意识到微生物组的健康和多样性对人体的影响。改变微生物组可导致骨骼,肌肉和大脑的改变。
“细菌对身体其他系统的影响非常显著,”西北大学神经生物学研究教授Martha Vitaterna说,“有研究表明,肠道微生物组的变化与神经和生理有关,如阿茨海默病,帕金森病,自闭症和精神分裂症。通过保护肠道,我们可以保护所有这些系统。”
超过90%的肠道细菌分属于两大类:厚壁菌(Firmicutes)或拟杆菌(Bacteroidetes)。两个类别都包含好细菌和坏细菌的混合物。Scott微生物组中的厚壁菌门和拟杆菌之间的比例在太空飞行中经历了明显的变化——厚壁菌数量增加,而拟杆菌减少。这种转变是研究人员在Scott微生物组中发现的更大组成变化之一,但这种微生物组变化在回到地球后恢复正常。
“这种微生物群落的结构发生了大规模的转变,”Vitaterna说,“我们不能说这是好事还是坏事。”
是什么导致了转变?
许多变量都可能影响Scott在太空中的肠道微生物组,包括微重力,辐射增加,昼夜节律变化,睡眠时间减少,空气循环不足,生活在封闭空间的压力和饮食改变。
最初Turek和Vitaterna担心Scott在太空中的饮食,主要包括冷冻干燥,辐照,预包装的食品,会降低他肠道微生物组的多样性。但是西北大学之前进行的小鼠实验证明了并不是,虽然Scott和Mark在为期一年的研究中没有吃同样的食物,但之前研究中,小鼠吃了完全相同的饮食。与地球上的对照小鼠相比,太空小鼠的肠道微生物组也发生了变化。
Turek认为微重力最有可能导致变化。“我们认为微重力会对细菌产生影响,”他说,“未来我们将会确定这一点。”
④ 亚洲惊现比“霍比特人”更小的早期人类新物种
菲律宾的一个岛屿洞穴深处发现了不为人所知的人类亲戚骸骨,它们的身形甚至比霍比特人还小巧。
新人种被命名为“吕宋人”,以纪念发现它们的吕宋岛。这些骸骨的主人生活在5万多年前的更新世晚期,吕宋人身高不足1.2米,是有史以来第二个已知的矮人族,第一个是弗洛雷斯人,也被称为霍比特人,2004年发现于印度尼西亚的弗洛雷斯岛。
澳大利亚国立大学(ANU)的Philip Piper教授是该研究小组的共同作者和主要成员,他说这一发现是我们对东南亚人类进化认识的重大突破。
研究人员在同一个考古矿中发现了至少两个成年人和一个少年的遗骸。
化石包括成人的手指和脚趾骨以及牙齿。我们还发现了一个孩子的股骨,它们有一些非常有趣的特征,例如,牙齿非常小,Piper教授说。
“一般来说,牙齿的大小虽然并不总是反映哺乳动物的整体体型,我们认为虽然吕宋人可能相对较小,但还不知道到底有多小。我们需要找到一些可以更精确地测量身体尺寸的骨骼元素,”Piper教授说。
“令人难以置信的是,四肢,也就是手和脚的骨头都是南猿特有的。南猿(Lucy所在的属)最后一次出现在非洲是在大约200万年前,被认为是包括现代人类在内的人类的祖先。
问题是这些特征中的一些是作为适应岛上生活而进化的?还是在过去200万年里由祖先传给吕宋人的解剖学特征?
巴黎国家自然历史博物馆的古人类学家Florent Détroit说,有关吕宋岛70万年前的古代动物屠杀证据表明,“一些亚洲直立人(可能来自中国)成功地穿越了大海,定居在吕宋岛,在那里它们随后经历了‘岛屿特有性’的影响,最终导致了吕宋人的灭绝,”他说。“但是这是非常投机的,我可能对这个简单场景做出了一个(或多个)错误的推断,我们将在未来对此进行研究。”
尽管关于吕宋人的起源和它们在吕宋岛上的寿命还有很多疑问,但最近科学家们在卡洛洞穴(Callao Cave)附近的挖掘工作发现了大约70万年前的石器和被屠杀的犀牛。
“虽然附近没有发现人类化石,但这确实为人类在吕宋岛的存在提供了一个时间表。不管是吕宋人屠杀和吃犀牛,我们都要拭目以待,”Piper教授说。
“这使得整个地区非常重要。菲律宾是由一组大岛屿组成的,这些岛屿被分开的时间足够长,有可能促进群岛物种形成。菲律宾的考古学研究没有理由不能发现几种人类蛋白。可能只是时间问题。”
吕宋人与在菲律宾群岛东南部的弗洛雷斯岛上发现的著名的弗洛雷斯人或“霍比特人”具有一些独特的骨骼特征。
此外,在苏拉威西岛发现了大约20万年前的石器,这意味着古代人类可能居住在东南亚的许多大岛上。
“虽然附近没有发现人类化石,但这确实为人类在吕宋岛的存在提供了一个时间表。不管是吕宋人屠杀和吃犀牛,我们都要拭目以待,”Piper教授说。
Détroit指出,科学家们无法从新发现的人骨中提取任何DNA,部分原因是菲律宾潮湿温暖的气候无助于保存遗传物质。然而,研究人员说,从残骸中提取蛋白质是可能的,这些蛋白质可以揭示家族树相关问题。
“菲律宾是由一组大岛屿组成的,这些岛屿被分开的时间足够长,有可能促进群岛物种形成。在菲律宾的考古学研究没有理由不能发现几种人类蛋白,可能只是时间问题。”
吕宋人与在菲律宾群岛东南部的弗洛雷斯岛上发现的著名的“霍比特人”具有一些独特的骨骼特征。
此外,在苏拉威西岛发现了大约20万年前的石器,这意味着古代人类可能居住在东南亚的许多大岛上。
原文检索:New evidence for a 67,000-year-old human presence at Callao Cave, Luzon, Philippines
⑤ Cell完全打破干细胞的概念:居然存在多能干细胞以上的“带头大哥”细胞
加拿大麦克马斯特大学的一个研究小组在人类干细胞中发现了一个独特的细胞亚群,这些细胞似乎可以指示周围细胞如何发育和生长。
研究人员将其命名为“Kingpin”细胞,这类细胞的发现,以及鉴定细胞的过程,将为科学家们开辟一条新的研究道路,帮助我们更好的了解癌细胞的生长,以及人类干细胞如何做出决定的作用机制。
这一研究成果公布在4月12日的Cell杂志上。
领导这一研究的麦克马斯特大学干细胞和癌症研究所主任Mick Bhatia说:“我们发现了一个不为人知的细胞群,它似乎是维持和培育所有其他细胞所需干细胞生态系统的‘带头大哥'”。
“这类人体多能干细胞具有非常不同的基因组,遵循不同的遗传规则,对不同类型的信号做出反应。”
一直以来,科学家们都认为人体多能干细胞就是主细胞,它们具有分化成各种细胞类型的能力,但是这类细胞似乎处于干细胞系统的顶端。
Bhatia的团队花了六年多的时间展开研究,分析他们之前忽视的多能干细胞边缘细胞,通过描述这些细胞,研究人员发现它们是在成体细胞重编程为多能细胞的最早阶段形成的。
之后,研究人员利用单细胞RNA测序基因表达分析的工具分离和分析了细胞,发现之类祖细胞的特征与周围的细胞生态系统不同。
麦克马斯特大学与哈佛大学,澳大利亚等多处的研究人员合作,比较了人类多能创始细胞(pluripotent founder cells)和小鼠干细胞,没有发现相似之处。不过他们在猴干细胞中找到了相同的细胞亚群。
“我们继续研究不同的物种,因为我们认为这是普遍存在的细胞,但让人震惊的是这不是一种普遍存在的细胞,”Bhatia说。
“我们花了很多时间试图证明这是一个普遍化的现象,但事实证明它只限于灵长类动物。这可能有助于解释小鼠与人类干细胞药物反应的根本差异”。
在这篇文章中,研究人员采用了最新技术,并结合了新的数据挖掘工具,这对研究结果至关重要。
目前,研究组成员试图这种细胞分析人体癌症,文章作者,Tony Collins说,“我们现在将这些技术和经验应用于复杂的癌症系统。为什么某些细胞会先发生癌变呢?癌细胞之间有什么区别?这些创始细胞的特征是否与肿瘤有关呢?”
这项研究开辟了一套全新的标准,以及一种观察细胞系统的新方式。
⑥ Nature:点击“重置按钮”,解决导致疾病的基因复制问题
“我们不需要添加任何纠正性的遗传物质,相反,细胞将DNA缝合在一起,减去重复,这是基因矫正的捷径,具有潜在的治疗吸引力,”麻省大学医学院教授Scot A. Wolfe说。
Charles P. Emerson Jr., PhD 和 Scot A. Wolfe, PhD
“我们不需要添加任何纠正性的遗传物质,相反,细胞将DNA缝合在一起,减去重复,这是基因矫正的捷径,具有潜在的治疗吸引力,”麻省大学医学院教授Scot A. Wolfe说。他们利用CRISPR/Cas9和一种很少使用的DNA修复途径来编辑和修复与微复制(microduplications)相关的特定基因突变,本质上,这种可编程的基因编辑方法克服了之前的基因校正效率低下的问题。
微复制是染色体上的变化,染色体上的小片段DNA被复制或复印。在某些基因中,这些重复可以导致所谓的“移码突变”,即添加的核苷酸数量不能被3整除。这会改变基因转化为有功能的蛋白质。由微复制引起的疾病多达143种,包括肌营养不良、Hermansky-Pudlak综合征和Tay-Sachs病等。
Wolfe博士是这篇Nature的联合研究员,他是CRISPR/Cas9和其他基于可编程核酸酶基因编辑方法研究的专家。
目前,大多数技术都需要在缺陷基因处产生DNA链断裂,并引入纠正性基因材料。新序列通过一种被称为同源定向修复途径的天然DNA修复机制被插入断裂处。虽有临床应用潜力,但其校正效率低下,而且还存在其他技术挑战。
Wolfe与麻省大学医学院肌营养不良中心主任、骨骼肌发育和肌营养不良专家Charles P. Emerson Jr教授相信有一种更直接的方法来纠正由微复制引起的疾病。他们认为,如果微同源介导的末端连接(MMEJ)途径(而非同源定向修复途径)能被有效的利用,它将可以去除重复序列恢复基因原本的功能序列。与其他细胞修复机制相比,MMEJ通路比较罕见,效率更低,通常导致断裂两侧缺失,据一些人估计只执行小于10%的DNA修复。
Emerson博士具备一个良好的模型可以评估该方法的实际效果——TCAP基因微复制引起的2G型肢带肌肉营养不良(LGMD2G)。Emerson和Wolfe实验室利用LGMD2G患者的多能干细胞和SpCas9核酸酶靶向TCAP基因微复制中心附近的一处DNA断裂。正如他们所预期的那样,MMEJ可以删除一个微复制拷贝,有效地将DNA重新缝合了在一起,省去了突变就可以产生正常的TCAP蛋白。
“TCAP基因的微复制基因编辑的简单性和效率都是令人惊喜的,LGMD2G目前是无法治疗的,它为这种疾病提供了一个独特的机会,我们立即就可以展开进一步研究,”Emerson说。
其他疾病呢?他们与儿科副教授Christian Mueller博士合作,又证明了MMEJ核酸酶基因编辑也具备潜力治疗其他微复制引起的疾病,如1型Hermanksy-Pudlak综合征相关的HPS1基因。随后,神经学助理教授Oliver King博士开发了一个计算工具来搜索人类基因组数据库,显著地识别了143种疾病相关的微复制。这些微复制都可以使用他们的Cas9-MMEJ方法进行治疗。
从这里出发,我们相信,基于MMEJ的治疗策略的简单性、可靠性和有效性也许能为更多目前无法治疗的疾病开发基于核酸酶的基因矫正疗法。
原文检索:Precise therapeutic gene correction by a simple nuclease-induced double-stranded break
⑦ 新癌症药物靶点加速精准医学发展
研究人员利用CRISPR技术捣毁了30种癌症类型的300多种癌症模型的每个基因,并发现了数千种对癌症生存至关重要的关键基因。这是此类型研究中规模最大的一个,研究成员来自威康桑格研究所和Open Targets,他们随后开发了一个新系统,对600个药物目标进行优先级排序,以展示最有希望发展为治疗的目标。
这项结果发表在今天(4月10)的《Nature》杂志,它加速了靶向癌症治疗的发展,使研究人员更近距离地绘制癌症依赖关系图,这是一本关于精准癌症治疗的详细规划书,帮助更多患者获得有效治疗。
在英国,每两分钟就有一人被诊断出患有癌症,同时,50%的社会人将会在一生中的某个时刻患上癌症。手术、化疗和放疗属于癌症常规治疗范畴,然而,它们在有些患者身上有效,在另一些患者身上没有反应,不仅如此,治疗损害了健康组织,从而对癌症患者产生有毒副作用。
科学家和制药公司正在探索新的靶向治疗方法,选择性地杀死癌细胞,使健康组织不受伤害。目前,前途渺茫:开发一种药物大概需要10-20亿美元,其中90%的药物在开发过程中以失败告终。
一个好的初始选择往往是一个好的靶向药物发现的最重要环节。
威康桑格研究所、GSK、Open Targets、欧洲生物信息研究所(EMBL-EBI)及其合作单位进行了迄今为止最大的癌症基因CRISPR筛选,总共破坏了30种癌症的300多个癌症模型的2万个基因,才揭示出哪些基因对生存至关重要,重点研究了常见的肺癌、结肠癌和乳腺癌,以及急需新疗法的胰腺癌和卵巢癌等。
数千个关键癌症基因录入一个优先排列系统,输出具备最大药物开发前景的大约600个基因。
在多种不同癌症类型中,一个最高评分靶标是Werner综合征RecQ螺旋酶(WRN)。研究小组发现,DNA修复路径有缺陷的癌细胞(又称microsatellite unstable cancers)需要WRN才能存活。其中包括15%的结肠癌和28%的胃癌。WRN作为一个有希望的药物靶点为广泛的癌症治疗提供了一个令人兴奋的机会。
“CRISPR是一个强大的工具,它让我们以五年前还无法想象的规模和精度来进行科学研究。有了CRISPR,我们发现了一个令人兴奋的癌症新药研发机会,”文章合著者、京都大学前沿生物与医学科学研究所的Kosuke Yusa博士说。
“我们首次以数据驱动的方式,在基因组尺度上提供指导和新的治疗目标,”文章共同第一作者、威康桑格研究所和Open Targets公司的Francesco Iorio博士说。
桑格和合作伙伴们将继续推动这些研究成果转化为新的治疗方法。“这本癌症精准治疗的详细说明书将免费提供给世界各地的科学家,让他们了解什么使癌症成为癌症,以及我们如何比现在更有效地针对不同类型的癌症,”文章合著者Mathew Garnett博士说。
“通过癌症依赖关系图(Cancer Dependency Map)我真心希望彻底改变人类患者的治疗方式,我想改变患者的生活,即使临床中已经有了一些抗癌药物,但通过改进药物开发过程,也许可以使更大量的患者受益,”文章共同一作Fiona Behan博士说。
“无疑,CRISPR提供了一个独特的工具来加速肿瘤药物靶点的发现,这项研究是朝着积极方向的一个显著的飞跃,”英国癌症研究中心首席科学家Karen Vousden说。“但是我们应该记住,实验室研究细胞并不总能反映人体内癌症的复杂性,下一步将会对本研究中被确定为‘弱点’的基因展开彻底分析。”
原文检索:Fiona Behan et al. (2019) Prioritisation of cancer therapeutic targets using CRISPR-Cas9 screens. Nature. DOI: 10.1038/s41586-019-1103-9
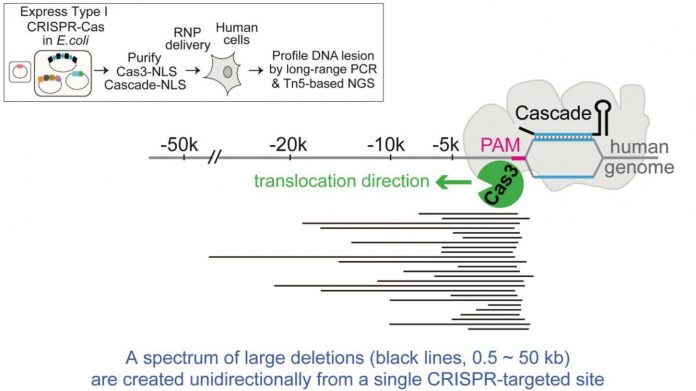
⑧ 效果堪比粉碎机,两名华人学者发现CRISPR新工具
CRISPR-Cas9就像一把小剪刀,允许研究人员在特定的位置剪断和编辑DNA链。不过,有时候这把小剪刀的力量实在太弱了。于是,研究人员又开发出一种新型的CRISPR工具,能够删除长片段的DNA。
密歇根大学领导的研究团队近日在《Molecular Cell》杂志上介绍了这种堪比粉碎机的工具——I型CRISPR-Cas3。他们首次在人类细胞中实现了长距离的DNA删除。这种工具适用于遗传学研究,有助于人们了解疾病的基础,并治疗与长链DNA相关的疾病。
文章的两名通讯作者分别是密歇根大学生物化学系的助理教授张燕(Yan Zhang)博士和康奈尔大学分子生物学与遗传学系的教授柯爱龙(Ailong Ke)博士。张燕博士解释说,这种新工具使用了另外一种CRISPR系统,与目前广泛使用的CRISPR系统不同。不过这两者都来自细菌,正常功能是清除入侵的DNA。
与众不同的CRISPR
新工具使用的是I型CRISPR,对细菌而言它其实比II型CRISPR(含有Cas9)更常见。I型CRISPR之前从未用于任何真核细胞,它采用一种称为Cascade的核糖蛋白复合物来寻找其靶点,并利用Cas3酶来粉碎DNA。
柯爱龙教授领导的团队完成了颇具挑战性的蛋白质优化和纯化方面的工作。他主要用结构和生物化学的方法研究了I型CRISPR系统。
两个研究团队尝试将细菌的CRISPR组分导入人胚胎干细胞和HAP1细胞系。他们发现,在向导RNA的带领下,I型CRISPR系统成功删除了靶向的DNA区域,大小从几百bp到100 kb不等。
带有马达的粉碎机
张燕博士将Cascade-Cas3系统称为“带有马达的DNA粉碎机”,因为它可以沿着DNA链移动一段距离,在移动的同时降解遗传物质。
“Cas9是一种分子剪刀,可以到达特定的位置并剪断DNA,”张燕博士谈道。“不过,Cas3则可以到达你想要的地方,沿着染色体移动,删除几十kb的片段。这使其成为一种强大的筛选工具,可以确定哪些DNA区域对特定疾病最重要。”
当人们研究不编码任何蛋白质的长链非编码RNA时,这种工具可能特别有用。利用DNA粉碎机,人们可以删除一大段DNA,然后看看会发生什么。
此外,Cas3能够沿着染色体移动一段距离,这是目前的Cas9技术无法实现的。而且,无核酸酶活性的Cas3版本(dCas3)也能沿着DNA移动,但缺乏粉碎机的功能,这为长距离的表观基因组改造提供了一个强大的平台。
克服重重挑战
为了让干细胞显示是否有DNA被删除,墨尔本大学的Sara Howden博士开发出一种灵敏的双报告细胞系,而之前的“报告”干细胞大多不够灵敏,如果粉碎活性比较低的话。
团队面临的另一项挑战是如何利用新一代测序来确定粉碎机粉碎了哪些DNA。密歇根大学的Zhonggang Hou博士开发了一种基于转座酶的方法,而Peter Freddolino博士建立了定制的信息学管道来分析深度测序的结果。
研究人员指出,CRISPR-Cas3系统使用的向导RNA序列比CRISPR-Cas9的更长,而且目标搜索和降解是两个完全分离的步骤,因此这种方法更容易得到控制。它不大可能在人们不想要的地方做出错误的切割。
张燕博士推测,这种新工具及其衍生物也许对疾病治疗有用,不过或许在多年后才能实现。目前,密歇根大学和康奈尔大学已就这一工具申请了一项联合专利。(生物通 薄荷)
原文检索
Introducing a Spectrum of Long-Range Genomic Deletions in Human Embryonic Stem Cells Using Type I CRISPR-Cas
Molecular Cell Available online 8 April 2019