4.17 丁香实验科研资讯早报(每日更新)
丁香园
4月17日 丁香实验科研资讯早报(每日更新)
① Cell杂志最受关注的五篇文章(4月)
Cell创刊于1974年,现已成为世界自然科学研究领域最著名的期刊之一,并陆续发行了十几种姊妹刊,在各自专业领域里均占据着举足轻重的地位。Cell以发表具有重要意义的原创性科研报告为主,许多生命科学领域最重要的发现都发表在Cell上。本月《Cell》前五名下载论文为:
1)Phosphoinositide 3-Kinase Regulates Glycolysis through Mobilization of Aldolase from the Actin Cytoskeleton
由贝斯以色列女执事医疗中心(BIDMC)的一个科学小组领导的一项新研究,提供了有关PI3K(磷脂酰肌醇3-激酶)在糖酵解中发挥作用潜在生物学机制的一些重要新见解。癌细胞借助于糖酵解这一代谢过程来生成生物质和能量实现旺盛生长。发表在《细胞》(Cell)杂志上的新研究结果,证实了糖对癌症生存的重要性,并为开发出一些PI3K抑制剂来作为癌症靶向疗法提供了重要的新信息。
论文的通讯作者、BIDMC癌症中心肿瘤学家、哈佛医学院医学副教授Gerburg Wulf说:“这项研究证实了PI3K作为一个主要的调控因子整合了癌细胞的结构和它的代谢。”糖分解与细胞结构是如何协调的?Wulf说,答案是一个惊人简单的生物物理机制。
Wulf解释道:“在正常细胞中,来自外部的信号会激活高度组织化及灵活的细胞骨架。细胞骨架并不是静态的,而是由纤维束动态组装而成,纤维束不断地周转(turnover),分解能量分子ATP以维持细胞的形状。”这些纤维是由肌动蛋白(actin)所构成,Wulf研究小组发现当PI3K激活时,ATP会分解加速,肌动蛋白纤维瓦解,释放出醛缩酶(aldolase)。
“就像鸟儿坐在电话线上一样,这些酶坐在肌动蛋白纤维上。如果切断电话线鸟儿会飞走。同样地,当肌动蛋白纤维分解时,醛缩酶会脱落。我们发现这一‘脱落’过程激活了醛缩酶,加速了糖酵解。”
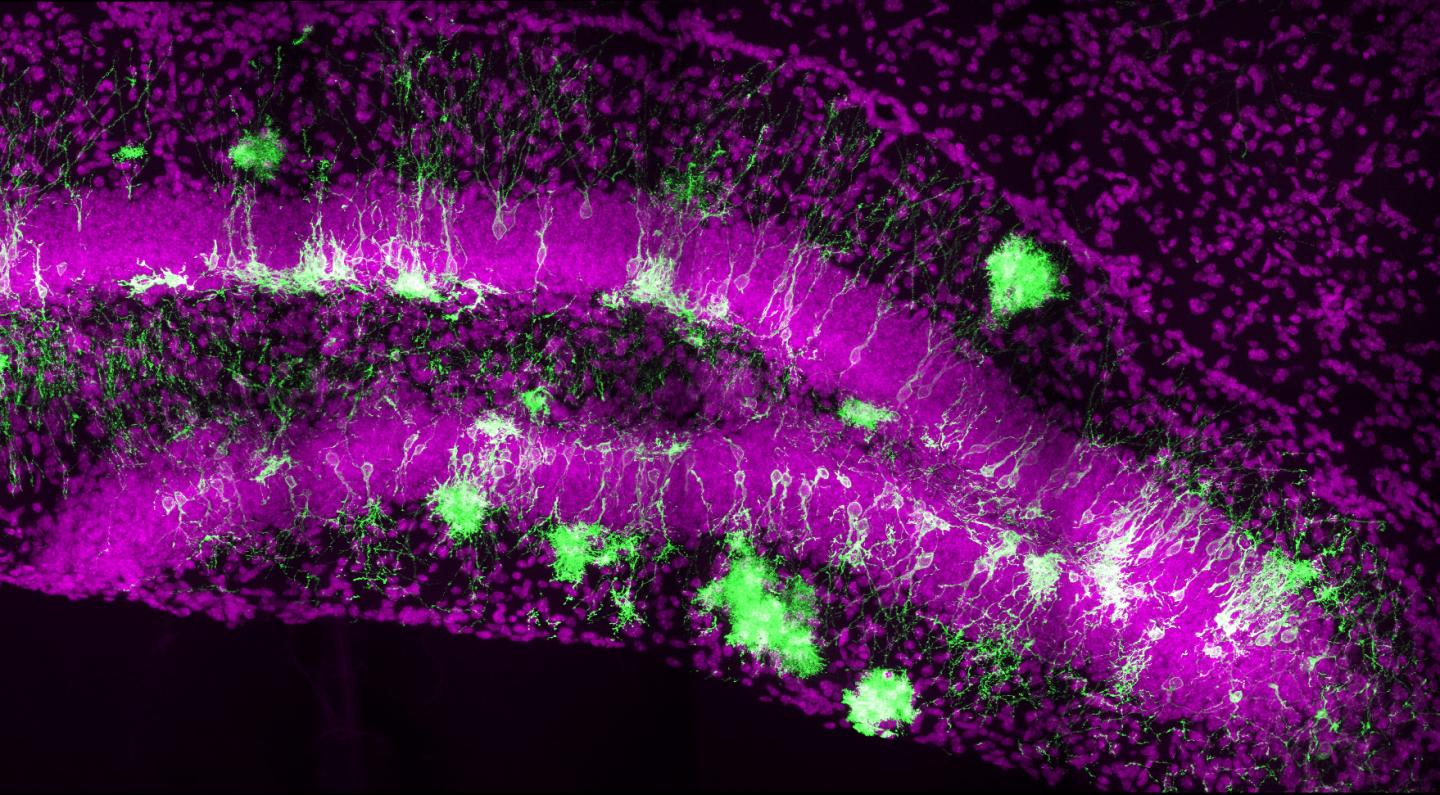
2)A Common Embryonic Origin of Stem Cells Drives Developmental and Adult Neurogenesis
科学家们曾经认为,哺乳动物成年后已经具备了所有神经元。但是60年代的研究发现,在成人大脑的某些部位仍会产生新神经元。90年代的开创性研究帮助确定了它们的起源和功能。
最新Cell杂志发表的一篇报道指出,在小鼠身上,单一的神经祖细胞谱系有助于胚胎、早期出生和成年后海马神经发生,并且,这些细胞在一生中不断产生。
“从概念上讲,这表明我们的大脑有能力持续改进、适应和将新细胞融入到电路之中,”宾夕法尼亚大学医学院的文章通讯作者Hongjun Song说。“这是非常重要的,因为众所周知,海马对学习、记忆和情绪调节很重要。”
神经发生最初被认为有两个阶段:发育阶段,主要发生在胚胎和短暂的出生后,在这个阶段,神经元由干细胞产生,干细胞形成整个神经系统的循环。成年神经发生被认为起源于一组专门的神经干细胞群体,这些干细胞被“搁置”并与胚胎发生期间产生的神经元的前体不同。新研究结果证明,事实并不是那么简单。
在目前的研究中,研究人员标记了小鼠大脑发育早期阶段的前体神经干细胞。然后,他们在整个发育过程中和成年期跟踪细胞谱系。结果,在动物的整个生命周期中,新的带有前体细胞标签的神经干细胞不断产生。
RNA-seq和ATAC-seq分析被用来确认谱系中拥有共同分子标记和相同发育动力学的所有细胞。
“早期研究表明,大脑的特定部位,如嗅球和海马可以产生神经元,”Song说。“直到现在,还不清楚这是怎么发生的。我们首次在哺乳动物大脑中证明,发育从一开始就在进行中,而且这一过程是持续一生的连续过程。”
3)Structures of the Catalytically Activated Yeast Spliceosome Reveal the Mechanism of Branching
清华大学生命学院施一公教授研究组就剪接体的机理与结构研究,于《细胞》(Cell)期刊发表题为《催化激活状态的酵母剪接体结构揭示RNA剪接分支反应的机理》(Structures of the Catalytically Activated Yeast Spliceosome Reveal the Mechanism of Branching)的科研论文,揭示了剪接体第一步剪接反应前的瞬变状态——催化激活剪接体(catalytically activated spliceosome,定义为“undefined复合物”)4个不同构象的高分辨率三维结构,这是目前RNA剪接循环中最后一个未被解析的基本状态。
至此,施一公研究组成为世界上首个、也是唯一一个成功捕获并解析了RNA剪接过程中所有完全组装剪接体高分辨率三维结构系列成果的团队。该文报道的这4个同一状态却不同构象的剪接体结构,整体分辨率为2.9埃-3.8埃,核心区域的分辨率高达2.7埃,是目前报道的最高分辨率剪接体结构,该结构首次揭示了第一步剪接反应发生过程中的动态变化,展现了剪接因子对于剪接反应发生的重要作用,第一次从结构信息中回答了剪接体对不同pre-mRNA底物识别的特异性等重要科学问题。
4)Human Pluripotency Is Initiated and Preserved by a Unique Subset of Founder Cells
加拿大麦克马斯特大学的一个研究小组在人类干细胞中发现了一个独特的细胞亚群,这些细胞似乎可以指示周围细胞如何发育和生长。
研究人员将其命名为“Kingpin”细胞,这类细胞的发现,以及鉴定细胞的过程,将为科学家们开辟一条新的研究道路,帮助我们更好的了解癌细胞的生长,以及人类干细胞如何做出决定的作用机制。
这一研究成果公布在4月12日的Cell杂志上。
领导这一研究的麦克马斯特大学干细胞和癌症研究所主任Mick Bhatia说:“我们发现了一个不为人知的细胞群,它似乎是维持和培育所有其他细胞所需干细胞生态系统的‘带头大哥'”。
“这类人体多能干细胞具有非常不同的基因组,遵循不同的遗传规则,对不同类型的信号做出反应。”
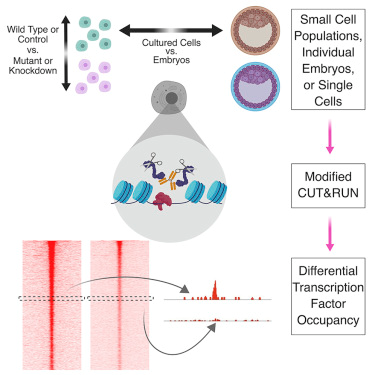
5)Profiling of Pluripotency Factors in Single Cells and Early Embryos
美国匹兹堡大学生命科学学院,麻省大学医学院的研究人员利用一种开创性新方法:uliCUT&RUN绘制了少量细胞(包括单细胞)和单个植入前胚胎的染色质上转录因子和DNA结合蛋白图谱。
这一研究成果公布在4月4日的Cell杂志上,由美国匹兹堡大学生命科学学院的Sarah Hainer和麻省大学医学院的Thomas G. Fazzio领导完成。
CUT&RUN是一种类似于广泛使用的染色质免疫沉淀(ChIP)技术的方法,这种方法能确定染色质上的蛋白质定位。然而,目前用于DNA结合蛋白的全基因组作图方法需要数万,甚至数百万个细胞,因此在体内完成DNA结合蛋白的作图十分受限——许多生物学重要意义的细胞群中的细胞数量都不大。
CUT&RUN最初于2017年得以改善,可以成功应用于1,000多个细胞群。在最新研究中,Hainer和Fazzio试图进一步改进这项技术,终于首次成功在单细胞和单个植入前小鼠胚胎中完成了全基因组作用因子的图谱。
他们将这种技术命名为超低输入CUT和RUN(ultra-low input CUT&RUN,uliCUT&RUN),实验证明,在大多数细胞中只有一小部分转录因子结合位点被占据,因此证实了多细胞实验所进行的检测,而且研究还表明,uliCUT&RUN可以检测转录因子与细胞发育或疾病关键稀有细胞群的结合。
“通过将定位研究推进到单细胞和单个胚胎水平,未来的研究可以聚焦于细胞异质性和有限生物样品的研究,”Hainer说,“通常,组织样品中细胞数和细胞纯度之间的平衡,会不利于ChIP-seq分析纯化组织特异性细胞群。 而uliCUT&RUN从50个细胞中获得因子结合图谱的能力与高细胞数的图谱高度重叠,因此几乎可以从任何可用的样本进行绘图。”
② 解开中枢神经系统自身免疫性炎症谜团 Nature子刊发现关键的表观遗传机制
炎症是机体对抗感染及组织损伤反应的一个重要组成部分,但失控的炎症可导致各种疾病发生,并促进癌症形成。
由德克萨斯大学MD安德森癌症中心领导的一项新研究,有可能会让罹患多发性硬化症(MS)和其他炎症性疾病的患者受益。
这项研究描述了一个叫做Trabid的蛋白质调控因子,是导致多发性硬化症患者中枢神经系统自身免疫性炎症这一谜团中一个重要的部分。研究结果发表在Nature Immunology杂志上。
文章作者,德克萨斯大学MD安德森癌症中心免疫学教授Shao-Cong Sun表示,“我们的研究结果阐明了调控细胞因子基因IL-12和IL-23的一个表观遗传机制,确定了Trabid是炎症性T细胞反应的一个免疫调控因子。Trabid似乎通过控制组蛋白去甲基化酶Jmjd2d的命运调控了组蛋白修饰。”
细胞因子是一些对细胞信号传导极为重要的小蛋白,IL-12和IL-23是炎症介质,与一些炎症性疾病有关联。孙少聪认为,Trabid和Jmjd2d有可能是治疗多发性硬化症一类炎症性疾病的潜在治疗靶点。
“由于慢性炎症是一个重要的癌症风险因子,未来的研究将会探究Trabid和Jmjd2d是否也在癌症形成中起作用。”
研究人员说,IL-12和IL-23一类的促炎症细胞因子连接了一些先天反应和免疫反应,与一些自身免疫性疾病和炎症性疾病相关。先天免疫系统,也称作非特异性免疫系统,其包括一系列的细胞及相关机制,可以非特异性方式保护宿主抵御其他生物的感染。
“包括树突状细胞和巨噬细胞在内先天免疫系统细胞,对适应性免疫反应的性质和强度起重要的调控作用。它们能够识别微生物组件,包括各种受体,这些受体可触发细胞内信号传导事件影响这些细胞的功能。先天免疫系统细胞异常生成促炎症细胞因子也可以导致一些自身免疫和炎症性疾病。”
这一研究发现,删除树突状细胞中Trabid的蛋白质编码基因Zranb1,可抑制IL-12和IL-23表达,破坏炎症性T细胞分化。这一过程保护了研究小鼠免于自身免疫炎症。
③ 对于不明原因的肝病,外显子组测序显神威
据统计,大约两成肝病患者患有“不明原因的肝病”,就是将甲、乙、丙、丁、戊型肝炎病毒全查一遍,也找不到致病的原因。这让医生和患者都很郁闷。不过,最新研究表明,外显子组测序能够发现部分患者中的突变。
耶鲁大学医学院和密歇根大学的研究人员近日对19名不明原因的肝病患者进行了深度表型分析和外显子组测序分析。他们成功地对其中5名患者进行了诊断,发现了四种单基因疾病。这项成果发表在《Journal of Hepatology》杂志上。
耶鲁大学医学院的Silvia Vilarinho及其同事表示:“我们提供了数据,支持外显子组测序(WES)在不明原因肝病患者的诊断和管理中的作用,这可能涉及到其他疾病。”
耶鲁大学在2015年10月至2018年8月期间招募了19名原因不明的肝病患者,他们没有过量饮酒史,诊断时的年龄介于22岁至73岁,利用Illumina测序仪,研究人员对这些患者的蛋白质编码区域进行了测序。
他们将这些序列与人类参考基因组进行比较以鉴定变异,同时利用一种专有的程序来获取外显子组中的拷贝数变异。通过这些分析,他们成功对5名亚洲、欧洲和非洲裔患者进行了诊断,发现他们患有四种不同的单基因疾病。
研究人员解释称,追踪这些变化不仅有助于部分病例的诊断,还有助于人们深入了解肝病生物学、与各种突变相关的临床表现,以及个别患者的潜在治疗方法。
对于一名肝病患者,他们发现了影响PPARG基因的杂合突变,此基因的改变与家族性部分脂肪营养不良3型有关。于是,研究人员采用了瘦素替代疗法,改善了该患者的几种症状。
研究人员还发现两名患者的ABCB4基因中存在隐性突变,导致多药耐药蛋白3(MDR3)出现缺陷。对于另外两名患者,外显子组数据指向了纯合的NDUFB3变异和杂合的APOB变异,这两种变异分别引起非酒精性脂肪性肝炎和肝脏脂肪变性。
基于这些发现,作者认为“一部分患有不明原因肝病的成年患者,存在潜在的孟德尔遗传病,这种疾病在整个童年期间可能无法判断,直到他们进行基因检测”。
在同期杂志的一篇相关社论中,梅奥诊所的Filippo Pinto e Vairo和Konstantinos Lazaridis表示,这项研究强调了外显子组测序在诊断不明原因肝病患者的孟德尔疾病上的重要性,即使没有家族病史。
他们指出,新诊断的个体都不到40岁,这表明外显子组测序方法可能对年轻患者特别有益。他们主张对40岁之前出现症状的患者进行外显子组测序。(生物通 薄荷)
原文检索
Clinical utility of genomic analysis in adults with idiopathic liver disease
DOI: https://doi.org/10.1016/j.jhep.2019.01.036
④ PNAS发现一种阻止肿瘤细胞免疫逃避的新生物标志物
基于The Cancer Genome Atlas (TCGA)数据库中7747份实体肿瘤患者的活体组织检查,这个NLRC5基因的表达,是与各种癌症患者的生存率高度相关的,特别是黑色素瘤、直肠癌、膀胱癌、宫颈癌和头颈癌,生存时间更长的患者倾向于有更多的NLRC5表达。
美国德克萨斯农工大学健康科学中心的研究人员发现,当癌细胞能够阻止NLRC5基因的功能时,它们就能够逃避免疫系统,并进行增殖。
这一研究成果公布在PNAS杂志上。
在正常情况下,免疫系统可识别并成功对抗癌细胞,从而随着它们的发展消除它们。然而,有时候这个过程会发生故障,从而形成肿瘤。“我们发现了癌细胞逃避我们免疫系统并形成肿瘤的主要机制”,文章作者Koichi Kobayashi教授表示。这一结果表明,NLRC5可作为癌症病人生存和治疗反应的一个新型生物标志物,也是新疗法的一个潜在靶标。
Kobayashi说:“癌细胞就是因为基因变化而产生的,如基因突变或不同染色体的重组。正因为如此,所有癌细胞都有新的‘外源’基因,通常宿主T细胞将其检测为肿瘤抗原。这种抗肿瘤系统运行得非常好。”
Kobayashi和他的同事们在几年前发现,NLRC5可调节主要组织相容性复合体(MHC) I类基因。这些基因编码细胞表面的分子,呈现外来蛋白质的片段——例如来自病毒或细菌的蛋白。这些蛋白片段可通知一部分免疫系统,称为细胞毒性T细胞,从而引发来自免疫系统的一种即刻反应,对抗这种特定的外来抗原。
这项研究的新发现在于,相同的系统应该努力摧毁癌细胞,但有时它们能找到一种方法来禁用NLRC5基因,从而使它们逃避免疫系统,并形成肿瘤。该论文的第一作者、Kobayashi实验室的Sayuri Yoshihama博士指出:“如果MHC I类抗原呈现并不起作用,癌细胞将不会被T细胞杀死。我们发现,在癌症中各种机制减少了NLRC5的功能和表达,结果是,肿瘤细胞的免疫逃避。”
事实上,基于The Cancer Genome Atlas (TCGA)数据库中7747份实体肿瘤患者的活体组织检查,这个NLRC5基因的表达,是与各种癌症患者的生存率高度相关的,特别是黑色素瘤、直肠癌、膀胱癌、宫颈癌和头颈癌,生存时间更长的患者倾向于有更多的NLRC5表达。其中,黑素瘤和膀胱癌表现出最显著的差异,NLRC5低表达的患者组,5年存活率为36%,而在NLRC5高表达的患者组中,这个比例为34%。
Kobayashi说:“有了NLRC5作为癌症的一个重要生物标志物,我们最终可以预测癌症患者可以存活多久,以及癌症治疗对他们的效果如何。”这可能对黑色素瘤患者有重要的意义,因为NLRC5变异率相对较高,并且,因为它的表达水平,能够高度预测这种癌症患者的生存率。
该研究小组计划继续研究NLRC5在癌症中的作用,积极发展这一成果相关技术的商业化。临时专利申请已经提交,并基于NLRC5表达水平开发和验证一种测试,用来预测癌症患者的生存率和治疗反应,目前这些工作正在进行当中。希望在于,这种测试将为卫生保健提供者增添一种工具,用于确定癌症患者的最佳治疗策略,以消除昂贵的无益疗法的负担。
最终,Kobayashi和他的团队希望,这一发现也可能给癌症带来新的治疗策略。Kobayashi说:“如果我们能调节NLRC5的激活或其表达水平,这可能是一种新型的癌症疗法。几年来,我们希望我们的研究可以确定潜在的候选药物,可以增加NLRC5的水平,从而帮助我们自身的免疫系统来更好地对抗癌症。”不过,他提出了谨慎的建议。这种逃避免疫系统的机制,不是被每个癌症细胞利用,该研究仍然需要在动物模型中进行复制。
癌症并不是唯一受免疫系统影响的奇怪疾病。Kobayashi之前在免疫功能和遗传学方面的研究,都集中在炎症性肠病,如克罗恩氏病。他们也致力于移植医学研究,试图确定为什么一些器官被新的宿主排斥。
Kobayashi说:“我们现在知道为什么癌细胞可以逃离我们的免疫系统。没有其他的机制如同我们发现的机制一样引人注目。我们设想NLRC5生物标志物可让医生评估和确定每名癌症患者的最佳治疗策略,从而为每年1200万被诊断出患有癌症的人,带来更好的治疗效果。”
原文标题:
NLRC5/MHC class I transactivator is a target for immune evasion in cancer
⑤ Cell Discovery:评估IVF中精子质量的小RNA分子标志物
研究发现精子中小RNA的表达与精子质量高度相关,可为体外受精(in vitro fertilization, IVF)提供有效的生物标记物,提高临床辅助生殖的成功率。
国际学术期刊Cell Discovery在线发表了中国科学院生物化学与细胞生物学研究所吴立刚研究组、上海市计划生育科学研究所施惠娟实验室和复旦大学附属妇产科医院上海集爱遗传与不育诊疗中心陈国武实验室的合作研究成果“Identification of small noncoding RNAs as sperm quality biomarkers for in vitro fertilization”。该研究发现精子中小RNA的表达与精子质量高度相关,可为体外受精(in vitro fertilization, IVF)提供有效的生物标记物,提高临床辅助生殖的成功率。
近几十年来,辅助生殖技术已广泛应用于治疗人类不孕症。然而,仅约30%的IVF和卵胞浆内单精子注射技术(ICSI)可成功受孕。传统的精液参数,如精子密度、精子形态和精子运动能力,并不能有效地判别精子的生育能力。因此,目前临床上迫切需要一种对精液参数正常样品中的精子质量进行评价的方法。
已有研究表明哺乳动物精子细胞中表达多种非编码小RNA,包括microRNAs(miRNAs),PIWI-interacting RNAs(piRNAs),tRNA-derived small RNAs(tsRNAs)和rRNA-derived small RNAs (rsRNAs)等,在精子的发生及成熟过程中发挥了重要的调节功能,因此,有可能利用小RNA作为生物标志物判别精子的生育能力。
在这项研究中,研究人员从接受IVF治疗夫妇的男性患者中收集了精液参数正常的87例精子样本,同时尽可能地排除女方因素影响,并通过体外受精后的优质胚胎率来判断精子的质量。通过对精子中的小RNA进行深度测序和分析,发现人精子中差异表达的tsRNA、rsRNA和miRNA与体外受精后胚胎发育的质量有显著的相关性,其中tsRNA用于评估精子质量的效果最好。
这一发现与之前周琪和Oliver Rando实验室在小鼠中研究发现精子中特异性表达的tsRNA影响胚胎发育和子代表型的结果一致,人精子中的tsRNA有望在临床上作为评估精子质量的分子标志物。
中科院生化与细胞所吴立刚研究员、上海市计划生育科学研究所施惠娟研究员与复旦大学附属妇产科医院上海集爱遗传与不育诊疗中心陈国武主任为本文的共同通讯作者,上海计生所华敏敏博士、生化与细胞所刘伟博士和上海集爱遗传与不育诊疗中心陈颖为共同第一作者,博士张凤娟和工作人员徐蓓英也对该工作提供了帮助。本研究得到了来自国家自然科学基金委、科技部、中科院和上海市科委的经费支持。
原文标题:
Identification of small noncoding RNAs as sperm quality biomarkers for in vitro fertilization
⑥ Nature Biotechnology小小改动,让CRISPR的精确度提高50倍!
一种添加的RNA“发夹”结构能了CRISPR准确度提供50倍
杜克大学生物医学工程科学家研发出一种新方法,可以将CRISPR基因组编辑技术的准确性平均提高50倍,他们相信这种技术将能很快应用到多种编辑技术上。
具体来说,这种方法就是在导向RNA上添加一段短“尾巴”,这种“尾巴”会向后折叠,与其自身结合,形成一个“发夹”结构,只有靶向DNA序列能解开。
这一研究成果公布在4月15日的Nature Biotechnology杂志上。
多个CRISPR系统都会产生不必要的遗传编辑
“一般来说,CRISPR准确性高,但已经有了一些例子出现了脱靶效应,因此这个研究领域对于提高特异性普遍关注。但到目前为止提出的解决方案都不能在不同的CRISPR系统之间轻松转换”,文章作者,杜克大学生物医学工程副教授Charles Gersbach说。
CRISPR-Cas9是一种防御系统,细菌用它来靶向和切割入侵病毒的DNA。虽然第一个被设计用于人体细胞的CRISPR技术源自Streptococcus pyogenes这种细菌,但其它细菌也具有其它的形式。
一直以来,科学家们花费了大量时间,找到了特殊的新CRISPR系统,不断添加到CRISPR库中。例如,一些系统较小,适合病毒载体递送至人体细胞用于基因治疗。但无论这些系统的功能如何,都会产生不必要的遗传编辑。
CRISPR系统的一个共同特性是利用RNA分子作为指导,一旦导向RNA找到其互补的基因序列,Cas9酶就像剪刀一样在DNA中切割,促进基因组序列的改变。但是因为每个序列只有20个核苷酸长,而人类基因组含有大约30亿个碱基对,所以搜寻过程漫长,而且CRISPR有时会出现错误,对上了错误的碱基对。
提高CRISPR准确性的一种方法是两个Cas9分子结合到相同DNA序列的相对链上,完成完全切割。虽然这种方法有效,但它会给系统增加更多部件,增加复杂性,难以实现。
另一种方法是对Cas9蛋白进行基因工程改造,使其功效降低,从而更少的犯错误,但是要构建这样的蛋白并不容易,同时对于不同的CRISPR系统,需要不同的蛋白工程设计。
导向RNA的设计
“现在似乎每周都会发现一种新的CRISPR系统,它们具有独特的性质,在特定的应用中非常有效,”Gersbach说,“每当我们发现新的CRISPR蛋白,进行广泛的重新设计并不是一个容易实现的解决方法。”
“我们希望能研发出对于任何类型的CRISPR系统都是通用的方法,”博士生Dewran Kocak说,“所有CRISPR系统的共同点是都需要导向RNA,这些短RNA更易于设计。”
研究人员提出了新的解决方案:将导向RNA延伸多20个核苷酸,让其自身折叠,变成原始导向RNA的“尾巴”,形成发夹形状。如果DNA序列中有一个碱基不正确,这就会形成一种无法解开的锁定,而由于导向RNA更倾向于与DNA结合,因此碰到正确组合的DNA,就能打开,靶向结合。
“我们能够对这种‘锁定’的强度进行微调,方便导向RNA在达到正确匹配时仍能正常工作,”Kocak说。
研究人员表示,这种方法可以将四种不同细菌菌株的五种不同CRISPR系统的编辑准确率(人体细胞切割的准确性)平均提高50倍。在其中一个案例中,甚至提高了200多倍。
“这是一个非常简单的想法,Dewran多年来的工作表明它的工作方式与我们认为的相符,这是一个很好的解决方案,可以摆脱脱靶效应。”
下一步,研究人员希望能够看到这种方法应用于多少种不同的CRISPR变体,并且深入探索锁定机制的工作原理,CRISPR变体之间是否存在差异等。由于这些实验是在培养的细胞中进行的,研究人员也迫切希望看到这种方法在实际动物疾病模型中是否能提高CRISPR的准确性。
原文标题:
Increasing the Specificity of CRISPR Systems with Engineered RNA Secondary Structures