酶活性位点催化残基特征分析
纽普生物
Bartlett 等人分析了 178 个酶(有结构报道)及他们的催化残基特征,并总结成文。
催化残基定义:
1. 直接参与催化,比如作为亲核试剂的残基.
2. 对另外一个直接参与催化的残基或者水分子施加影响的残基(例如静电或者酸碱作用)。
3. 稳定过渡态中间体的残基。
4. 对底物或者辅因子施加影响,从而辅助催化。比如极化作用。
平均每个酶有 3.5 个催化残基。
残基的分布频率及所在的二级结构特征
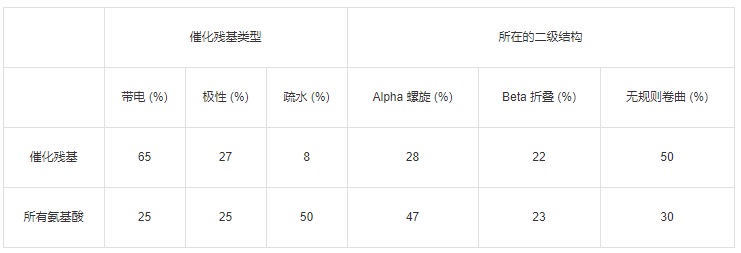
在所有催化残基中,有 65% 的残基是带电氨基酸(H, R, K, E, D),有 27% 的残基是极性氨基酸(Q, T, S, N, C, Y, W),只有 8% 的残基是疏水氨基酸。
这还是比较好理解的,毕竟催化过程中包含质子和电子的运动及电荷的稳定,这需要带电和 / 或极性残基来提供静电力。注意,上述频率分布和氨基酸的自身的丰度没有相关性。
表:催化残基类型和它们的二级结构与数据集中所有氨基酸的对比
组氨酸在所有催化残基中的占比是 18%,尽管它只有 2.7% 的丰度(低)。组氨酸尤其适合参与反应过程,因为它在生理 pH 值下既可以带电也可以表现为中性,从而可以发挥亲核试剂、酸、碱的作用,也可以参与稳定反应的中间态。
天冬氨酸和谷氨酸残基在催化残基中分别占比 15% 和 11%。他们自然丰度都差不多,分别是 5.7% 和 5.9%。可能是因为与谷氨酸相比,天冬氨酸有比较短的侧链(少一个甲基),使得天冬氨酸的侧链柔性相对弱一点,位置相对固定,从而有助于催化。
精氨酸和赖氨酸在催化残基中分别占比 11% 和 9%。精氨酸和赖氨酸的自然丰度分别是 4.9% 和 9%。这种偏好性可能是因为精氨酸侧链有三个氮基团,而赖氨酸侧链只有一个氮基团。
另外,因为精氨酸的侧链可能形成更多的静电相互作用,所以它可以定位更加精准,这有助于催化。精氨酸侧链还具有良好的几何结构,可以稳定磷酸基上的一对氧原子,磷酸基是一种常见的生物基团。
半胱氨酸(有自由巯基的)在催化残基中占比 5.6%,而它自然丰度只有 1.2%。
综上所述,组氨酸和半胱氨酸都有着最高的可能成为催化残基,接下来就是带电残基,然后再就是极性残基,极性残基之后就是一些疏水氨基酸。
侧链和主链相互作用
在催化残基中,有 92% 的残基都用到侧链相互作用,剩下的 8% 则是主链相互作用。在那些用到主链相互作用的残基中,82% 通过的 N-H 基团,18% 通过 C = O 基团来参与作用。主链基团通常是来稳定反应中间态的,比如磷酸酶 A2 的 Gly30.
甘氨酸在主链相互作用的残基中占比最高,高达 44%
溶剂可及性
与完全暴露在蛋白表面的残基溶剂可及性(% RSA = 100%)相比,89% 的催化残基的相对溶剂可及性(% RSA)不到 30%。
这其中有 50% 的催化残基的 RSA 小于等于 10%;有 20% 的催化残基的 RSA 介于 10% 和 20%;有 5% 的催化残基的 RSA 为 0,也就是被完全包裹。大部分催化残基很少暴露在溶剂中,主要原因可能是正确的定位和限制催化残基的可动性。
残基柔性
晶体结构中的 B 因子是用来表征残基的柔性的,催化残基的 B 因子比所有残基的 B 因子倾向于更低,表明催化残基相对更加刚性。酶蛋白在结合底物或者辅因子之后,这些催化残基会变得更加固定。
具有催化活性的精氨酸,赖氨酸,天冬氨酸和谷氨酸,比平均 B 因子值更低。精氨酸的 1 到 2 个氮基团被 「栓」 住,其余的发挥催化功能。赖氨酸有个非常柔性的侧链,也需要被拴住来发挥催化功能。对于谷氨酸和天冬氨酸来说,羧酸基团的氧原子之一可以被束缚而另一个具有催化功能。具有催化活性的组氨酸和半胱氨酸残基的 B 因子分布与所有组氨酸和半胱氨酸残基的无太大差别。这可能是由于这两种氨基酸出现催化残基的比例太高所导致的。
保守性
催化残基具有更高的保守性,随着与催化残基距离的增加,残基的保守性也稳定下降。这表明与活性位点附近的其他残基相比,催化残基的强选择压力,这对于底物识别是重要的。
有效的催化取决于关键原子的精确定位,这通常只能通过使用特定的氨基酸残基(例如天冬氨酸代替谷氨酸)来实现。另外,空间结构上接近催化残基的残基比氨基酸残基序列中相近残基更保守。需要注意的是,酶活性位点不一定是球形的,并且球体也可以保留一些保守的、被包裹的核心残基,因为它们对于维持蛋白质的结构完整性是必需的。
氢键
残基与水分子之间形成的氢键,本文不讨论。研究案例中,93% 的催化残基至少会形成一个氢键,有作为供体的,也有作为受体的。这表明催化残基的构象自由度其实很受限制的。84% 的催化残基通过主链 N-H 或者 C = O 基团至少形成一个氢键。而 75% 的催化残基通过侧链原子至少形成一个氢键。这表明,这些催化残基的主链和侧链基本都被束缚住了。
在这些通过 N-H 或者 C = O 基团形成氢键的残基中,几乎所有(97%)氢键都是与蛋白的其他残基之间形成的,有 8% 的比例是与配体形成的。这些氢键中的大部分可能对保持催化残基的位置是必要的。
在这些通过侧链基团形成氢键的残基中,94% 的氢键都是与蛋白的其他残基之间形成的,19% 的比例是与配体之间形成的。
四级结构与结构域
几乎所有酶的活性位点都在一个蛋白亚基上,只有 11% 的酶的活性位点由超过 2 个亚基组成。






