突破多年脑癌治疗瓶颈!Nature 揭示免疫监视脑瘤的新策略
长久以来,学界一向认为大脑中没有经典的淋巴引流系统。没有淋巴引流系统介导的免疫监视也意味着脑中只有非常少量的 CD8 T 细胞相关的特异性免疫反应,引发了脑癌的迅速生长。
大脑中免疫系统的先天不足,让包括 PD- 1 疗法在内的免疫检查点疗法在脑瘤治疗中没了用武之地。而四年前,研究人员在外层脑膜发现了脑膜淋巴管。它的存在,让在脑瘤中实现免疫监视成为了可能。
2020 年 1 月 15 号,来自耶鲁大学医学院 Akiko Iwasaki 教授与神经学 Jean-Leon Thomas 教授共同领导的团队在 Nature 上发表了题为《VEGF-C-driven lymphatic drainage enables immunosurveillance of brain tumours》的论文,揭示了通过 VEGF-C 可以促进大脑内的淋巴引流,最后使大脑获得对脑瘤的免疫监视能力。

主要研究内容
研究人员使用胶质母细胞瘤(Glioblastoma, GBM)作为研究对象,GBM 是恶性程度最高的脑癌,占所有脑部肿瘤中的 15%。其复发率很高,五年生存率仅为 3 - 7% 之间。

他们一开始利用腺病毒相关载体 AAV9 在小鼠脑内过表达了 VEGF-C, 并发现接受 AAV9 -VEGF-C 注射的实验组小鼠脑膜淋巴管的淋巴窦面积出现了明显的上升。
与此同时,实验组对 GBM 实现了 100% 的清除。
因为此前已经有研究证明下颌淋巴结与颈外侧浅淋巴结对中枢神经系统的抗原识别有非常重要的作用,所以研究人员随后将过表达 VEGF-C 的小鼠中通往这两个淋巴结的淋巴管进行了结扎。
发现 VEGF-C 在结扎后的小鼠中不能帮助他们抵抗脑瘤;而通过 CD8 和 CD4 抗体清除 CD8 / 4 T 、细胞后,VEGF-C 的预防作用也大打折扣。
这两个实验证明了 VEGF-C 对脑瘤的预防作用需要有抗原识别作用的淋巴结和 CD8 / 4 T 细胞的参与。
图片来源:Nature
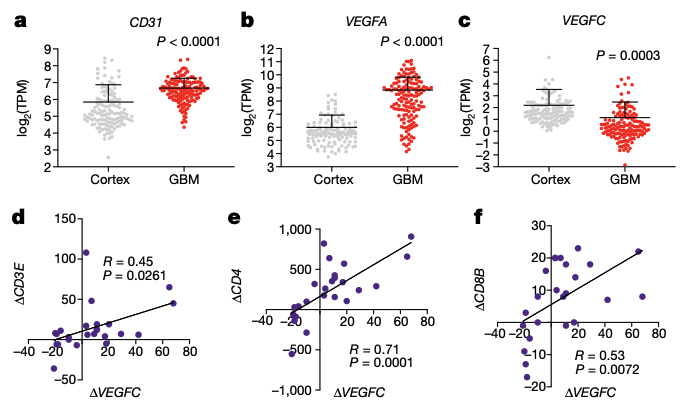
随后,研究人员通过对 GTEX 和 TCGA 数据库中的正常人与 GBM 患者的脑组织转录组进行分析,发现了 GBM 组织中出现了更高的血管促进因子 VEGF-A 和 CD31 的表达,而 VEGF-C 的表达则出现了显著的下降。
而在另外一个关于抗 PD- 1 疗法对 GBM 的治疗作用的研究中,研究人员发现 VEGF-C 的表达与 T 细胞浸润出现很强的相关性。
这些临床数据也证明 VEGF-C 在 GBM 中的缺失可能导致了 GBM 的发生或生长。

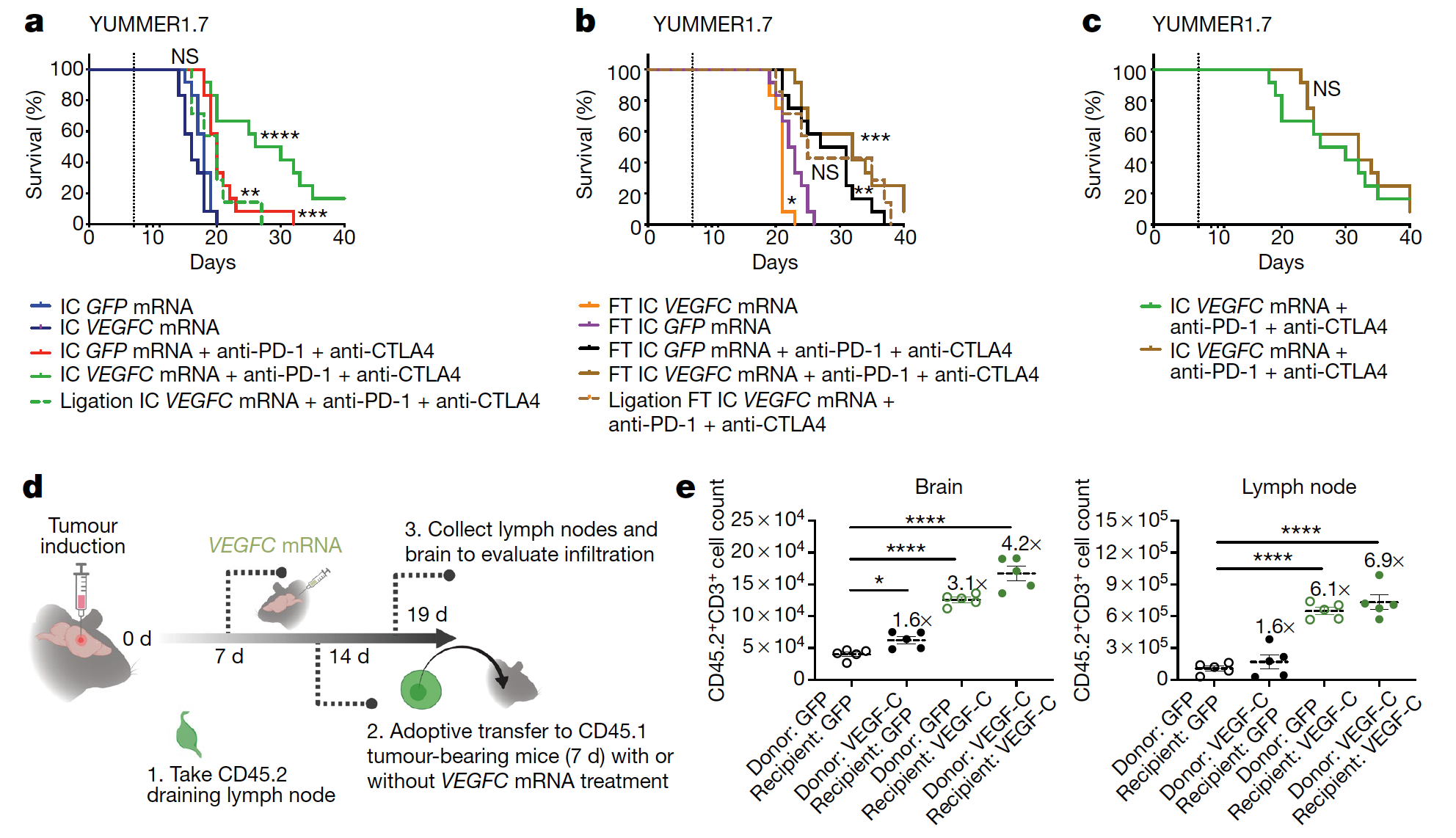
为了进一步证明 VEGF-C 是否可以用来通过增强免疫监视来治疗 GBM, 研究人员直接将 VEGF-C mRNA 介导的过表达与 PD- 1 抗体进行了联用。
不出所料,单独的 anti-PD- 1 治疗对 GBM 的效果非常有限,只是出现轻微的改善。
但当 anti-PD- 1 与 VEGF-C mRNA 联用时,出现了极其显著的协同作用。一些其他此前被证明对 GBM 效果不佳的免疫检查点抑制剂的药效也在与 VEGF-C 联用时出现了显著的加强。
同时,在 VEGF-C 过表达的小鼠中,GBM 特异性 T 细胞的百分比在中枢神经相关的淋巴结和脑瘤组织中都出现了显著了上升。
下一个研究人员面临的问题是:VEGF-C 的作用到底是通过影响颅内微环境还是活化 T 细胞来实现的?
为了解决这个问题,研究人员使用了模拟脑转移的黑色素瘤,发现无论转移瘤是只在颅内还是同时在颅内与颅外,VEGF-C 都可以强化免疫检查点抑制剂的功能。
这说明了 VEGF-C 既可以在颅内通过改变脑内微环境帮助 T 细胞浸润,也可以在颅外通过活化 T 细胞抵抗肿瘤。
为了进一步证明这一点,研究人员进行了浸润白细胞移植试验,发现单独活化 T 细胞与单独改善瘤内微环境都可以提高肿瘤和淋巴结内的 T 细胞数量,而两者叠加后出现了进一步协同作用。
这证明 VEGF-C 通过两种机制帮助大脑获得对脑瘤的免疫监视功能。
研究亮点分析
包括 GBM 在内的部分脑癌是预后较差的癌症种类,而常规的手术疗法会对病人造成极大的创伤,并且有着较高的复发率。由于大脑中薄弱的免疫系统,近年来如日中天的免疫疗法在脑癌的治疗中毫无建树。
本研究利用近年来逐渐引起人们重视的脑膜淋巴系统,通过过表达 VEGF-C 的方法达到淋巴引流以帮助大脑获得免疫监视的能力,以此强化免疫检查点抑制剂的疗效。
本研究突破了多年脑癌治疗中瓶颈,也为免疫疗法在脑癌的应用开辟了一番新的天地。







