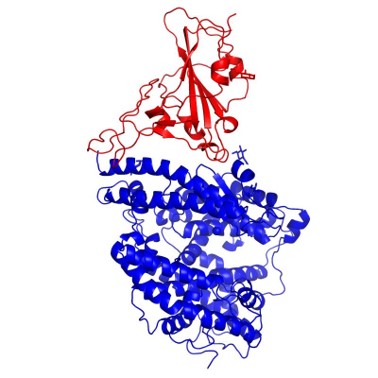
西湖大学成功解析新冠病毒入侵人体的关键 - 人 ACE2 的全长结构!
在与时间和疫情争分夺秒的科研攻关中,中科院武汉病毒研究所、武汉市金银潭医院及湖北省疾病预防控制中心联合团队于 2 月 3 日在 Nature 在线发表了题为《A pneumonia outbreak associated with a new coronavirus of probable bat origin》的研究工作,揭示了新型冠状病毒可能利用血管紧张素转换酶 2(ACE2)入侵细胞。
随后,同济大学医学院左为教授团队通过对四万三千多个肺脏细胞进行高通量单细胞测序分析,证实新型冠状病毒 S 蛋白与 ACE2 蛋白结合自由能约为 - 50.6kcal/mol。
进一步表明,与 SARS 冠状病毒相似,新型冠状病毒同样依靠病毒表面的 S 蛋白与细胞表面的 ACE2 受体进行结合,并在细胞质中释放出 RNA,指导合成大量新的病毒颗粒,导致被感染个体产生疾病。
因此,阐明新型冠状病毒表面 S 蛋白与其入侵人体细胞的「门户」蛋白 ACE2 间的相互作用成了科研攻关的重中之重。
2 月 19 日,西湖大学周强团队在预印版平台 bioRxiv 在线发表了题为《Structure of dimeric full-length human ACE2 in complex with B0AT1》的研究成果。周强团队率先利用冷冻电镜技术成功解析了新型冠状病毒侵入人体的关键 - 人 ACE2 的全长结构。
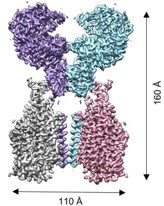
ACE2 -B0AT1 复合体冷冻电镜图
图片来源:bioRxiv
ACE2 是羧肽酶 ACE 同源物,2000 年 ACE2 成功克隆后,迄今为止已经鉴出多种功能。ACE2 及其同源物 Collectrin 可与氨基酸转运蛋白结合,参与肾脏和肠道氨基酸吸收。
同时,ACE2 也是 17 年前 SARS 冠状病毒和此次新冠状病毒的重要受体。
由于 ACE2 属于膜蛋白,其在体外很难稳定存在。这一点为解析 ACE2 全长结构带来了重重困难。ACE2 可与肠道 B0AT1 氨基酸转运蛋白(SLC6A19)结合形成复合物,推测可能与 ACE2 发挥酶切功能为 B0AT1 提供中性氨基酸有关。
基于上述 ACE2 与 B0AT1 的相互作用,周强团队通过共表达方法获得了稳定 ACE2 -B0AT1 复合体,并利用冷冻电镜解析了其三维结构,分辨率达到 2.9 埃。
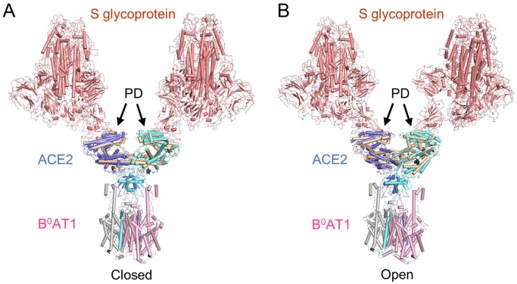
ACE2 二聚体具有开放和关闭两种构象
ACE2 -B0AT1 复合体和 S 蛋白复合体通过 PD 结构域锚定
图片来源:bioRxiv
除了人 ACE2 全长结构外,蛋白糖基化位点对于新型冠状病毒同其受体相互结合同样至关重要。此前有研究报道,氯喹对 SARS 冠状病毒感染的抑制作用可能与其干扰 ACE2 糖基化有关。故 ACE2 蛋白糖基化位点的揭示可能有助于筛选针对新型冠状病毒糖基化的药物。
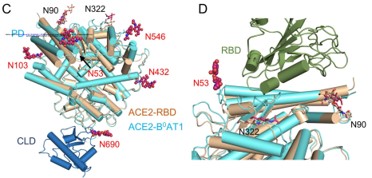
人 ACE2 的糖基化位点
图片来源:bioRxiv
此前,美国德克萨斯大学奥斯汀分校 Jason McLellan 教授及其团队,在预印版平台 bioRxiv 上发表了题为《Cryo-EM Structure of the 2019 -nCoVSpike in the Prefusion Conformation》的研究论文,揭示新型冠状病毒侵染机体的关键蛋白 ——S 蛋白的冷冻电镜结构。
图片来源:bioRxiv
Jason McLellan 教授团队根据已公开的新型冠状病毒基因组序列,合成并纯化了新型冠状病毒 S 蛋白的膜外结构域,并用冷冻电镜获得 3207 张纯化 S 蛋白照片,经过 3D 重建后获得分辨率为 3.5 Å 的 S 蛋白三聚体结构。
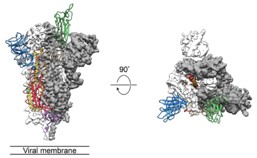
新型冠状病毒 S 蛋白膜外结构域冷冻电镜图
图片来源:bioRxiv
新型冠状病毒利用高度糖基化的同源三聚体 S 蛋白进入宿主细胞。S 蛋白结构重排后将病毒融合进入宿主细胞的细胞膜。这一过程包括病毒的 S1 亚基结合到宿主细胞受体上,引发三聚体失去稳定性, S1 亚基脱落 S2 亚基形成高度稳定的融合后结构。
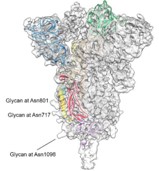
新型冠状病毒同源三聚体糖基化 S 蛋白
图片来源:bioRxiv
为了接近宿主细胞受体,S1 亚基受体结合结构域 RBD 变构实现对受体结合关键位点的隐藏或暴露。
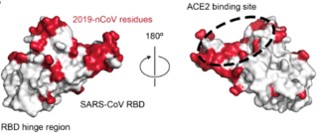
S1 亚基受体结合结构域 RBD 变构
图片来源:bioRxiv
同样,新型冠状病毒 S 蛋白结构的成功解析,为研发特异性抗病毒药物以及疫苗开发提供了重要的结构生物学支撑。
结语
人 ACE2 全长结构和新型冠状病毒 S 蛋白冷冻电镜结构图的相继破译,为进一步解析全长 ACE2 和新型冠状病毒 S 蛋白复合体三维结构奠定了结构生物学基础。
同时,有助于人类理解新型冠状病毒感染靶细胞的结构基础和功能特征,对发现和优化阻断新型冠状病毒进入细胞的特异性抑制剂有重要作用,为后续疫情防控和药物开发奠定了坚实基础。