Science 子刊,同济高崚等发现诱导多能干细胞的新应用,其外泌体可改善心梗
据《中国心血管病报告 2013》显示,我国总心血管病患者达 2.9 亿,心血管病死亡是居民总死亡原因的首位。数据显示,我国每年新发心梗约 60 万例,死亡比例在三成以上,中青年人猝死频发是近年来的新特征。
在猝死患者中,大部分都有冠心病或其他冠状动脉病变。让人忧心警惕的是,国内心肌梗死发病年龄明显提前,特别是在青年科学家英年早逝的新闻一次次的刺痛大家的心扉。
在这种大环境下,心肌梗死的应急处理和预后恢复的研究显得尤为重要,近来同济大学联合国际团队在心肌损伤的恢复上取得新的突破 ——
2020 年 9 月 16 日,美国阿拉巴马大学伯明翰分校张建一、中国同济大学附属东方医院高崚研究员团队合作,在 Science Translational medicine 上发表了,题为 Exosomes secreted by hiPSC-derived cardiac cells improve recovery from myocardial infarction in swine 的研究性论文,发现由 人诱导多能干细胞(hiPSC)衍生的心脏细胞外泌体,可改善猪心肌梗死的恢复,而不会增加心律失常并发症的发生率,为心肌损伤提供了无细胞治疗的新选择。

图片来源:Science Translational Medicine
研究背景
多种动物模型研究表明,hiPSC 可以生成心肌细胞(CMs),平滑肌细胞 (SMCs) 和内皮细胞 (ECs),在心脏修复疗法上具有广阔前景。然而,这种技术在临床上还存在很多问题,如细胞驻留率和植入率低,肿瘤发生和室性心律不齐的潜在风险,与传统治疗剂相比,细胞产品也更难以存储和运输,所以其临床应用仍然受到限制。因此,人们开始寻找更好的心血管治疗方法,比如利用 hiPSC 和 hiPSC 衍生细胞的心脏保护和再生特性,同时又避免了细胞移植的复杂性。
本研究通过使用来自不同 hiPSC 衍生细胞类型(hiPSC-CM,hiPSC-EC 和 hiPSC-SMC)的外泌体进行大量体外测定,并实验构建心肌梗死模型后,用 hiPSC 衍生心脏细胞分泌的外泌体治疗,评估猪的心肌恢复效果。
研究内容
表征 hiPSC 衍生的心脏细胞及其外泌体
首先,研究者对得到的 hiPSC-心脏细胞进行表征。从人心脏成纤维细胞中重编程,获得hiPSC-心脏细胞,并分为 hiPSC-CM,hiPSC-EC 和 hiPSC-SMC。纯化一周后,检测细胞标志的表达。
随后,研究者分离出不同细胞或细胞组合的外泌体,进行表征。具体来说,就是从培养的 hiPSC-CM,hiPSC-EC 和 hiPSC-SMC 或包含三种细胞类型的共培养物(hiPSC-CMs:hiPSC-ECs:hiPSC-SMC,2:1:1 比例)中,分离出外泌体。纳米粒子追踪和透射电子显微镜分析表明,分离的外泌体直径约 98 nm,具有双层膜;蛋白质阵列检测,确定了外泌体特异性标记物的存在。

图片来源:Science Translational Medicine
hiPSC-心脏细胞外泌体增强血管生成活性并保护缺氧损伤
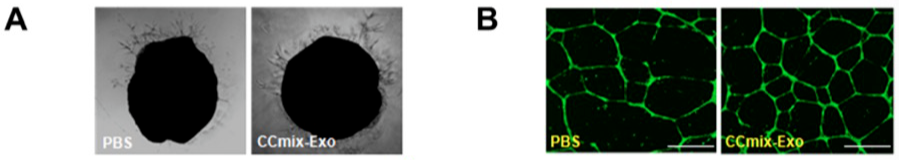
研究者体外检测了 hiPSC-心脏细胞外泌体的功能。分别处理 hiPSC- ECs,hiPSC-SMCs,hiPSC-CMs,或共培养混合物的外泌体后,与处理人真皮成纤维细胞(hdFB)的外泌体或 PBS 相比,从主动脉环萌芽的内皮微血管,培养的人脐静脉内皮细胞中的管形成,均显著增加。
此外,用 hiPSC-EC,hiPSC-SMC 和 hiPSC-心脏细胞混合物,不用 hiPSC-CM 或 hdFB 外泌体处理,在无血清低氧条件下,显著增加了钙瞬变幅度,减少了凋亡,增加 ATP 的含量,但在常氧条件无显著作用。hiPSC-心脏细胞外泌体逆转了低氧诱导的 AKT 磷酸化下降。因此,hiPSC-心脏细胞混合物产生的外泌体可以增强内皮细胞的血管生成活性,促进 hiPSC-CM 的增殖,并通过阻止细胞凋亡,维持细胞内钙稳态,改善能量代谢,来保护 hiPSC-CM 缺氧。
图片来源:Science Translational Medicine
hiPSC-心脏细胞外泌体改善的心脏功能,限制不良重塑
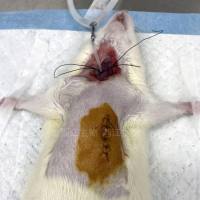
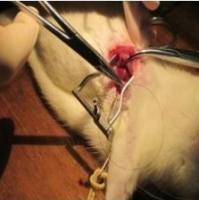
随后,研究者构建了猪心肌梗死模型,在体检测了 hiPSC-心脏细胞和 外泌体的心脏保护和再生效果,分成五组:
Sham:假手术组,除了不结扎,其余步骤与 MI 相同;
MI:心肌梗死组,冠状动脉左前降支结扎 60 分钟后再灌注;
MI + Cell:hiPSC-CCs 细胞混合处理组(一千万个 hiPSC-CM,五百万个 hiPSC-EC 和五百万个 hiPSC-SMC);
MI + Fra:与来自 MI + Cell 组,相同剂量细胞的均质碎片组;
MI + Exo:从混合的 hiPSC-CCs 中分离的 7.5 mg 外泌体组(hiPSC-CMs: hiPSC-ECs: hiPSC-SMCs =2:1:1);
治疗操作方法:将细胞,碎片或外泌体,直接注射到心肌缺血区域。
手术四周后,在对动物进行安乐死评估心肌肥大之前,通过磁共振成像(MRI)和血液动力学分析,评估心肌梗死或假手术后 4 周的心脏功能。测量梗死面积,左心室射血分数,梗死区和梗死边界区域的左室舒张末期容积,收缩期增厚分数,区域壁应力,以及左室与体重的比值。这些指标在 MI+ Cell,MI+ Fra 和 MI+ Exo 组几乎相等,但较 MI 组显著降低。MI + Cell 组和 MI + Exo 组中心肌细胞的横截面积也相同,并且显著低于 MI 组。
这些结果表明,将 hiPSC-心脏细胞,hiPSC-心脏细胞片段和 hiPSC-心脏细胞外泌体,递送到猪心脏的梗死区域时,它们的心脏功能,壁应力,梗死面积,心肌肥大都有所改善。

图片来源:Science Translational Medicine
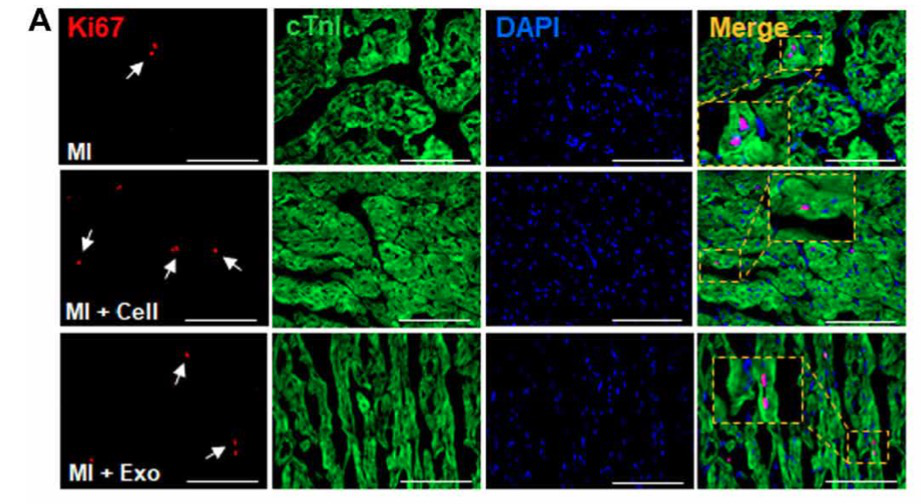
hiPSC-心脏细胞外泌体可促进血管生成,增殖,细胞存活和迁移分子的表达
再接下来,研究者进行了免疫荧光分析。测量血管密度(表达 CD31 的结构),小动脉密度(表达 CD31 和 SMA 的结构),以及心脏边缘区中的增殖(表达 Ki67 的细胞和含有磷酸化组蛋白 3 的细胞)。这些指标在 MI + Cell 组与 MI +Exo 组动物相似,均显著大于 MI 组。此外,MI + Cell 组与 MI +Exo 组凋亡阳性细胞的下降几乎相同,在促进细胞迁移中起关键作用的 Con43 和 CXCR4 分子表达水平增加也相同。
这些结果表明,移植的 hiPSC-心脏细胞诱导旁分泌,从而促进血管和小动脉的生长,细胞迁移,增殖和存活,以及细胞内通讯,并且可以通过使用 hiPSC-心脏细胞外泌体来复制这些作用。

图片来源:Science Translational Medicine
猪心梗模型中,hiPSC-心脏细胞外泌体改善细胞能量代谢
在心脏中,肌酸激酶(CK)快速可逆地将磷酸肌酸和腺苷 5'- 二磷酸,转化为 ATP 和肌酸,提供心脏的主要储备能量。最后,研究者进行了 31P 磁共振波谱磁化饱和转移(MRS-MST)实验,以确定在 Sham,MI,MI + Cell 和 MI +Exo 组动物之间,心肌能量代谢的指标是否有所不同。MI 诱导或假手术第 4 周后,PCr/ATP 比和 FluxPCr→ATP 均下降,MI + Cell 和 MI+ Exo 组比 MI 组更大。
此外,蛋白质印迹分析表明,心脏边缘区,MI+ Cell 组和 MI+ Exo 组中线粒体 ATPase- β(mtATPase-β),线粒体 CK(CK-Mt)和心肌 CK(CK-M)的蛋白表达几乎相等,均比 MI 组心脏的相应区域更大,而边缘区的脑 CK(CK-B),三组的表达相似。分光光度法检测也得到了同样的结果。这些观察结果表明,hiPSC-CC 和 hiPSC-CC 外泌体均阻止或逆转了心肌梗死发生的部分心肌能量代谢变化。
图片来源:Science Translational Medicine
创新点及问题
该研究首次在猪心肌梗死模型中,证明 hiPSC-CC 外泌体的改善心肌梗死的显著效果。由于大多数移植细胞在给药后,存活时间不超过几天,所以还研究了均质化的细胞碎片,也与细胞治疗具有同样的效果。
在体内,hiPSC-心脏细胞,hiPSC-心脏细胞片段或 hiPSC-心脏细胞外泌体,用三种不同方式治疗的动物的左心室功能,梗死面积,壁应力,心脏肥大,细胞凋亡和血管生成明显改善。
在体外,hiPSC-心脏细胞产生的外泌体,在培养的内皮细胞和分离的主动脉环上,促进血管生成活性。通过减少细胞凋亡,维持细胞内钙稳态,增加细胞 ATP 含量,保护无血清低氧培养基对 hiPSC-CMs 的毒性作用。
因为细胞和外泌体是在开胸手术中给药的,该技术目前的问题,是不能重复给药。此外,在体内研究中选择的 hiPSC-心脏细胞外泌体剂量(7.5 mg),是根据之前的研究确定的,该剂量表明 hiPSC-心脏细胞衍生的外泌体,在大动物心肌损伤模型中,与 hiPSC-心脏细胞本身具有同样的益处。虽然结果表明这两种治疗方法具有可比性,但仍需进行其他研究,确定哪种方法可能对心肌梗死,心力衰竭或其他类型的心血管疾病患者最有益。