凋亡的三岔路口,这个通路把控!韩家淮院士/莫玮等揭示坏死性凋亡的新机制
万物的尽头都是死亡,生命的基础结构细胞也不例外。
通常来讲,细胞的死亡途径也分「自杀」与「他杀」,即细胞程序性死亡 —— 细胞凋亡 (Apoptosis),以及细胞坏死(Necrosis)。随着科学的发展,人们对细胞的死亡方式逐渐有更深的认识,在这两种分类上又进行了细致的划分。
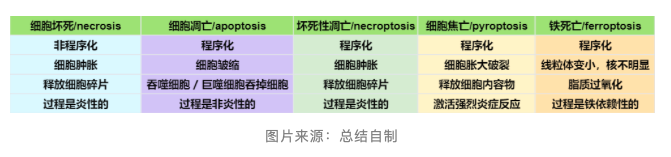
狭义上的细胞凋亡(Apoptosis)由 caspase-8 介导,不引起组织损伤;坏死性凋亡(Necroptosis)是近年来新发现的一种受调控的死亡方式之一,发生在 caspase-8 受抑制的情况下;细胞焦亡(pyroptosis)则描述了一种受调节的死亡过程的炎症模式,常发生在病原体入侵时,对于增强抗微生物免疫极为重要。几种重要死亡方式特征对比图如下:
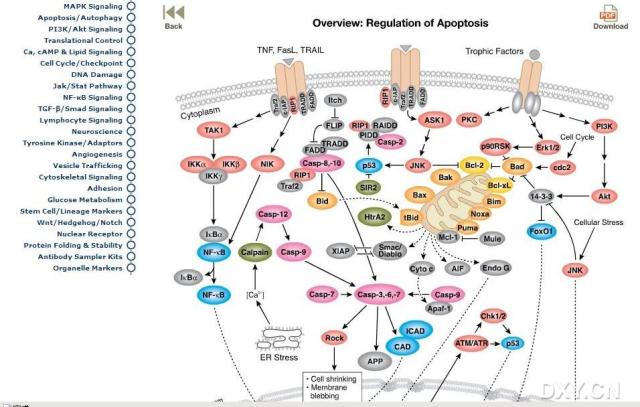
2019 年 12 月,德国科隆大学 Hamid Kashkar 等在 Nature 发表题为 Caspase-8 is the molecular switch for apoptosis, necroptosis and pyroptosis 的文章,报道 caspase-8 也诱导细胞焦亡,是站在细胞凋亡三岔路口的「开关」。
那么,这个开关如何调控开启决定细胞命运的走向呢?韩家淮院士和莫玮教授团队从表观遗传学的角度出发,对这个问题进行了探究!
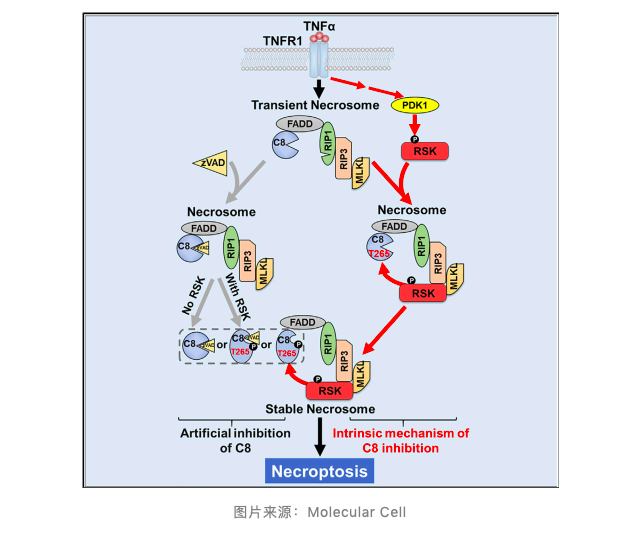
2020 年 9 月 25 日,来自厦门大学生命科学学院的韩家淮院士团队和莫玮教授团队合作在 Molecular Cell 期刊上发表题为 A Non-canonical PDK1-RSK Signal Diminishes Pro-caspase-8-Mediated Necroptosis Blockade 的研究性论文。在该论文中, 作者发现非经典的 PDK1-RSK 通路能够诱导 Pro-caspase-8 蛋白 Thr265 位点发生磷酸化而失活,从而降低 caspase-8 对坏死性凋亡的阻断作用。

研究背景:
当感知肿瘤坏死因子受体超家族(TNFR)、Toll 样受体 3 和 4(TLR3/TLR4)、干扰素受体(IFNRs)信号以及病原微生物入侵时, 细胞内活化的 RIP1-RIP3-MLKL 信号通路将介导坏死性凋亡的发生。
大量研究表明在体外诱导坏死性凋亡时需要使用 zVAD 抑制 caspase-8(半胱氨酸 - 天冬氨酸蛋白酶 8,能够在靶蛋白的特异天冬氨酸残基部位进行切割,介导细胞凋亡)剪切活性,阻断后者对 RIP1 的剪切以及破坏坏死小体的形成。
但是在体内和一些细胞系(如 L929 细胞)中使用 TNF 诱导坏死性凋亡是却不需要使用 zVAD,这暗示细胞中存在一种内在机制能够降低 caspase 8 对坏死性凋亡的阻断作用。
研究内容:
1. caspase-8 蛋白 Thr265 位点磷酸化抑制其对坏死性凋亡的阻断作用
为了探究降低 caspase-8 对坏死性凋亡阻断作用的内源机制,作者以 caspase-8 蛋白自身为研究起始点。有研究表明 caspase-8 的活性能够被翻译后修饰调控,比如磷酸化。
通过质谱分析,作者发现 caspase-8 蛋白上存在 9 个潜在磷酸化位点。对这些潜在的位点进行组成型磷酸化突变分析,结果显示只有 Thr265 位点磷酸化后,caspase-8 的剪切活性显著降低。此外,在 caspase-8 缺陷的 L929 细胞中回补 Thr265 磷酸化突变质粒后,细胞坏死性凋亡明显增加。这表明 caspase-8 蛋白的 Thr265 位点磷酸化能够降低其对坏死性凋亡的阻断作用。
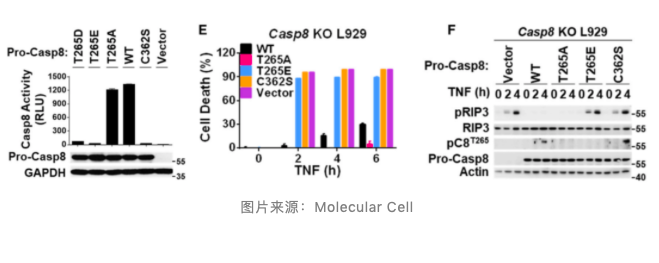
2. 在胚胎发育过程中 caspase-8 蛋白 Thr265 位点磷酸化抑制其对坏死性凋亡的阻断作用
既然在体外 Thr265 位点磷酸化能够逆转 caspase-8 对坏死性凋亡的阻断作用,那在体内是否也有相同的结果呢?作者构建了 Casp8T265E/T265E 组成性磷酸化突变小鼠,发现纯合小鼠卵黄囊血管系统异常,胚胎致死。免疫荧光和免疫组化结果显示 Casp8T265E/T265E 突变小鼠中坏死性凋亡的标志物 pRIP3 和 pMLKL 显著上调。与此同时,Rip3 和 Mlkl 缺陷能够逆转 Casp8T265E/T265E 突变小鼠胚胎致死。这表明在体内 Thr265 位点磷酸化能够抑制 caspase-8 活性,诱导坏死性凋亡的发生,从而导致小鼠胚胎致死。
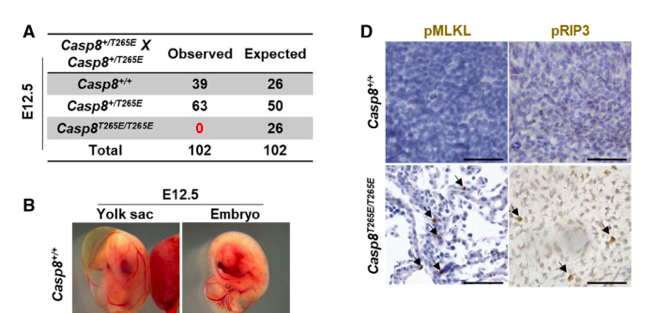
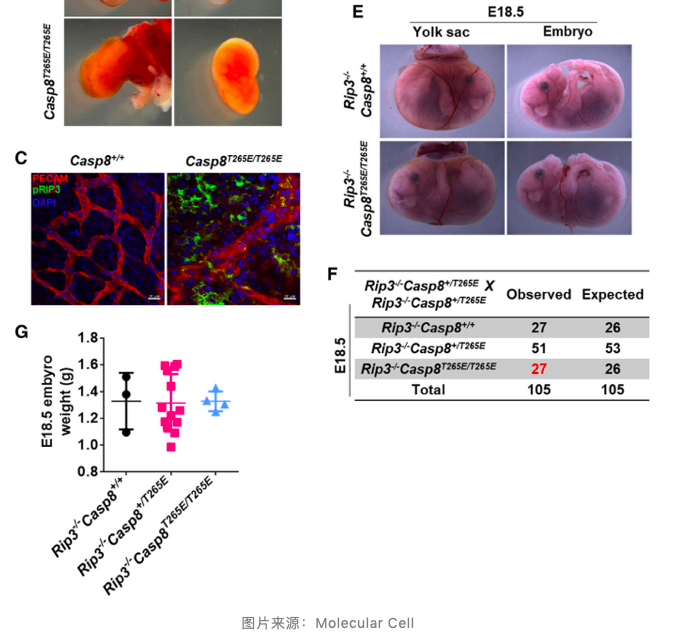
3. 抑制 caspase-8 磷酸化能够降低坏死性凋亡和相关病理的发生
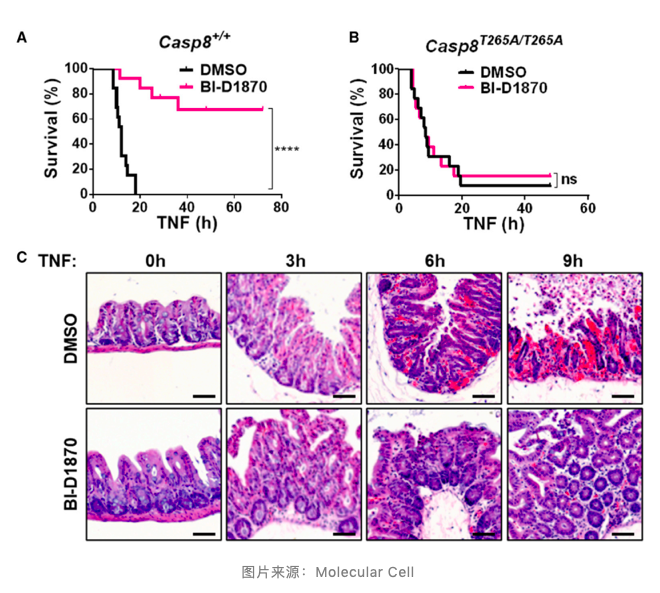
为了进一步确定这个结果,作者又构建了 Casp8T265A/T265A 非磷酸化突变小鼠。结果显示 Casp8T265A/T265A 小鼠胚胎正常发育,并且静脉注射 TNF 后,Casp8T265A/T265A 小鼠的生存率显著提高,胃肠道出血性病变也得到明显降低,这表明在体内抑制 caspase-8 磷酸化能够有效降低坏死性凋亡和相关病理的发生。
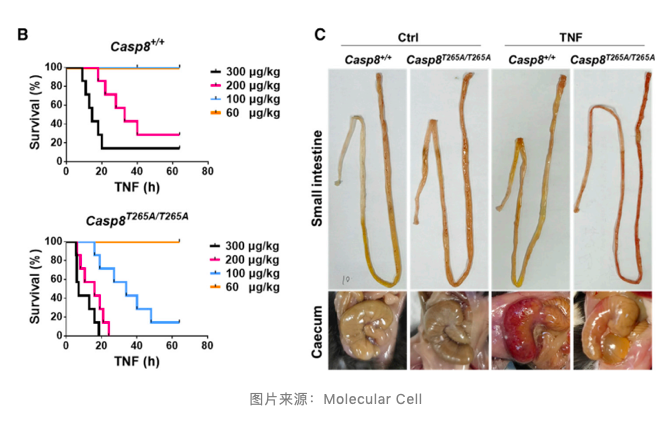
4. RSK1 激酶诱导 caspase-8 蛋白 Thr265 位点发生磷酸化
接下来作者探究介导 caspase-8 蛋白 Thr265 位点磷酸化的关键激酶。先前的研究表明人源 caspase-8 蛋白的 Thr263 位点(同源于鼠源 Thr265 位点)能够被 RSK2 磷酸化,因此作者猜想 RSK 激酶能磷酸化导 caspase-8 蛋白。
通过体外磷酸化实验呢,作者发现 RSK1 和 RSK2 均能够诱导 caspase-8 蛋白 Thr263 位点发生磷酸化。但是 L929 细胞中主要表达 RSK1 蛋白,因此在该细胞中只有敲低 RSK1 时,caspase-8 蛋白的磷酸化才显著降低。这表明在 L929 细胞中,RSK1 诱导 caspase-8 蛋白的 Thr265 位点发生磷酸化,从而促进坏死性凋亡的发生。

5. RSK1 的抑制剂能够缓解 TNF 诱导的小鼠盲肠损伤和死亡。
为了进一步确定该结果,作者给小鼠静脉注射 RSK1 的抑制剂 BI-D1870,随后使用 TNF 诱导坏死性凋亡。结果显示 BI-D1870 能够明显提高小鼠的生存率,显著降低小鼠盲肠损伤,并且当小鼠 Casp8T265A/T265A 突变后该现象便消失。这表明 caspase-8 蛋白的 Thr265 位点磷酸化由 RSK1 介导,进而降低 caspase-8 对坏死性凋亡的阻断作用。
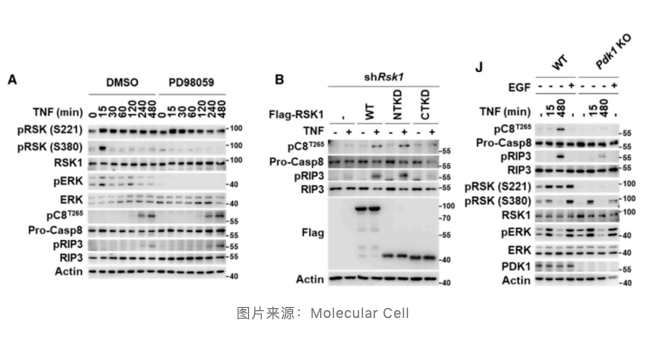
6. PDK1 诱导 RSK1 Ser221 位点磷酸化活化
RSK1 蛋白包含 C 端 (CTKD) 和 N 端 (NTKD) 两个激酶结构域,究竟哪个结构域介导 caspase-8 磷酸化呢?先前的研究指出 CTKD 能够被 ERK 磷酸化 Ser380 位点活化,NTKD 能够被 PDK1 磷酸化 Ser221 活化。通过抑制剂 PD98059 阻断 ERK 介导的 Ser380 磷酸化,作者发现 caspase-8 蛋白 Thr265 位点磷酸化无明显变化,这暗示 RSK1 诱导 caspase-8 蛋白 Thr265 位点磷酸化不依赖于 CTKD 结构域。
为了进一步确定这个结果,作者在 RSK1 缺陷的细胞中分别回补 CTKD 和 NTKD,发现只有回补 NTKD 时,caspase-8 蛋白才能被磷酸化失活。而敲低 PDK1 后 caspase-8 磷酸化和 RIP 磷酸化受到明显抑制,这表明 PDK1 能够诱导 RSK1 的 NTKD 磷酸化活化,进而促进 caspase-8 磷酸化失活,介导坏死性凋亡。
研究总结:
在这项研究中,作者发现 PDK1 能够诱导 RSK1 NTKD 结构域的 Ser221 位点磷酸化活化,随后 RSK1 被招募到坏死小体中,进一步磷酸化 caspase-8 的 Thr265 位点,导致 caspase-8 失活,从而促进坏死性凋亡的发生。
这项研究不仅揭示了 RSK1 降低 caspase-8 对坏死性凋亡阻断作用的内在机制,而且还为坏死性凋亡提供新的阻断靶点。
此外,本研究还揭示 RSK1 的抑制剂能够缓解 TNF 诱导的小鼠盲肠损伤和死亡,为相关疾病的治疗提供新的策略。