肿瘤、感染、神经炎症…为啥都开始关注细胞焦亡?
&丁香园
细胞焦亡,一种炎性细胞程序性死亡过程,最初是在细胞感染过程中得以发现,后来被发现作为炎症小体(包含 Caspase-1)及其他 Caspase 的下游,广泛参与多种疾病炎性过程中的细胞死亡过程。细胞焦亡和其他多种细胞程序性死亡相互补充、相互串连和转化,共同构成了细胞程序性死亡的复杂体系。
1 细胞焦亡的激活过程,从病原体感染说起
当细胞受到外界微生物(如细菌)感染时,模式识别受体(pattern-recognition receptors, PRRs)可识别病原体相关分子模式(pathogen-associated molecular pattern,PAMP)或机体细胞释放的危险相关分子模式(danger-associated molecular pattern,DAMP),从而快速启动天然免疫反应以抵御病原微生物入侵。模式识别受体一般表达于巨噬细胞、单核细胞、树突状细胞、中性粒细胞、上皮细胞以及适应性免疫系统中的一些细胞。
模式识别受体依据亚细胞定位可分为两大类:
(1)细胞膜上的 Toll 样受体(Toll-likereceptors,TLR)和 C 型凝集素受体(C-type lectin receptors);
(2)细胞质内的 RIG-Ⅰ样受体(RIG-Ⅰ-like receptors)、AIM2 样受体(AIM2 like receptors)及 NOD 样受体(NOD-like receptors)。
研究表明,位于细胞质内的一些 NOD 样受体/AIM2 样受体在细胞内能够直接或者通过接头蛋白 ASC(apoptosis-associated speck-like proteincontain a CARD)募集半胱氨酸天冬氨酸蛋白酶酶原(pro-Caspase-1),从而形成多蛋白复合体,即炎症小体(inflammasome)[1],在机体天然免疫应答中起重要作用。识别不同病原体的 PRRs 组装为不同的炎症小体,目前研究报道最多的是 NLRP3、NLRC4、NLRP1 和 AIM2 炎症小体,NLRP2、NLRP6、NLRP7、NLRP12 及 IFI16 等炎症小体也有报道[2,3]。
经典的炎症小体活化过程是「双重信号」模型。初级信号为启动信号,细胞膜上的 TLR 识别胞外的危险相关分子模式或病原体相关分子模式,例如 TLR4 识别细菌脂多糖(LPS),激活 NF-κB 信号通路,诱导多种 NOD 样受体(例如 NLRP3)蛋白以及 pro-IL-1β/pro-IL-18 的表达;次级信号为活化信号,细胞内的 NOD 样受体在迅速识别危险相关分子模式或病原体相关分子模式(例如线粒体 DNA)后,与接头蛋白 ASC 组装,从而招募 pro-Caspase-1[4]。当 pro-Caspase-1 的局部浓度升高时,发生自体剪切,生成的片段 p20 和 p10 组成四聚体结构的具有生物活性的 Caspase-1(即活化的 Caspase-1)[5]。炎症小体通过调控 Caspase-1 活化实现其功能:
(1)Caspase-1 剪切细胞因子 pro-IL-1β 和 pro-IL-18 使其成熟并释放到胞外介导炎症的级联反应,启动宿主免疫反应;
(2)Caspase-1 还可通过 GasderminD(GSDMD)介导细胞焦亡(pyroptosis)[6, 7],表现为细胞膜崩解,胞质内毒素分子释放,从而趋化炎症细胞并促进其释放细胞因子,这一过程是经典的细胞焦亡激活过程。
通过对细胞焦亡的研究的不断深入,一些新的分子机制被发现,比如一些新的 Caspase(如 Caspase-4、 Caspase-5、Caspase-11)可以被病原体结构分子(如 LPS)直接激活[8],并通过 GSDMD 介导细胞焦亡[9,10] ,这一过程被称为非经典的细胞焦亡激活过程(图 1)。
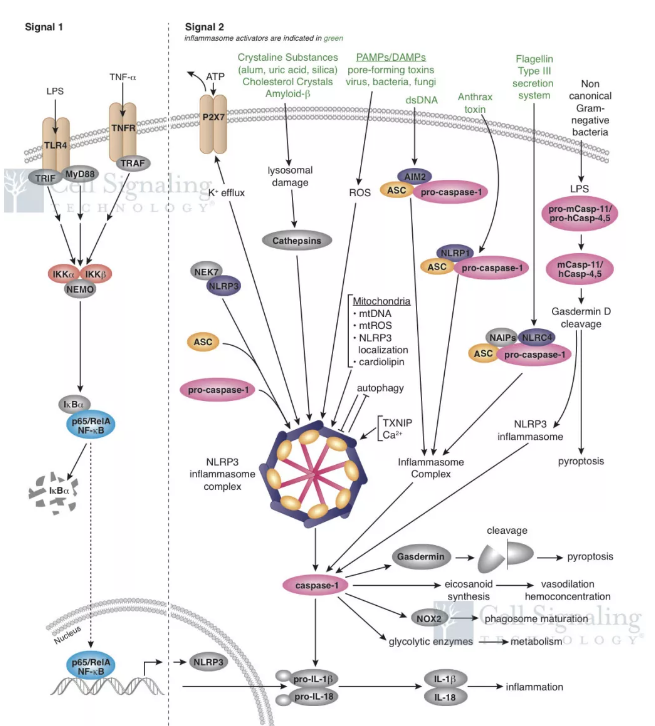
图 1:CST 炎症小体及细胞焦亡信号通路图
2 Gasdermin 是介导细胞焦亡的关键效应分子
实际上,早在 1992 年就有科学家观察到 Caspase-1 介导的程序性细胞死亡(也就是后来被称为细胞焦亡)[5],这是一种形态上区别于细胞凋亡的一种新的细胞程序性死亡形式。 直到 2015,Gasdermin D 作为 Caspase-1 和-11 的切割靶点被发现,这种细胞焦亡效应才为人所知 [6]。其中,中国的科学家邵峰院士在 Gasdermin 家族蛋白(包括 Gasdermin D)的研究中获得了令世人瞩目的发现,也因此获得了 CST 冠名的「中国细胞生物学会 2017 杰出成就奖」。Gasdermin D 的 N 端含有孔道形成结构域(pore-forming domain,PFD),当炎症小体信号通路被外界扰动(如细菌感染)激活时,在 Caspase-1 或 Caspase-11/4/5 的多个 caspase 切割下,从而将 Gasdermin D 裂解,将其 N 端形成孔结构域(PFD)与 C 端抑制区(RD)分离开来[6-8],大家可以利用 WB 检测到 Gasdermin D 全长片段和剪切后生成的 Gasdermin D-N 端片段(如图 2 所示)。同时,结构生物学研究显示 Gasdermin D 的 N 端发生多聚化并在细胞膜上形成孔道,同时释放成熟的 IL-1β,并驱动细胞肿胀直至膜破裂[11] 。另外,它通过与细菌膜上的心磷脂结合而具有潜在的抗菌作用。
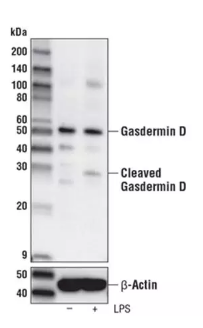
图 2: 用 80 nM TPA(12-O-四醇酚-13-乙酸酯,CST 产品#4174) 过夜处理诱导 THP-1 细胞分化后,再用 1 μg/ml 脂多糖(CST 产品#14011)处理 6 h,以未加 LPS 的 THP-1 细胞作为对照,分别提取细胞裂解物,用 Gasdermin D 抗体#96458 (上) 或β-actin(D6A8) 兔单抗#8457(下) 进行 WB 的结果。
然而,Gasdermin D 仅仅是 Gasdermin 家族的六位成员之一,其他的家族成员是不是也有类似效应,参与细胞焦亡呢?通过后来的研究发现,其他 Gasdermin 超家族蛋白具有同源的 PFDs,也被证明在发生切割后会激活 PFDs 形成细胞膜上孔道导致细胞焦亡[12]。其中之一,Gasdermin E(DFNA 5),可在不同情况下被 Caspase-3 切割激活,将凋亡转化为细胞焦亡或裂解性细胞死亡[13,14]。
细胞焦亡与其他细胞程序性死亡过程之间存在相互串话和转化
一些新的证据提示,细胞焦亡与其他细胞程序性死亡过程之间存在相互串话和转化。比如,细胞程序性坏死的关键调控蛋白 MLKL 可以激活 NLRP3 炎症小体[11]并促进 IL-1β 的加工,并介导 IL-1β 不依赖于 GADMD 的释放[12] ;在 Caspase-1 或 Gasdermin 家族成员被抑制的情况下,传统认为参与细胞凋亡的 Caspase-8 也可以介导 IL-1β的激活过程[15,16]。反之,在 Caspase-1 被抑制或缺失情况下,也发现炎症小体可以通过激活 Caspase-8 介导细胞凋亡的发生[17-20] 。
笔者相信,多种细胞程序性死亡的串话和相互转化将成为细胞死亡研究当中的一个热点问题[21],在不同的应激条件下,不同细胞程序性死亡形式将互为补充,共同维持生物体的内稳态。其中,Caspase 及 Caspase 介导的蛋白剪切和活化过程将成为多种细胞程序性死亡的串话和相互转化的直接证据被检测[22,23]。
想对多种细胞程序性死亡过程进行全面了解,扫描文章底部二维码获得《CST 细胞程序性死亡专题 PPT》。
3 展望:细胞焦亡的研究才刚刚开始
细胞焦亡,作为一种炎性程序性细胞死亡,已经在不同疾病模型当中开始受到关注,相信在近年来将成为基金申请的热点。目前,已经有很多报道初步显示了细胞焦亡参与肿瘤[24]、感染类疾病[25]、心血管疾病[26]、神经炎症[27]等很多疾病炎性过程,很多过去对炎症小体信号通路非常关注的研究人员,可能会自然延伸到对细胞焦亡机制的研究上来,掀起新一轮细胞死亡研究的热潮。






