简介
在肿瘤研究中,使用来自患者的原代肿瘤细胞,能够体现肿瘤细胞系所缺乏的体内肿瘤微环境和原发肿瘤异质性的影响。使用人肿瘤解离试剂盒可以温和、快速、有效地从原发性人肿瘤组织生成单细胞悬液,高得率地获得肿瘤细胞、基质细胞和肿瘤浸润淋巴细胞(TIL),同时保留细胞表面表位。解离的细胞随后使用人肿瘤细胞分离试剂盒富集 untouched 肿瘤细胞,制备的细胞可进行细胞培养或直接用于生化、生理、药理和形态研究。
原理
肿瘤组织可以通过机械解离与细胞外基质酶解相结合解离为单细胞悬液。细胞外基质维持了组织的结构完整性,肿瘤组织用试剂盒成分进行酶解,并配合 gentleMACS 全自动组织解离器机械解离以达到最佳效果。随后,细胞悬液中的非肿瘤细胞用偶联 MACS®磁珠的单克隆抗体鸡尾酒进行磁标记和分离,通过阴性分选去除标记的非肿瘤细胞,未标记部分即为 untouched 肿瘤细胞。
材料与仪器
1. 人肿瘤解离试剂盒;
2. 人肿瘤细胞分离试剂盒;
3. RPMI 1640 或 DMEM;
4. PBS 和 BSA,或 MACS BSA Stock Solution;
5. gentleMACS Octo 带加热模块组织解离器;
6. gentleMACS C 管;
7. 细胞滤筛 MACS SmartStrainer(30μm或70μm);
8. MACS 分选柱(如 LS 柱)和相应的 MACS 分选器(如 MidiMACS 或 QuadroMACS)。
步骤
1. 人肿瘤解离试剂盒酶复溶:
1)配制 Enzyme H 溶液:每瓶冻干粉用 3mL RPMI 1640 或 DMEM 复溶,分装,贮存于 –20°C。
2)配制 Enzyme R 溶液:每瓶冻干粉用 7mL RPMI 1640 或 DMEM 复溶,分装,贮存于 –20°C。
3)配制 Enzyme A 溶液:每瓶冻干粉用试剂盒中的 1mL Buffer A 复溶,切勿涡旋,分装,贮存于 –20°C。
2. 根据下表成分加入 gentleMACS C 管,准备酶混液:
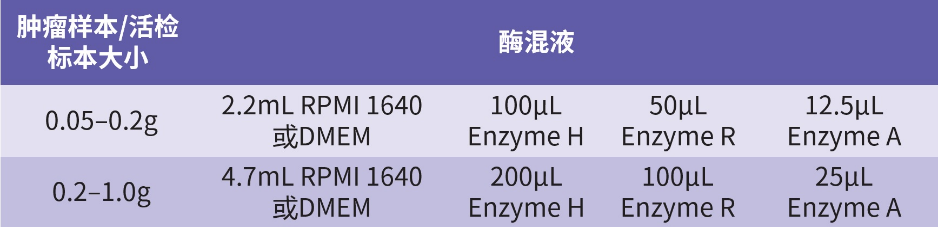
3. 肿瘤组织准备:尽量去除肿瘤样本中的脂肪、纤维和坏死区域,将组织剪成 2-4mm 的小块,转移至装有酶混液的 gentleMACS C 管中,拧紧 C 管,安装到 gentleMACS 组织解离器上。
4. 肿瘤组织解离:根据肿瘤组织的质地类型,运行合适的 gentleMACS 程序:
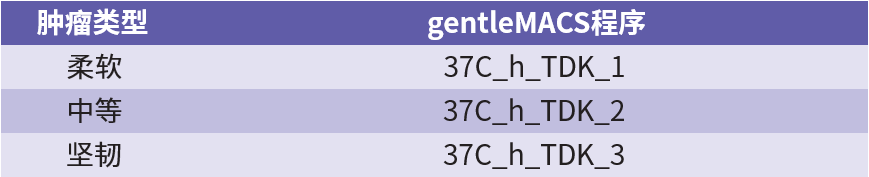
人肿瘤质地参考:

5. 细胞悬液过滤重悬:程序结束后,从组织解离器上取下 C 管,短暂离心,沉淀重悬后用 MACS SmartStrainer 滤筛(30μm 或 70μm)过滤。用 20mL RPMI 1640 或 DMEM 清洗滤筛,细胞悬液 300xg 离心 7 分钟,彻底弃上清,重悬。
6.(可选)细胞悬液质量优化:如果样本在解离后出现「粘性」(释放 DNA),DNase 处理;如果要去除红细胞或死细胞,按说明书使用红细胞裂解液或去死细胞试剂盒;如有大量细胞碎片,按说明书使用碎片去除溶液。
7. 分选缓冲液配制:配置含有 0.5% BSA 的 PBS(p2),可使用 PBS 按 1:20 稀释 MACS BSA Stock Solution,使用前脱气。
8. 计数细胞,细胞悬液 300xg 离心 10 分钟,彻底弃上清,按最多 2x10^6 肿瘤细胞或 10^7 总细胞重悬于 60μL 分选缓冲液。
9. 磁珠标记:对最多 2x10^6 肿瘤细胞或 10^7 总细胞加入人肿瘤细胞分离试剂盒中的 20µL Non-Tumor Cell Depletion Cocktail A 和 20µL Non-Tumor Cell Depletion Cocktail B,充分混匀,2-8°C 孵育 15 分钟,加分选缓冲液调整体积至 500µL。
10. 磁分选:LS 柱置于相应的 MACS 分选器磁场中,3mL 分选缓冲液润洗分选柱,加细胞悬液至分选柱,收集含有未标记细胞的流传液,即富集的人肿瘤细胞。用 2x1mL 分选缓冲液洗涤分选柱,收集流穿液合并。
11.(可选)将分选柱从分选器移出,加 3mL 分选缓冲液洗脱标记的非肿瘤细胞。
注意事项
1. 对于 TIL 分析,肿瘤组织解离时建议将酶混液中 Enzyme R 的用量减少至 20%,有助于保留细胞表面表位,但可能降低内皮细胞、上皮细胞和肿瘤相关成纤维细胞的产量和活率。
2. 始终使用新鲜配置的分选缓冲液。
3. 对肉瘤、间质卵巢瘤或间质胶质母细胞瘤分选肿瘤细胞时,只加入 Non-Tumor Cell Depletion Cocktail A,不使用 Non-Tumor Cell Depletion Cocktail B。
4. 磁珠标记推荐的孵育温度是 2–8°C,更高的温度和/或更长的孵育时间可能导致非特异的细胞标记。
来源:丁香实验