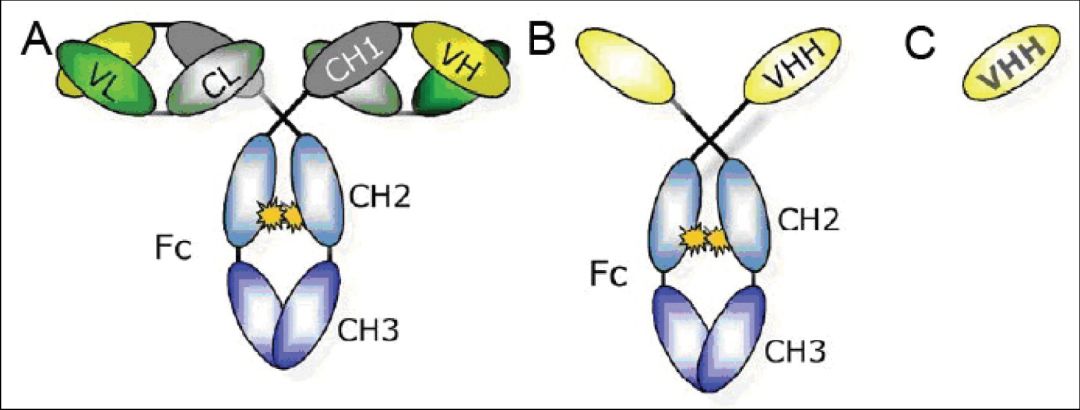
简介
SARS-CoV-2 刺突蛋白的受体结合域(RBD)可与上皮细胞表面的血管紧张素转换酶-2(ACE-2)结合并发生融合,从而使病毒进入细胞内。源自大羊驼(llama)的纳米抗体(VHH)可以与 RBD 结合,阻断这种相互作用,从而中和病毒。通过 X 射线晶体学方法对 VHH-RBD 复合物进行结构分析,可以精确地绘制 VHH 的抗体识别表位,并对变异突变所产生的影响进行解析和预测。因此,在这篇文章中,我们描述了一种生产 VHH-RBD 复合物的优化工作流程,以及可用于 X 射线晶体学分析的结晶方法。
材料与仪器
步骤
A、受体结合域的生成
1、载体的构建
a、对于 10 μL 的 In-fusion 反应,将 20 ng (1-3 μL) 的合成基因、100 ng (1-2 μL) 用 PmeI/NcoI 切割好的 pOPINTTG 载体、1 μL Exnase II,以及 2 μL 克隆试剂盒中的优化缓冲液混合在一起。
b、将反应在 37℃ 下孵育 30 分钟,然后通过加入 20 μL 冰冷的 TE 缓冲液立即终止反应。
c、用 5 μL 所得反应混合物转化 20 μL Stellar 感受态细胞,方法为先在冰上孵育 30 分钟,然后在 42℃ 下热休克处理 45 秒。
d、加入 400 μL 的 SOC 培养基,在 37℃ 下孵育 45 分钟。
e、将 100 μL 的细胞和培养基混合物铺板在补充有 100 μg/mL 氨苄青霉素的 LB-琼脂培养板上,并在 37℃ 下培养过夜。
f、将单个菌落挑到 3 mL 含 100 μg/mL 氨苄青霉素的 LB 培养基中,在 37℃ 下孵育过夜。
g、制备甘油细胞原液:在 2 mL 冻存管中加入 0.5 mL 在 LB 培养基中过夜培养的细胞,然后加入 0.5 mL 50%(v/v)无菌甘油,并在 -80℃ 下冷冻。
h、用细胞沉粒制备 DNA,并用 pTTfwd 和 PTTrev 引物对 minipreps DNA (小提 DNA)进行测序,确认克隆是正确的。
i、使用 50% 甘油细胞原液来培养更多细胞,用以制备转染级质粒。
j、使用 QIAGEN Plasmid Plus Midi 试剂盒,从 150 mL 在 LB 培养基中培养过夜的培养物中提纯转染级质粒 (0.5-1 mg)。如果需要,可将质粒置于无菌 1.5 mL Eppendorf 管中,储存在 -20℃ 下。
k、用 NanoDrop 分光光度计测量 DNA 的纯度和浓度。用于转染的质粒 DNA 需要有很高的纯度 (见注 1)。
l、DNA 的浓度和纯度由仪器按以下公式自动计算:
浓度:DNA (µg/mL)=(A260 读数-A320 读数)×稀释系数×50 µg/mL 纯度:(A260/A280) = (A260 读数-A320 读数) ÷(A280 读数-A320 读数)
m、每 100 万转染细胞使用 1 μg DNA。
2、转染实验方法
a、培养得到的 Expi293TM 细胞悬液在解冻后至少维持 3 次传代(传代数 3-30 的细胞可用于实验)。传代培养用 Gibco Expi293TM Express 培养基在加湿 (80%) 的培养箱(CO2 浓度 5%~8%,轨道摇速 120 rpm,37℃)中进行,培养至细胞密度为 0.5~5.0 ×106个细胞/mL。将 30 mL的 Expi293 细胞保存在 125 mL 的培养瓶中。
b、在转染前一天,以 1×106个细胞/mL 的细胞密度播种 Expi293TM 细胞。每次制备 RBD 时设置三个 500 mL 的培养瓶,每瓶装入 170 mL 的培养物。
c、在转染的当天测定细胞数和细胞活率,如果细胞数在 2×106~2.5×106/mL 之间,并且至少有 95% 的存活率,则继续进行转染(见注 2)。
d、对于每份 170 mL 的培养物:将 17 mL OPTI-MEM 培养基与 170 μg 质粒 DNA 和 918 μL PEI Max 40kDa 转染试剂混合在一个 50 mL 的 Falcon 管中。
e、充分混合后在室温下孵育 10 分钟,然后轻轻地(滴加)加入到 Expi293TM 细胞中(见注 3)。
f、加入 1 mg/mL 原液浓度的 kifunensine(每 100 mL 培养加入 100 μL),并将细胞放回轨道摇床培养箱中,在 125 rpm 摇速、5%~8% CO2、80% 湿度和 37℃ 条件下培养。
g、培养 16-18 小时后,在每份 170 mL 的培养物中加入 2890 μL 丙戊酸、1100 μL 丙酸钠,和 3400 μL 葡萄糖。将培养物放回培养箱(见注 4)。
h、在转染后的第 5 天确定细胞数和存活率。
i、收获培养基,并在 0.5 L 的离心瓶中以 6000×g 转速离心20 分钟。然后用 0.45 μm 的 0.5 L 瓶盖过滤器过滤除菌。
3、纯化
IMAC-SEC 纯化实验是按照 Nettleship 等人 (2009) 描述的程序设置在 ÄKTA Xpress 平台上进行 的。用其他具有自动峰值检测功能的纯化系统纯化时也可以使用同样的工作流程。Unicorn 程序的文字记录见附录。
a、用「凝胶过滤平衡」程序和凝胶过滤缓冲液 (20 mM Tris, pH = 7.5, 200 mM NaCl) 平衡凝胶过滤柱。
b、按照“哺乳动物预处理系统”的方法来设置系统。它将泵送清洗 A1 和 A2,并清洗进样 口。然后它会要求您将 5 mL 的层析柱拧到位置 1,并将平衡层析柱。
c、在过滤后的细胞上清液中加入等体积的 PBS,用 NaOH 调节 pH 值至 7.4。
d、层析柱安装好且样本准备完毕后,慢慢地将 A2 管线从缓冲液中取出(动作需缓慢轻柔以避免管线中出现气泡),并将其插入样本中。确保所有的管线都插到瓶子的底部。
e、按照设定实验程序运行过夜。
f、使用来自 ÄKTA 的痕迹(trace),选择含目标蛋白质的正确馏分。将 10 μL 蛋白质溶液与 10 μL 样品缓冲液混合,在 95℃ 下加热 5 分钟。用 SDS-PAGE 凝胶电泳检测样本,并用 Instant Blue® 进行染色。
g、浓缩蛋白质:通常用 10 kDa 浓缩离心机 在 4℃ 以 2500×g 转速离心浓缩至 5 mg/mL。
h、分装蛋白质(例如,分装成 0.1 mL),将装有蛋白质的分装管插入液氮中速冻,
i、然后储存在 -80℃ 下。
B、VHH 的生成
1、载体的构建
通过筛选 M13 噬菌体呈显库 (display libraries) 确定 VHH,并重新表达所识别的 VHH 用于生产蛋白质。
a、用 VHH 正向引物和 VHH 反向引物,在以下 PCR 条件下用源呈显载体扩增 VHH:
1) 98℃,10 秒
2) 30 个循环,每个循环:98℃ 1 秒 ,60℃ 5 秒 ,72℃ 15 秒
3) 72℃ ,2 分钟。
4) 维持温度 4℃。
b、通过琼脂糖凝胶电泳纯化扩增的 VHH DNA,并根据制造商的说明使用 Nucleospin® 试剂盒提取 DNA。按照 RBD 克隆中所述,将 PCR 产物克隆到 SfiI 切割的 pADL-23c 载体中。
c、用 PhDseq 正向引物和 PhDseq 反向引物测序,验证克隆是否正确。
2、在大肠杆菌中的表达
a、按照前述方法转化化学感受态 WK6 细胞用于构建 RBD 表达载体。
b、从转化后的细胞培养板上挑出一个菌落,并建立预培养体系:8 mL 补充有 100 μg/mL 氨苄青霉素、2% 葡萄糖和 1 mM MgCl2 的 TB 培养基。
c、建立培养体系:在一个 2 L 的培养瓶中加入 800 mL 补充有 100μg/mL 氨苄青霉素、0.1% 葡萄糖和 1mM MgCl2 的 TB 培养基。
d、将培养瓶/培养基预热至 37℃。
e、加入预培养物,在 37℃ 下以 225 rpm 摇速在轨道摇床培养箱中培养。
f、当 OD600 达到~1.2 时(通常需要 3.5 小时左右),加入 IPTG 至终浓度为 1 mM,并继续在 28℃ 下以 225 rpm 摇速培养过夜。
g、在 4℃ 下以 2500×g 转速将细胞离心沉淀 15 分钟。
3、VHH 的纯化
a、在细胞颗粒中加入 15 mL TES 缓冲液,在 4℃ 下用磁力搅拌子在瓶中缓慢搅拌重悬过夜。
b、第二天,向重悬的培养物中加入两倍体积的补充有 120 U Kunitz DNaseI 的冰冷 TES/4 缓冲液,并缓慢搅拌 2 小时。
c、加入 TES/4 缓冲液扩容到 80 mL。
d、(在一个 50 mL 的离心管中)在 4℃ 下以 28000×g 转速离心 30 分钟产生沉淀。
e、用 0.8μm 过滤器真空过滤上清液。
f、用 5 倍体积的 PBS(pH = 7.4)稀释上清液,并充分混合。
g、将样本加载到两个串联的 5 mL IMAC 层析柱上,上样流速 <2 mL/分钟。
h、用含有 30 mM 咪唑的 PBS(pH = 7.4)洗柱。
i、用含有 300 mM 咪唑的 PBS 以 1 mL/分钟的流速,按照 1 mL 的馏分体积,将样本洗脱到 96 孔收集板中。
j、将 A280 峰处的馏分汇集起来(大约 7.5 mL),在 Superdex S75/600 层析柱上用凝胶过滤缓冲液(50 mM Tris pH = 7, 150 mM NaCl)过柱。
k、汇集 A280 峰处的蛋白馏分,用截留分子量为 5 kDa 的浓缩器浓缩,通常浓缩到 15 mg/mL (见注5)。
l、分装蛋白质(例如,分装成 0.1 mL),将装有蛋白质的分装管插入液氮中速冻,
m、然后储存在 -80℃ 下。
C、VHH-RBD 复合物的结晶
1、VHH:RBD 复合物的制备
a、将 5 mg RBD (5 mg/mL) 与 3 mg VHH (15 mg/mL) 混合,此时二者摩尔比为 RBD:VHH = 1:1.2 ,并在冷室中以 2 rpm 的速度搅拌孵育 3 小时(见注6)。
b、将 RBD-VHH 复合物与 0.4 mg EndoH 糖苷酶 (1 mg/mL) 一起在室温下以 2 rpm 速度搅拌孵育过夜(见注7)。
c、用截留分子量为 5 kDa 的浓缩器将混合物浓缩至 1 mL,并加载到 Superdex 200 10/300 层析柱上,在凝胶过滤缓冲液 (50 mM Tris pH = 7, 150 mM NaCl ) 中过柱。
d、监测 A280,汇集峰值馏分,并用截留分子量为 5 kDa 的浓缩器浓缩至 20 mg/mL(见图 1 和 图 2)。
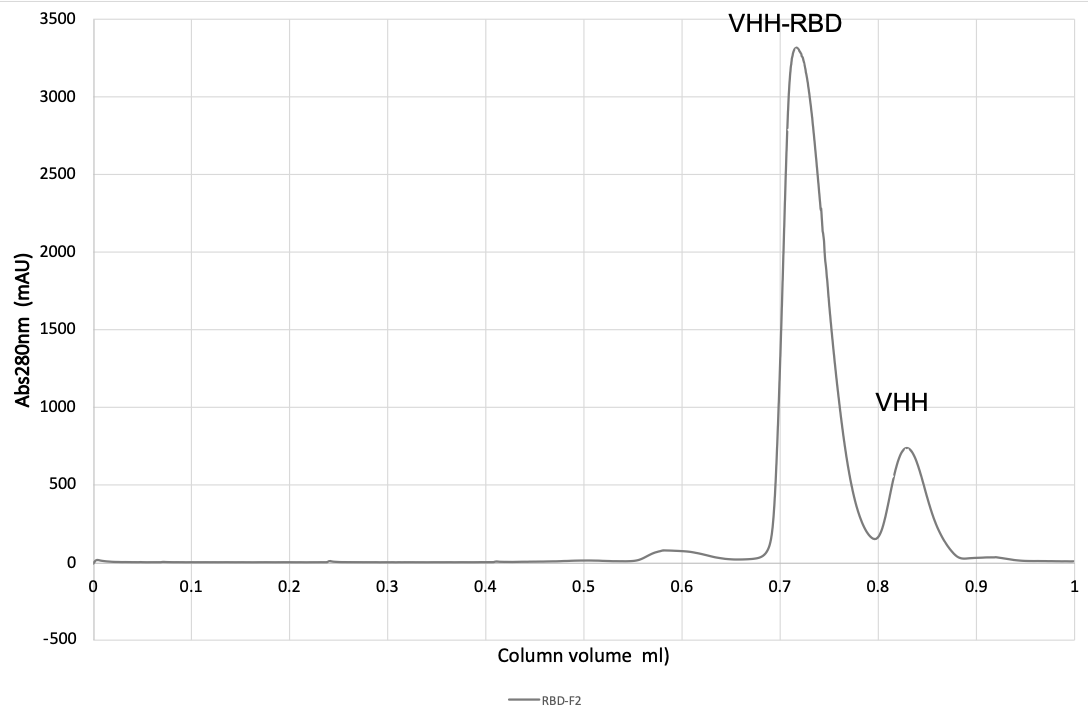
图 1. 用 SD200 20/300 尺寸排阻层析柱 (CV = 23.56 mL) 纯化 VHH-RBD 复合物。
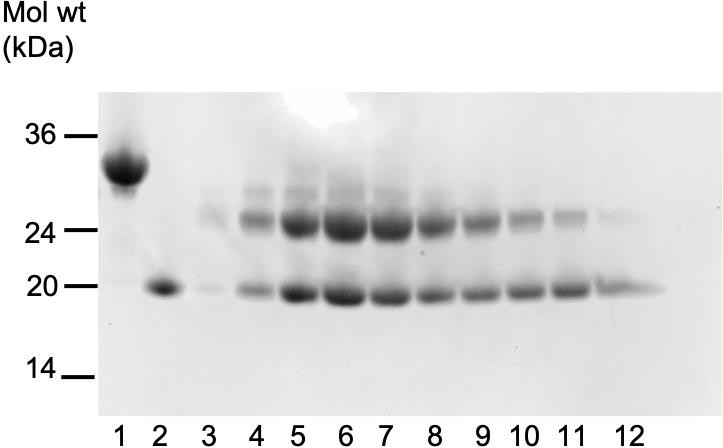
图 2. RBD(泳道1)、VHH(泳道2)和用内切酶 HH 处理过的 RBD-VHH 复合物凝胶过滤后馏分(泳道 3-12)的 SDS-PAGE 电泳结果。
1、结晶筛选
a. 用 Hydra 移液工作站从 96 孔 Masterblock 孔板移取 25 μL 结晶溶液到 Swisssci 结晶板的池液孔中。
b. 用移液器将蛋白质溶液转移到 V 型底微孔板的柱中。
c. 用机器人液体处理系统(Mosquito),以三种蛋白质液:池液(reservoir)的比例(100 nL 蛋白质液+100 nL 池液;200 nL 蛋白质液+100 nL 池液;100 nL 蛋白质液+200 nL 池液)建立一个含 288 个液滴地坐滴板(见注8)。
d. 用 VIEWseal 密封完成地坐滴板。
e. 按 Formulatrix 成像仪中的 Fibonacci 时间设置,在 20℃ 下的对坐滴板进行成像并储存(结晶示例见图 4)。
f. 在选定的晶体滴上的封盖切出一个方形孔开放液滴。
g. 在晶体/液滴上滴加 1 μL 的冷冻保护剂混合物(30% 甘油,或原始结晶条件下滴加 Peg
400)。表 1 列出了结晶 VHH-RBD 复合物的一些例子。
h. 将安装针装在磁棒上,用晶体捞针环将晶体从液滴中取出,并迅速放入装有液氮的泡沫杜瓦瓶中。
i. 将装好的晶体块储存在泡沫杜瓦瓶内。
j. 将晶体块转移到经液氮预冷的液氮罐中。
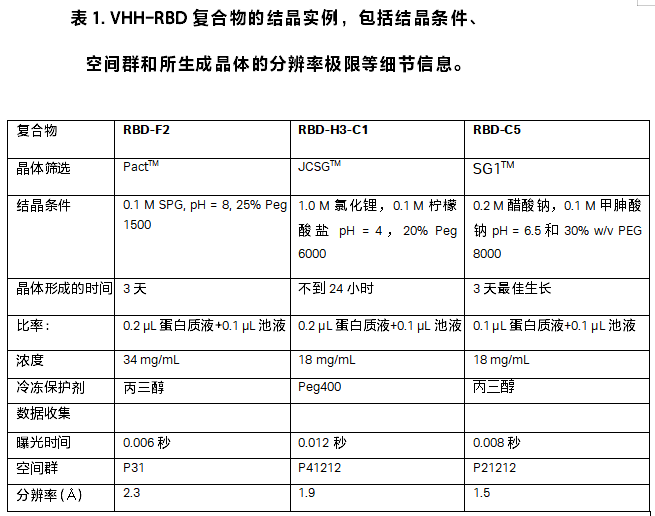

图 3. 不同复合物的晶体形状:RBD-F2(左),RBD-H3-C1(中)和RBD-C5(右)。
引用:Le Bas, A.等人(2022) SARS-CoV-2 刺突蛋白受体结合域与纳米抗体形成复合物的生成和结晶
Bio-protocol 12(09): e4406.DOI: 10.21769/BioProtoc.4406.
注意事项
1. 具有最少蛋白质和化学污染的优质 DNA 的 260/280 吸光度比率应该在 1.8-2.0 之间,而 260/230 的比率应该在 2.0-2.2 之间。
2. 我们的方案适用于任何规模的表达:1-3 mL 培养板规模的实验,和用 30-300 mL 培养瓶的大量表达实验。等比放大相应试剂的体积和数量使之与转染细胞的体积相适应。
3. 不要直接混合 DNA 和 PEI,因为它们会立即形成沉淀。
4. 结合使用丙戊酸、丙酸钠(组蛋白去乙酰化酶抑制剂)和补充葡萄糖有助于大幅提高基因表达。
5. 重要的一点是,要定时检查浓缩步骤中是否有 VHH 沉淀形成,如果观察到这种情况,应停止继续浓缩蛋白质。任何沉淀物都可以通过在微型离心机中以 12000×g 转速离心 10 分钟来去除,然后在 280 nm 处通过吸光度测量最终的蛋白质浓度。
6. 多加入一摩尔的 VHH,以确保 RBD 与纳米抗体完全复合。
7. EndoH 在 pH~5.2 时作用效率最高。然而,由于大多数蛋白质在这个 pH 值下不稳定,因此应在 pH = 7.5 下进行反应。另外,许多蛋白质在 37℃ 下无法长期保持稳定,所以反应最好在室温下进行。EndoH 在室温和 pH = 7.5 时都有活性,但反应时间比在最佳条件下进行的要长。
8. 两种稀疏基质的筛选(JCSG+和 SG1)在两种不同的浓度(通常为 34 mg/mL 和 18 mg/mL)下以三种不同的比例进行常规筛选。对于复合物 RBD-F2 和 RBD-H3-C1,我们获得了数个结晶命中 (hits),而对于 RBD-C5 我们仅获得了一个命中。仅偶尔使用了 PACT 筛选。晶体直接从稀疏矩阵筛选中收获,不需要进一步优化。为了获得更多衍射质量区别非常细微的晶体,通常在 Mosquito 工作站中的同一行上设置相同的条件,并使用相同的实验方案。通过这种做法也可以测试两种不同的冷冻条件(通常为甘油和 Peg 400)。晶体的可重复性很高。通常情况下,在生长 24 小时内从所有的命中(hits)收获了最纯净的晶体,但对大多数命中来说,此后 5 天内晶体的衍射质量仍然是稳定的
内容来源:Cytiva
来源:丁香实验