简介
游离核酸(包括 cfDNA 和 cfRNA) 是指在生物体液中发现的游离于细胞外的核酸,游离核酸的来源分为内源性和外源性,可以是细胞凋亡释放到体液中的内源性核酸,也可以是人体感染病原微生物后由微生物产生的外源性核酸。游离核酸可以用于癌症的早期诊断、预后评估,也可以用于病原感染的诊断,根据实验目的不同,采集体液样本类型不同,核酸纯化方案也有一定区别。

原理
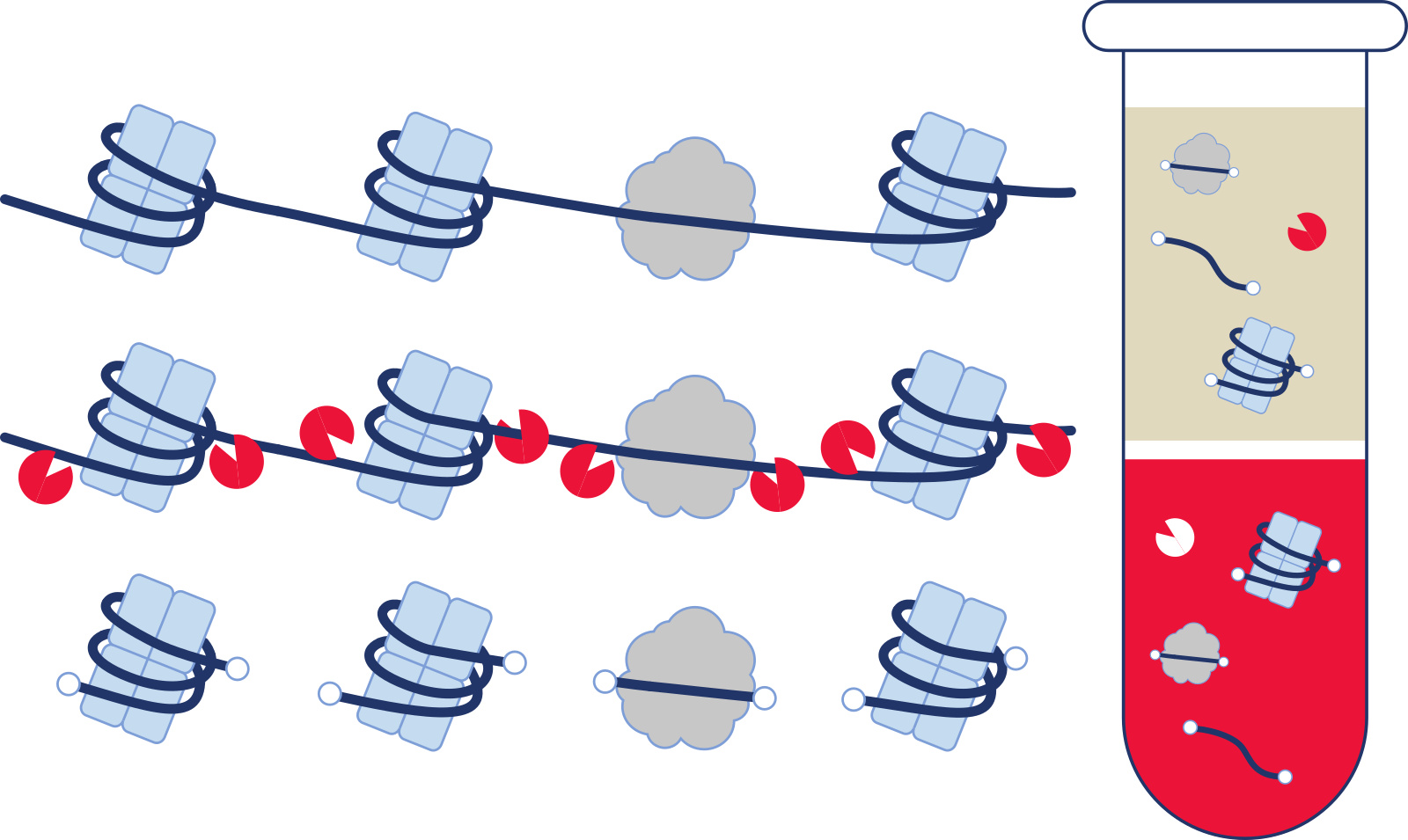
体液样本先经过高速离心去除细胞及细胞碎片等大分子物质,进行蛋白消化后,将核酸溶液转移到硅胶膜柱上使核酸结合在柱膜上,经洗涤去除杂质后洗脱得到纯净的核酸。
由于游离核酸浓度较低,可以在缓冲液中加入 carrier RNA 去除静电效应,保证核酸更好地吸附到纯化柱上,提高洗脱效率。
材料与仪器
QIAamp Viral RNA Mini Kit (QIAGEN,用于病原微生物核酸提取,下文操作步骤基于此试剂盒)
QIAamp Circulating Nucleic Acid (QIAGEN,用于体液游离核酸提取)
离心机
加热模块或水浴锅
1.5 ml 或 2 ml 离心管、无菌吸头
一次性手套
乙醇(96%–100%)
步骤
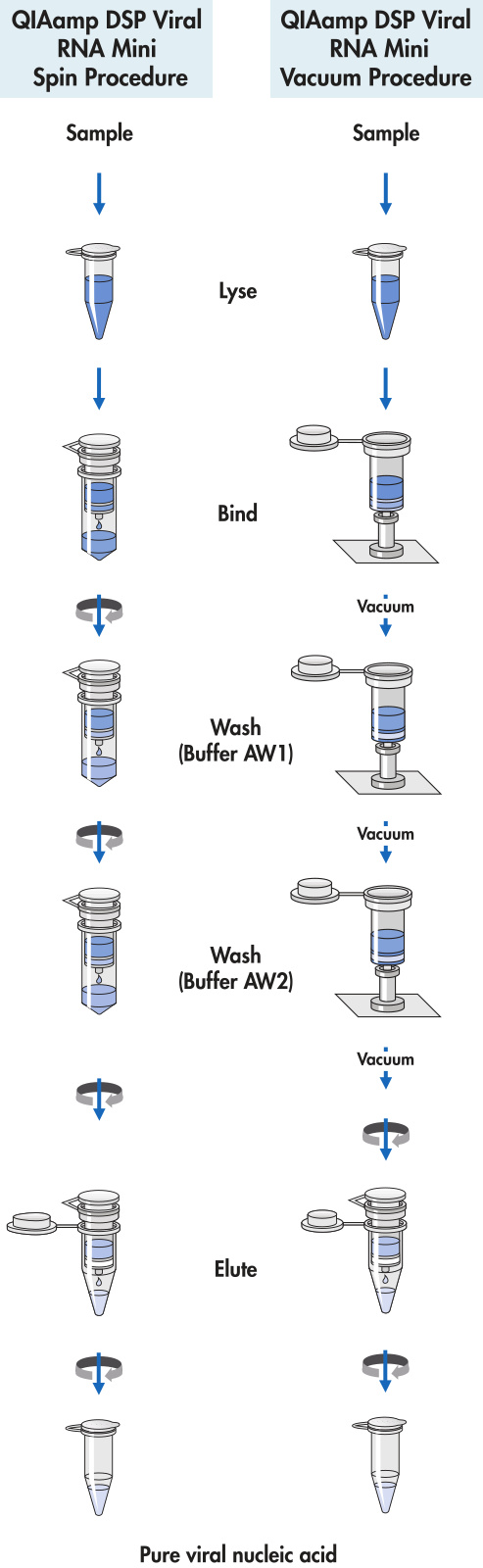
1. 吸取 560 μl 准备好的 Buffer AVL–carrier RNA 至 1.5 ml 的离心管。
2. 加 140 μl 血浆、血清、尿液、细胞培养上清液,或其他无细胞体液至第 1 步准备好的管中。涡旋振荡 15 s。为了保证裂解效率,请确保样本与 Buffer AVL 彻底混匀为匀浆。只冻融过 1 次的冰冻样本也可被处理。如样本是拭子,请按照以下步骤处理:拭子置于离心管中,加入 400 μl Buffer ATL 浸润样本;56°C 振荡孵育 15 min;吸取 140 μl 样本加入第 1 步准备好的离心管
3. 室温下(15°C–25°C)孵育 10 min。病毒颗粒在室温下 10 min 后充分裂解。长时间的孵育无助于 RNA 的产量和质量。
4. 快速离心以去除附着于内壁与内盖的水滴。
5. 加 560 μl 乙醇(96%–100%)至样本中,短暂离心 15 s 混匀。混匀后,快速离心去除附着于内壁与内盖的水滴。
6. 小心吸取 630μl 第 5 步获的溶液至 QIAamp Mini column 上(柱子放置于 1 个 2 毫升的收集管内)。盖上盖子,6000 x g (8000 rpm)下离心 1 min。将 QIAamp Mini column 移至 1 个新的 2 ml 收集管,丢弃带有流出液的旧管。离心建议程序:6000 x g (8000 rpm)下离心 1 min。
7. 小心打开盖子,重复第 6 步操作。
8. 小心打开盖子,加入 500 μl Buffer AW1。盖上盖子,6000 x g (8000 rpm)下离心 1 min。将 QIAamp Mini column 移至 1 个新的 2 ml 收集管,丢弃带有流出液的旧管。
9. 小心打开盖子,加入 500 μl Buffer AW2。盖上盖子全速离心(20,000 x g; 14,000 rpm) 3 min。直接进行第 11 步,或为了排除 Buffer AW2 的残留机会,先进行第 10 步操作,再做第 11 步。
10. 将柱子放在一个新的 2 ml 收集管,丢到含有流出液的旧管。全速离心 1 min。
11. 将柱子放在 1 个干净的 1.5 ml 的离心管,丢掉含有流出液的旧管。小心打开盖子,加 60 μl 平衡好的 Buffer AVE 至膜上。盖上盖子,室温下孵育 1 min。6000x g (8000 rpm)离心 1 min。RNA 在–20°C 或–70°C 下可以稳定保存至多 1 年。
注意事项
1. 游离核酸提取过程中,样本收集和离心后,血浆(未经处理,或用肝素之外的抗凝剂处理)或血清可在 2°C–8°C 下储存至多 6 h。如需长期保存,建议分装后在–20°C 或 –80°C 保存。冷冻血浆或血清样本不可反复冻融。反复冻融将会促使蛋白变性沉淀,降低核酸回收率。
2. 如果体液样本需要长时间保持运输,需要使用专门的游离核酸采血管,常规的肝素、ETDA、枸橼酸钠采血管无法有效防止溶血,gDNA 会污染游离核酸。
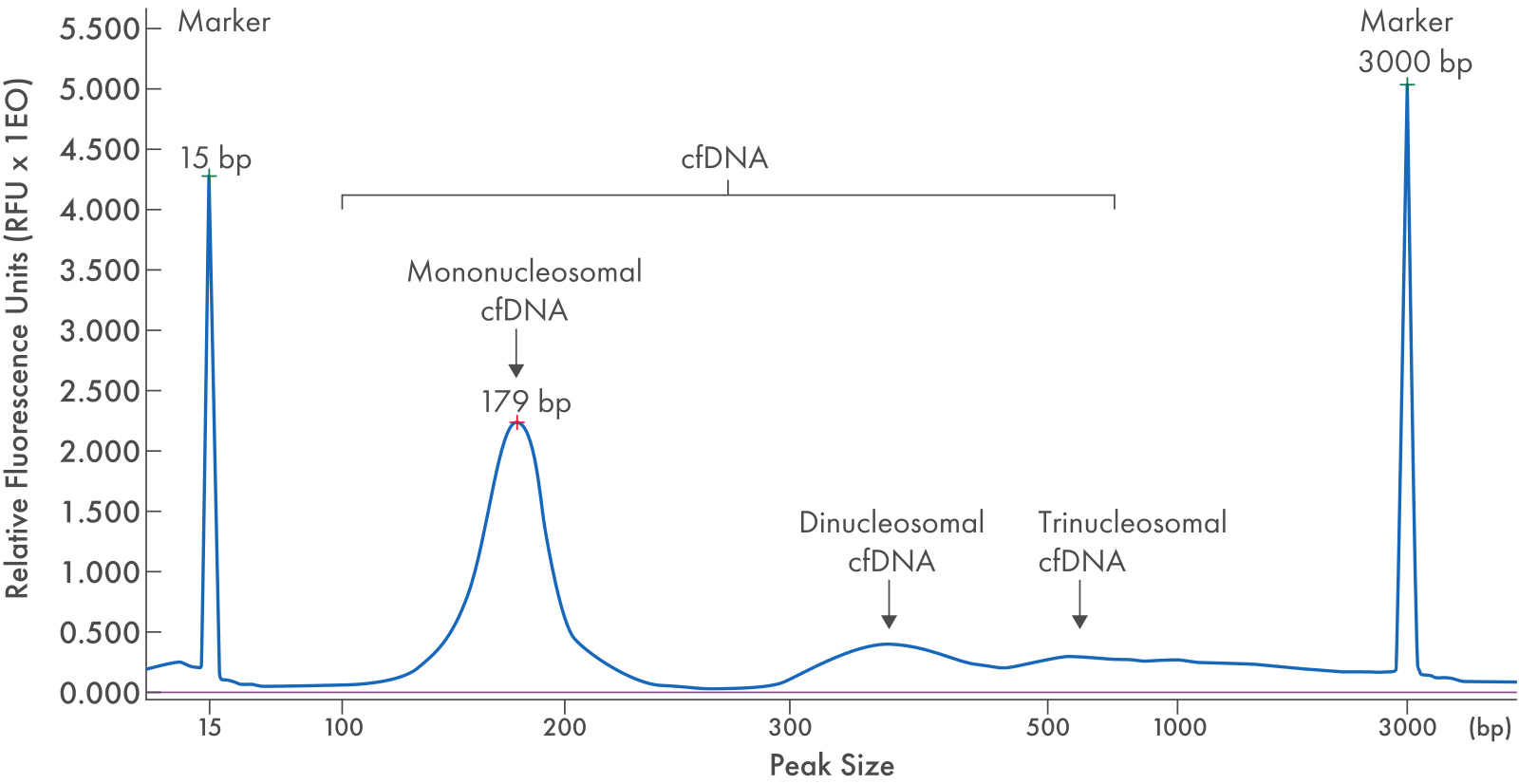
3. cfDNA 的浓度常常很低,Qubit 定量可能无法检测到信号,且核酸处于片段化状态,您需要高灵敏度且可靠的工具才能确保检测到信号的准确性。
4. 单次 60 μl Buffer AVE 处理 QIAamp Mini column 可以达到至少 90% 的病毒 RNA 洗提效率。2 次 40 μl Buffer AVE 洗提可以提高 10% 的产量。洗提体积小于 30 μl 会减少产量,也不会增加最终洗提液中 RNA 的浓度。
内容来源:QIAGEN 凯杰
来源:丁香实验
