简介
低至单个细胞的 DNA&mRNA 共提取方案,起始样本支持显微切割细胞、流式分选细胞、循环肿瘤细胞(CTCs)、胎儿细胞、干细胞、T 细胞等。
原理
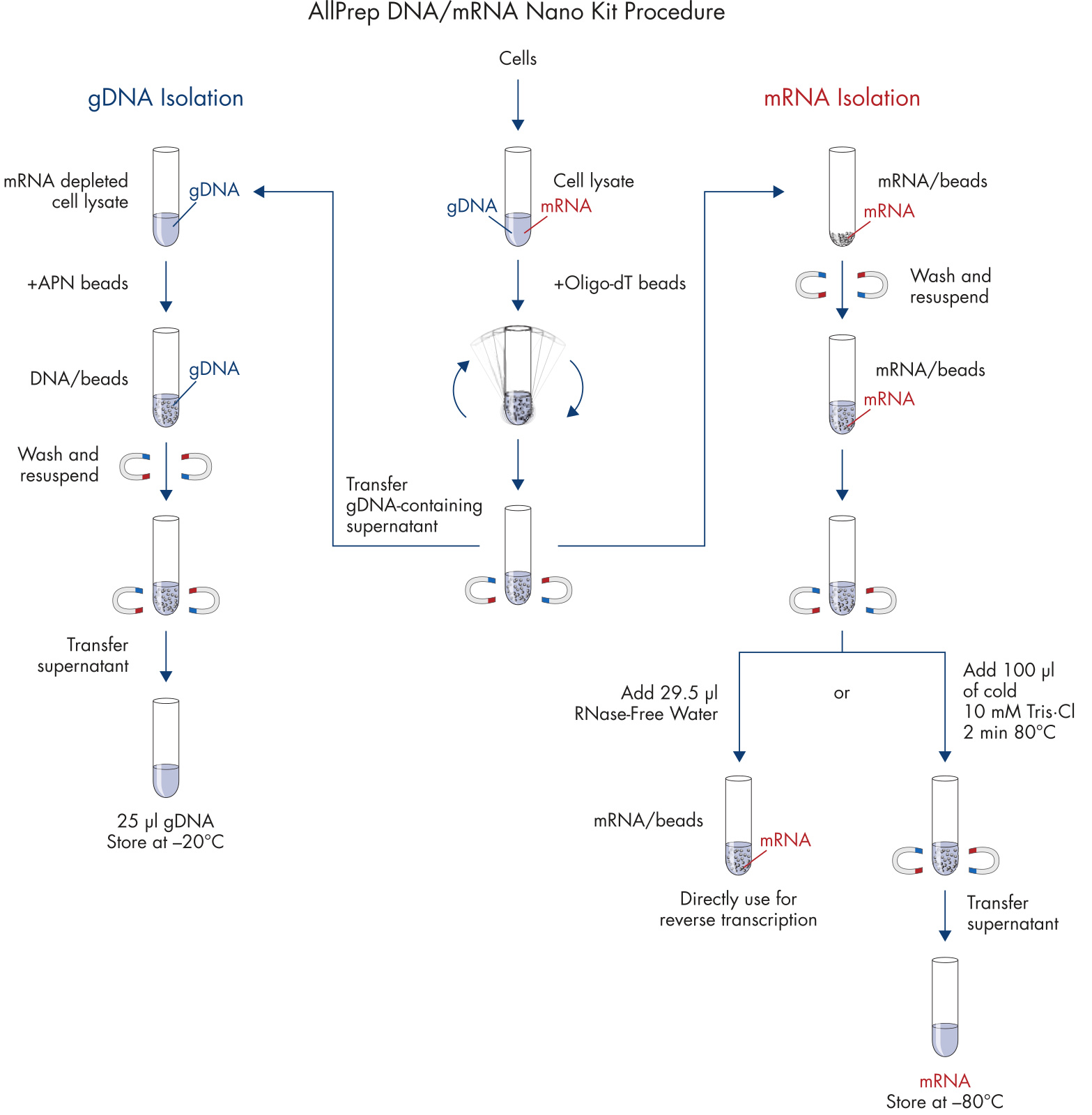
细胞裂解后释放出基因组 DNA 和 mRNA,利用 Oligo-dT 磁珠将 mRNA 与裂解后液体中的基因组 DNA 分离开来,分别进行基因组 DNA 与 mRNA 的纯化。对富集有 mRNA 的磁珠进行杂质洗涤后即可洗脱得到 mRNA。与此同时,可利用另一款 APN 磁珠对基因组 DNA 进行富集,同样洗涤掉杂质后可洗脱获得基因组 DNA。两步磁珠法技术可帮助最大限度捕获更长片段的基因组 DNA 和 mRNA,用于长片段扩增、多重 PCR、数字 PCR、三代测序等应用。
材料与仪器
AllPrep DNA/mRNA Nano Kit (QIAGEN)
离心机
加热模块或水浴锅
0.2 ml、1.5 ml 或 2 ml 离心管、无菌吸头
一次性手套
乙醇(96%–100%)
步骤
从循环肿瘤细胞中提取基因组 DNA 和 mRNA,细胞在 200 μl AdnaTest 裂解/结合缓冲液(提供)中进行裂解。
mRNA 提取:
1. 向含有细胞裂解物的每个离心管中加入 20 μl Oligo(dT)磁珠。
2. 在允许倾斜和旋转的设备上,在室温下缓慢旋转管子(约 5 rpm)10 min
3. 将离心管放入不带磁极的 AdnaMag-S 中。向下摆动 AdnaMag-S 以释放盖子中捕获的磁珠和液体。
4. 插入磁极,1 min 后,将含有 DNA 的上清液转移到新的 1.5 ml 离心管(提供)中,并在 4°C 下储存直至使用。
5. 用 RNA 纯化缓冲液 A 洗涤。
6. 用 RNA 纯化缓冲液 B 洗涤。
7. 从 AdnaMag-S 上取下磁极。
8. 向每个离心管中加入 100 μl 冰冷的 Tris·Cl 缓冲液,用移液器重悬磁珠。
9. 将磁极插入 AdnaMag-S。
10. 1 min 后,完全除去上清液。
11. 从 AdnaMag-S 上取下磁极。
12. 根据下游应用的不同,请按照以下两个选项之一进行操作。
以不带磁珠的 cDNA 合成为例:加入 10–20 μl 冷的 10 mM Tris·Cl. 加热至 80°C ,2 min,然后立即将试管放在磁极上。将洗脱的 mRNA 快速转移到新的无 RNase 管中,然后继续进行下游应用或在 −80°C 下储存。
基因组 DNA 提取:
13. 准备洗脱缓冲液 AVE/APN。对于每个样品,将 22.4 μl 缓冲液 AVE 与 7.6 μl 洗脱缓冲液 APN 混合。
14. 向含有第 4 步细胞裂解物的每个离心中加入 600 μl RNase-Free Water。
15. 加入 40 μl 蛋白酶 K,涡旋 3 次,并在 56°C 下孵育 10 min。
16. 加入 150 μl 结合缓冲液 APN。
17. 向每个样品中加入 30 μl 磁珠悬浮液 APN。
18. 室温下缓慢旋转孵育(约 5 rpm)10 min。
19. 将试管放入不带磁极的 AdnaMag-S 中。向下摆动 AdnaMag-S 以释放盖子中捕获的磁珠和液体。
20. 插入磁极,30 s 后,除去上清液。
21. 用缓冲液 APN1 洗涤。
22. 用缓冲液 APN2 洗涤。
23. 从 AdnaMag-S 上取下磁极,取下反应管,并短暂离心。
24. 将反应管放回 AdnaMag-S 架子中,并将磁极插入 AdnaMag-S。
25. 30 s 后,完全去除残留的洗涤缓冲液。
26. 通过重复移液(5x)将磁珠重悬于 25 μl 洗脱缓冲液 AVE/APN 中,并在室温下孵育 1 min。
27. 短暂离心。
28. 将反应管放入 AdnaMag-S 中,并将洗脱液转移到新的 1.5 ml 管中。
29. 将装有 gDNA 的反应管放在冰上进行后续分析,或储存在 -30 至 -15°C 下。
内容来源: QIAGEN 凯杰
来源:丁香实验
