合作专家 | 李子涵博士
肿瘤免疫 中山大学
审核专家 | 孔旭博士
生物学 厦门大学
简介
质粒 DNA 和其他包装质粒共转染至细胞(293T 细胞)产生病毒,称为病毒包装。
原理
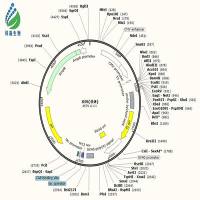
以慢病毒包装为例,主要包括 3 个质粒:质粒 DNA 可以转录出慢病毒遗传物质(RNA),但不能翻译出慢病毒的外壳及蛋白成分的载体质粒,其同时含有目的基因和报告基因,psPAX2 是可以表达慢病毒外壳的质粒,其表达产物可通过粘附机制更易穿过细胞膜。
pMD2.G 为慢病毒的膜蛋白质粒,通过脂质体进行三质粒共转到靶细胞基因组中,宿主基因组在表达时,随宿主基因转录出的目的基因 RNA 与 psPAX2、pMD2.G 基因翻译出的蛋白组装为慢病毒。病毒进入细胞后,其遗传物质 RNA 逆转录出 DNA,该基因再整合到靶细胞的基因组中,完成转染过程。
因为质粒 DNA 只能转录出病毒 RNA 和表达目的基因却不能表达出病毒的外壳和膜蛋白成分,因此其不能像普通的病毒一样在宿主细胞能反复增殖,故对宿主细胞是无害的并且高效的将目的基因转染到靶细胞基因组中。
用途
病毒产生,包装病毒。
材料与仪器
步骤
(1)293T 细胞铺板
取对数生长期的 293T 细胞,用 0.05% 的胰蛋白酶消化 293T 细胞,计数。
若是 10 cm 大皿,建议按照 10-12 × 106 每皿的数量将 293T 细胞均匀铺入。
若是 6 孔板,建议按照 2 × 106 每孔的数量将 293T 细胞均匀铺入。
(2)第二天:在 24 小时之内,观察 293T 细胞的汇合度在 90%~95% 之间时,向其中加入 DNA-脂质体复合体,DNA-脂质体复合体制备方法如下:
a)轻轻混匀 LipoMax,根据说明书加入相应量于 500 µl Opti-MEM 无血清培养基中,混合均匀并置于室温 5 分钟。
b)在 500 µl Opti-MEM 无血清培养基中稀释 DNA,总质量为 15 µg 按照载体质粒 : psPAX2 : pMD2.G = 4 : 3 : 1 的比例加入 DNA。
c)将稀释后的 LipoMax 和稀释后的 DNA 轻轻混匀,常温静置 20 分钟,形成 DNA-LipoMax 复合体。
(3)将 DNA-LipoMax 复合体轻柔地滴加至细胞培养皿中,轻轻摇晃培养皿混匀,放入细胞培养箱中培养。
(4)病毒收集
浓缩病毒:加入 DNA-LipoMax 复合体 48 小时后,收集病毒上清,同时加入 10 ml 预温的 293T 培养基到细胞培养皿中。
将收集到的病毒上清存在 4 ℃ 冰箱中;收集 72 小时病毒上清,与 48 小时病毒上清混在一起。将离心机温度降温到 4 ℃,600 g,离心 5 分钟,去除其中的细胞碎片,上清液经 0.45 µm 滤头过滤,加入病毒浓缩液,配制浓缩病毒液。
将浓缩后的病毒放于 4 ℃ 冰箱摇床上,旋转过夜。第二天,4 度离心机,3000~4000 g 离心 15 分钟。弃掉上清液,加入 1Xpbs 或培养基重悬。
注意事项
1. 病毒包装的几个关键点主要包括:细胞因素、载体系统(尽量使用成熟的商业化载体系统)、构建重组的质粒正确与否、质粒抽提纯化情况、包装转染控制(24、48 小时的细胞及荧光状态判断)、目的基因对病毒包装影响 (基因大小、序列情况、蛋白功能毒性等都会影响到是否能包装成功)。
2. 293T 细胞状态和铺板时候的紧密会影响病毒包装效率,需要观察包装病毒后的 48 h 培养基颜色是否橙红。
3. 病毒浓缩:病毒一般在 48 h 和 72 h 各收一次。如果不想浓缩病毒的话,也可以直接将收集的病毒上清作为要感染的细胞的培养基,但是可能效果会不太好。并且一般收病毒时,培养基的营养已经损耗了很多,那样直接培养感染细胞会损害细胞,所以建议还是进行浓缩后再感染。
常见问题
1. 包装病毒时 293T 细胞状态不好,或者铺得过密,可以选择放弃该次实验。
2. 目的载体过大,不易感染。
3. 避免转染过程以及后续感染过程出现的污染。
来源:丁香实验