简介
现在已有几种软件包用于流式细胞仪数据分析。尽管每一个在处理数据时方法各异,但是基本策略是近似的。由于随着参数的增加,分析也变得愈加复杂,因此我们集中介绍一种经典的分析手段以及可以对各种流式细胞术参数通用的分析方法。
原理
白细胞的多参数数据的采集和分析实验的基本原理是参数所代表的是所要测量的内容,而通道描述的是测量的数值。共有 3 种参数: 前向散射(FSC)、侧向散射(SSC)和荧光。FSC 是测量从 2°到 22°范围的激光束(取决于设备制造商),并与所测量的粒子横切面积成比例。由于会有其他的因素影响到测量,因此仅是对粒子大小的评估。SSC 又叫垂直或 90°散射,是因为其在与激光束成 90°夹角进行测量, 并且对细胞的颗粒性等性状敏感,后者反映了与胞质成分不同的胞内颗粒的颗粒指数。荧光强度也是在与细胞流成 90。角度进行测量, 并且定量地记录所有在细胞染色过程中使用的可溶性荧光素。目前最常使用的荧光素是偶联在一抗、二抗上或偶联在亲和素上,并可以被 488nm 或大约 633nm 的波长激发。抗体可以被偶联上具有不同激发或发射光谱特性的荧光素。为了将不同颜色分离,需要使用滤光片和分色棱镜将不用特异波长反射或投射。由于荧光的发射波长范围较宽, 需要通过校正仪器的补偿电路或通过软件进行荧光补偿来去掉那些不要的重叠的荧光。所有的流式细胞仪均通过一种叫做列表模式的程序来收集数据。1 个标准的列表模式文件包括关于样品和仪器信息的标题,然后是按照顺序收集的数据。在列表模式文件里保存的数值是来自监测器的每一个参数经过电处理的电压值 (Pl ,P2,P3,. . . Pn)。如表 3-1 所示,列表模式文件里数据显示的是与每一个参数对应的通道,参数代表了对细胞 1、2、以此类推直到最后一个细胞 n 的测量值。如果对 10 000 个细胞测定 6 个参数,那么按照次序会有 60 000 个记录。

材料与仪器
步骤
白细胞的多参数数据的采集和分析实验的基本过程可分为如下几步:
(一)仪器使用校准
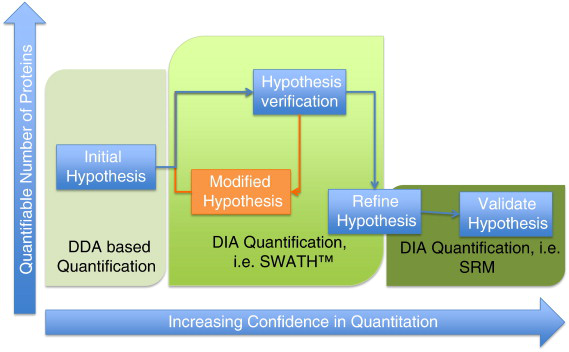
A 在收集数据前,最重要的是首先评估仪器的状况。为了达到这一点,一种简便易行的方法是通过比较当天和以前的操作。通常要使用高质量的微球对平均荧光强度和变异系数进行评估和测定。
B 对每 1 个功能参数设定 1 个阈值。当测量值落在阈值之外时,就必须进行矫正。图 3-1 举例说明了 FACSCalibur 连续 1 年每天都使用的情况。为了保证操作的稳定性,需要建立和维持仪器的保养与维护。
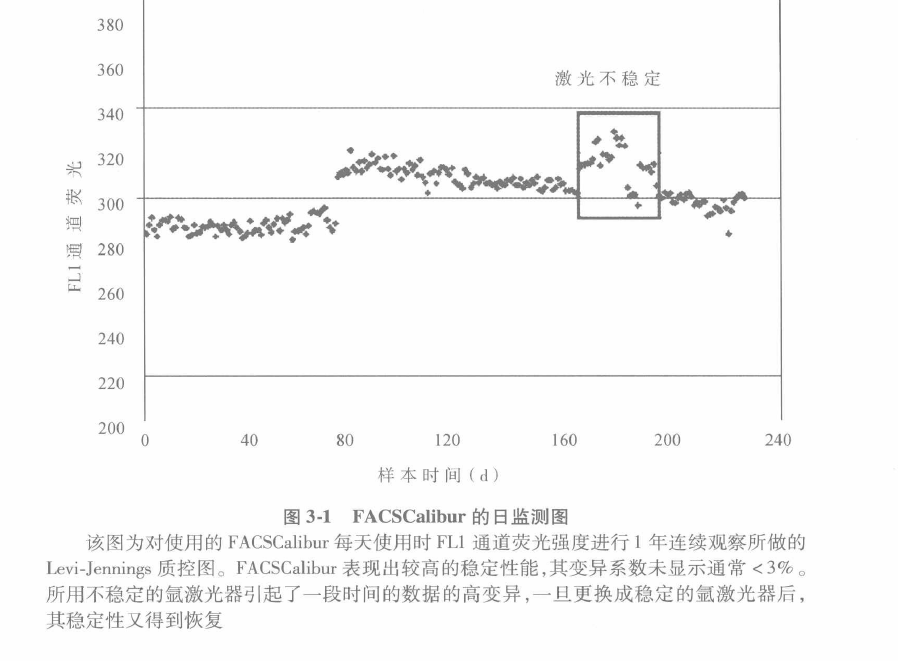
C 因为流式细胞仪是用来测定细胞的,因此操作的最后确证也是基于细胞的。在使用时要注意选择测定与仪器相吻合的细胞。
D 如图 3.2 所示在免疫分型时,用荧光抗体对细胞进行染色并测量它们的荧光强度。圈出 1 一个靶细胞所在区域作为每天使用的模版。所有不同的细胞都应该出现在它们各自的 区域。这些简便的测试保证了仪器的日常工作,使不论何时获取的数据具有很好的一致性。
(二)数据显示
A 单变量直方图
①如图 3.3 所示的单变量直方图是最简单的显示数据的方式。它是一种频率分布图,y 轴或纵坐标代表了细胞数目,而 x 轴或横坐标代表的是测量值(通道)。通常, 免疫荧光以对数数值来显示。因为这样的话可以在强度上跨越 3 到 4 个数量级。因此必须调整仪器监测器以使没有着色的细胞的荧光值在最低的对数值范围内 (图 3-3A 通道 1-10 所显示)。

②建立一个分界值以使在其右侧的细胞可以被判定为荧光抗体染色阳性。这时通常会使用同型对照免疫球蛋白 (isotype Ig),这种 IgG 是已知与细胞没有亲和力结合的,因此作为一种非特异的 IgG。然而, 人们经常忽视这一点,错误地认为供应商已经设置好了合适的 isotype 对照。如图 3-3B 所示,细胞由于抗体的非特异结合或 Fc 受体结合而比自发荧光强度更大。用合适剂量的 IgG 来封闭细胞表位可以减少 Fc 受体结合, 但是不能减少非特异结合。分界值的设定为了区分阳性和阴性细胞,并使阴性细胞的阳性峰限定在 0.5%〜2%。但是对于很少量细胞的分析用这种单变量直方图则不能充分说明问题。
③根据多数人的意见以及 NCCLS 文件,建议选用针对某种特异性抗体染色阴性的细胞作为实验的 isotype 对照。我们这里也推荐这种做法, 因为任何一个抗体都有其特定不变的亲和力,从而决定了抗体的使用浓度和特异性。另外由于 IgG 存在特异和非特异结合, 因此应该作为其自身的 isotype 对照。
B 设门
设门是一个对流式文件的某些限定部分,例如某群细胞进行分析的过程。用区域(region)来定义所感兴趣的细胞群。 这些区域有上下边界来界定。最常用的是 FSC 和 SSC 参数设门,如图 3-4 所示。但是这种策略依然存在缺陷, 就是想当然地认为所要的细胞都在圈定的区域内,这一点将在下面详细讨论。
①利用如图 34 所示的单变量直方图,我们可以通过细胞设门来分析数据。在图 3-4A 中,两个区域 R1 和 R2 分别来代表小细胞群和大细胞群,这样可以在前向散射直方图中,计算落在 R1 和 R2 边界区域内的细胞的比例。同时,还可以显示所有细胞、R1 设门中的细胞以及 R2 设门中的细胞的荧光强度直方图,分别如图 3-4B、图 3-4C 和图 3-4D 所示。这个过程就叫作设门(gating), 因为我们所得到的测量值取决于所感兴趣的区域(小细胞或大细胞)。只有落在设门区域内的细胞才被显示。
②如图 3-4C 所显示的来自 R1 设门的结果, 我们看到有两个荧光强度截然不同的直方 图, 有些类似在图 3-4B 中的阴性细胞群和强阳性细胞群。左边的为阴性细胞群,而右边的则 是阳性细胞群,因此可以将阳性与阴性很容易地区分开来。图 3-4D 的直方图是来自 R2 设门 的结果,只有一个细胞群代表的是图 3-4B 中那群中间的荧光较暗的阳性细胞群。

C 双变量分布图
当用两个参数来收集细胞而产生双变量的直方图时, 可以显示所有可能的组合。如图 3-5 所示的 4 个象限,代表了阳性和阴性细胞两两组合的结果。对于这种分析不能实现对单色高亮度 (bright) 和暗淡 (dim) 荧光的区分。用两种抗体染色有 4 种可能的组合:+-,+ +, - +及- -。而只用一个双变量的直方图就可以将这 4 种情况都显示岀来,如图 3-5 所示。

①当一个单变量的直方图分布在价轴,而另一个单变量的直方图分布在尸轴时,这样就产生了双变量的直方图 (图 3-6)。
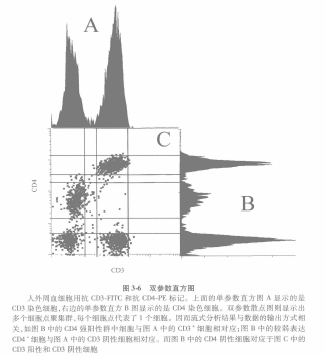
②如果这两个单变量的直方图的每一个都投射在两个参数显示图的中间位置,以点表 示细胞共同产生的聚类的值。每个点代表一个细胞。具有共同特性的细胞就会岀现重叠的点 形成聚集群。这些聚集群会有不同的形状和大小,取决于两种检测抗体之间的相互关系。这是因为在列表模式文件中数据都是相关联的。
③另外, 还可以对这些数据进一步地分析。比如,CD4 荧光较强的细胞同时为 CD3 阳性, 而那些 CD4 荧光较弱的细胞则不表达 CD3 分子。CD4 阴性的细胞可以是 CD3 阳性或 CD3 阴性。于是在单变量直方图上分开展示的这 3 群细胞可以在一个双变量的直方图上同时列出。
④通常的做法是用 FSC 和 SSC 来双变量散点图设门,在淋巴细胞聚集的周围划定区域。这种方法的前提是所有淋巴细胞落在这一聚类中,以及这一聚类里面的细胞都是淋巴细胞。但是,如图 3-7 所示, 事情并不是这样的。对于设门的任何区域,所获取的细胞的纯度都需要评估。图 3-7A 中显示了 3 个分界相当清晰的聚类, 分别以 L 代表淋巴细胞,M 代表单核细胞以及 G 代表粒细胞。而如果以 CD45 和 CD14 来染色的话,就可以看到在图 3-7B 显示的双变量的直方图。
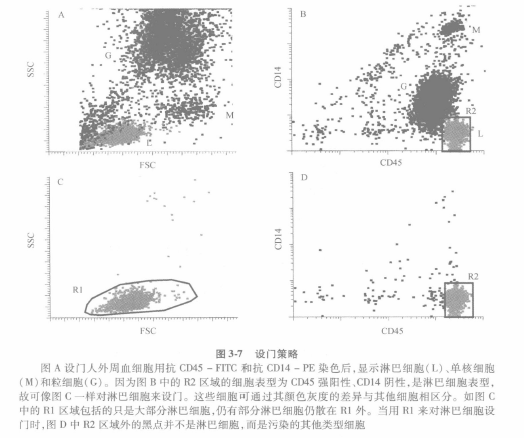
⑤R2 反映的是 CD45 hiCD14-淋巴细胞群。R2 是图 3-7C 中前向-侧向散射散点图的一个设门。而图 3-7C 中的 R1 则设定的是淋巴细胞,其 CD45 和 CD14 的表达情况如图 3-7D。那些在 R1 区域内,但在 R2 区域外的细胞不是淋巴细胞。如果 R1 设门过大的话,就会包括一些不纯的细胞而使淋巴细胞的纯度降低。图 3-7D 显示的是设门中有 7. 5% 的是污染的细胞。如果淋巴细胞的纯度低的话,比如<90% , 则可以通过降低 R1 的大小,但是这样做会使淋巴细胞部分丢失。但是只要丢失的仅是一小部分淋巴细胞,换来的是纯度的很大提高,那么这样做还是提倡的,可以获得一个理想的淋巴细胞设门,又叫作淋巴门 (lymphogate )o 这个淋巴门在前向-侧向散射图中一旦确立下来,可以用于后面的所有样品分析。在对单核细胞或粒细胞群进行分析时,可以采取同样的策略 (图 3-7A)。
D 颜色设门
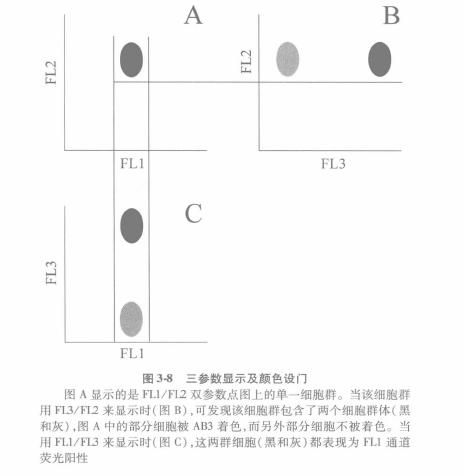
当有第 3 个颜色时,分析也变得更加复杂, 因为有 3 对双变量来描述荧光数据, 例如图 3.8 所示。按照通常的术语定义,分别是 AB1-FITC(FL1) 与 AB2-PE ( FL2) , AB1 -FITC ( FL1) 与 AB3-PC(FL3), 以及 AB2-PE(FI2) 与 AB3-PC(FL3)。而这样一来就会有 3 个散点图,故此我们需要能够在不同的二维图中来展现同一群细胞的位置,要做到这一点, 可以利用颜色设门的办法,即每一种颜色被指定到一个设门。
①图 3-8A 中,黑色显示的是 FL1 对比 FI2 的细胞群。而如果来看 FL2 对比 FL3(图 3-8B), 或 FL1 对比 FL3(图 3-8C), 这群细胞可能会出现在其他的任何地方。
②如图 3-8A 所示, 只看到 1 个单一的细胞群,但是在图 3-8B 中,2 个不同的细胞群,1 个是 AB3-PC 阴性,而另 1 个则是 AB3-PC 阳性。因为在图 3-8A 中,我们定义了细胞设门为黑 色,则在图 3-8B 中,这 2 个细胞群都是黑色的,即使分别为 AB2-PE+AB3-PC-和 AB2-PE+ AB3-PC+。这种情况可以通过将 AB2-PE+ AB3-PC-群定义为灰色来校正。
③在图 3-8C 中,我们看到的 2 个细胞群均是 AB1-FITC+,但是 AB3-PC -是灰色的。如 此,灰色的细胞群是 AB1-FITC+ AB2-PE+和 AB3-PC-;而黑色的细胞群则是 AB1-FITC+ AB2- PE + AB3-PCL 因此, 对于大量参数(3 个及以上)的数据自动分析,这种颜色设门是一种更为可取的策略。
④彩图 1 显示的是利用 3 种不同的抗体进行颜色设门的二维分析的例子。从 R1 到 R8, 每 1 个象限代表 1 个区域。对于要显示这 3 个荧光抗体所组成的 3 个二维组合,只要两个散点图即可以将所有可能的组合展示。任何两两组合即可,如在本例中,是 CD3-FITC 与 CD4-PE, 及 CD8-PC 与 CD4-PEO 如表 3.2 所示,基于任何一个给定的细胞其某种抗体的表达 阳性与阴性与否,可以共有 8 种可能的二维的组合(表 3.2)。
⑤通过利用布尔代数原理进行组合的区域划分,任何表型的细胞都可以被清晰地区分 开来。没有被染色的细胞只能在 R3 和 R7 区域内。我们不能只用 R3, 因为这些细胞在 R7 或 R8 区域也会存在。同样的道理, 如果我们只用 R7, 这些细胞也可在 R3 或 R4 区域存在。因 此, 根据布尔方程 R3 和 R7 清楚地定义了那些对三种抗体均阴性的细胞。这种逻辑可以用于 其他 7 种可能的二维组合。
⑥请注意表格中的数据排列情况。第一列的次序是-+ - + , 依次类推; 而第二列则 是- - + + -- + +,依次类推; 第三列是----+ + + + - - + + + +。如果再加入另外一个参数的话, 我们只需将这种分群数加倍,因此二维组合的数目是代表的是抗体(参数)的数目。8 个参数会产生 256 个细胞群。每一种组合会产生它自己独特的颜色表型,
就像在表 3-2 中最后一列中显示的彩图 1 中的 FITC-CD3,PE-CD4 和 PC-CD8。

(三)怎样制作表型图
数据分析的惯用策略是「标记」方法。对于一个二维的直方图的 4 个象限,分别代表了阴性、单阳性和双阳性的细胞,因此两种抗体区分的这四群细胞可以很容易地区分开。当两个以上的荧光颜色被使用时, 则需要多个二维的散点图。彩图 2 显示的是 4 种抗体同时使用时的情形。注意的是每当一种新的参数加入时,数据的复杂性加大,所需要的二维散点图的数目相应增加。
通常所进行的操作是首先进行前向散射和侧向散射的散点图绘制,然后圈出感兴趣的细胞群,比如淋巴细胞, 接下来利用荧光进行设门。如我们已经讨论的,所有的感兴趣的细胞不一定都被圈入,并且可能混入杂细胞。这就使人们意识到可能进行「细胞设门」是更好的方法。
基本上,需要一个或多个抗体来定义细胞,进行设门分析。例如 CD45 来定义所有白细胞,CD3 来定义 T 细胞,CD19 代表 B 细胞,CD56 + CD3 -代表 NT 细胞,CD14 定义单核细胞,以及 CD34 定义前体细胞。在此前提下, 利用侧向散射(线性或对数)和荧光抗体来分出感兴趣的细胞群。可以先圈出一群阳性细胞,然后再利用前/侧向散射和荧光来设门。这样操作的好处是一种抗体只需要一个区域即可,并且任何一个区域或组合都是一个定义的细胞设门。
这种特点已经被整合到数据分析的思路中,可以用来对付任意数目的荧光参数。并且随着参数的增加,分析起来也变得相对容易,如图 3-9 所示, 是从人外周血里区分淋巴细胞亚群的例子,这些细胞群有 T 细胞、NK 细胞和 B 细胞。
A 普通表型图
①在四色分析时,用侧向散射和荧光参数来区分每一个荧光,划出 1 个阳性细胞区域(图 3-9)。阴性细胞(最佳对照),作为同种异型对照或自发荧光可以用来定义阴性的群体。
②接下来,前向散射和侧向散射组合显示的是在侧向散射和抗体组合中获得的阳性细胞群(R1-R4)。这就提供阳性细胞的散射特点,还可发现之前不知道细胞群。另外一个区域,R5, 用来列举一个特定的细胞群,而产生 R5 设门和瓦(在这里 i = 1,2,3,4)。
③彩图 3 显示了所有的荧光组合。这些二维的图形可以是任何想要的一个荧光和前/侧向散射组合的结果。在这里,用 CD45 +细胞(图 3-9 中的 R4)来显示单核细胞的散射特征(图 3.9 中的 R5), 于是产生了 R4 和 R5。明显地,数据分析时,任何一个区域都可以以散射或荧光来设门。
④为了形象地显示所有二维组合中的细胞亚群,颜色设门用在每一个二维组合。我们 的策略是分派颜色来保证所有可能的表型组合。比如,在三色组合时,以红色来代表 3 个抗体 全阳性(+ + +)。如此,在二维直方图中,3 个抗体都阳性的细胞显示为红色的群。
B 四色及以上颜色的设门
颜色设门对四色及以上的参数并不适用,因为大多数人不能区分 11 或 12 种颜色(比如: 红、黄、橙、绿、蓝、紫、棕、金黄、青色、紫红、灰色和黑色)。尽管可以用阴影来区分一对颜色, 这也不能很容易地在彩图中被觉察。如此一来,5 色会产生 32 种二维的组合,需要 32 种颜 色,以至于不能分辨了。
①为了解决这一问题,我们重复使用颜色,而使其最多不超过 8 种。彩图 2 显示的是 一个例子。用 8 种颜色来代表四色荧光分析,这 8 种颜色在另一层分析中可以重复使用。
②五色荧光可能会需要四重分析, 每重分析会用同样的 8 个颜色。因此,选择 1 个或 多个荧光参数依次设门来进行 n 个独立的分析。考虑到抗体组合的目的,需要选择合适的荧 光色素标记抗体, 合适的颜色组合以及细胞设门策略。
尽管多参数数据分析的复杂性没有一个下限, 这种方法提供了一个简单的策略来处理数 据, 而不管多少个参数。因此,数据的复杂性虽然增加,但是分析手段仍旧简单。我们叫这一 过程为细胞设门,因为只有那些符合标准的细胞被筛选出来和被量化评估。
注意事项
抗体组合策略。需要从两个主要方面来决定什么抗体应该被组合: 从技术上和从科学性上。
1 技术上的考虑
①从技术层面讲抗体能保证结果的正确。针对同一抗原不同表位的抗体可能会相互封闭,否则会产生不正确的荧光补偿, 导致对结果的错误解释。
②抗原表达强度和荧光强度也要考虑在内。总的原则是使用最强的荧光素如 PE 或其串联物来标记低表达抗原,而选用较弱的荧光素如 FITC 或 PerCP 来标记高表达的抗原。APC 本是一个弱荧光素,但是由于在其激发波长上自发荧光很少而产生高信噪比而用于低表达细胞。另外,需要注意的是颜色的增加,相应地,补偿也变得更严格从而使象限分析难度增加。另外, 用折线而非矩形框设门时上面的方法仍旧可用。
2 科学性方面的考虑
①这方面主要是基于利用免疫分型实验和选用的抗体组合能否清晰地回答想要解决的问题,故而需要使用线形特异性抗体结合与感兴趣抗原相结合的抗体来识别。比如, 要分析 T 细胞表达的趋化性细胞因子受体,可以选用 CD3 来界定 T 细胞,同时与趋化性细胞因子受体抗体结合来分析。
②分析感兴趣的但是低频的细胞需要利用一组抗体去掉那些不感兴趣的细胞以及带来的相关背景。例如树突状细胞在血里面属于低频细胞。既然树突状细胞不表达 CD3、CD14、CD19 和 CD56, 这些抗体可以组合使用同一个荧光标记,例如 FITCO 另外,树突状细胞表达 CD123-PE,HLADr-PerCP, 和 CDllc-APC, 那么四色的组合可以精确地来区分树突状细胞,即 CD123 + ,HLADR+ ,CDllc+ , 同时 CD3、CD14、CD19 和 CD56 均是阴性。
来源:丁香实验