组织形态异常的原因一方面可能是受炎症因子或其他信号分子刺激下发生整体组织结构改变,也可能为发育期细胞增殖、凋亡异常造成的先天性结构缺陷,增殖凋亡分析也因此成为研究发育期或成体病如肿瘤等病理过程中的常规检测手段。
BrdU 掺入及增殖检测实验的基本原理是在免疫组化基础上,通过将目的化合物 5-溴脱氧尿嘧啶核苷(BrdU)掺入 DNA,并使用抗体来特异性识别标记物,达到标识增殖细胞的目的。
BrdU 掺入及增殖检测实验的基本过程可分为如下几步,以检测胚胎为例:
1. 按标准操作配鼠,检栓,在需要的时间取出母鼠,称重。
2. 充分溶解冷冻保存的 BrdU 储存液至完全没有沉淀。按 100 μl / 10 g 的剂量,小心按照标准操作对孕鼠进行腹腔注射。
3. 完成注射后,母鼠被放置在安静无强光处。
4. 做好准备工作,如固定胚胎所需的 PBS 缓冲液,4% 多聚甲醛等试剂。
5. 射 1 小时后,按标准操作在冷冻的 PBS 中迅速取出小鼠胚胎。
6. 按照标准操作对小鼠的胚胎进行固定,脱水,包埋。
7. 根据实验要求,按照标准操作获得小鼠胚胎合适位置的切片。通常切片时间连续间隔捞取用于 HE 染色和用于免疫组化的切片,分别使用普通玻片和黏附剂处理过的玻片,通过 HE 染色确定用于免疫组化的最佳位置的切片,以提高实验效率。
8. 将切片于 55 ℃ 烘烤过夜。
9. 选择有代表性的切片,按标准操作进行复水。
10. 将切片用 PBS 缓冲液洗 3 遍,每次 5 分钟。
11. 蛋白酶 K 处理切片,8 分钟。每 1 ml 蛋白酶工作液:938 μl MilliQ,50 μl Tris-HCI 缓冲液(pH8.0),10 μl 0.5 mol/L EDTA(pH 8.0)。
12. 将切片用 PBS 缓冲液洗 3 次,每次 5 分钟。
13. 2 mol/L HC1 处理,37 ℃,25 分钟,HCI 可以预热。
14. 将切片用 PBS 缓冲液洗 3 次,每次 5 分钟。
15. 室温下,用 3% H2O2 处理切片 15 分钟,以封闭内源性的辣根过氧化物酶。
16. 将切片用 PBS 缓冲液洗 3 次,每次 5 分钟。
17. 封闭,室温 30 分钟。
18. 用一抗稀释液稀释鼠源抗 BrdU 的一抗(1:100,Roche)。每张切片上加 50 μl 稀释好的一抗,于 4 ℃ 反应过夜
19. 将切片用 PBS 缓冲液洗 3 次,每次 5 分钟。
20. 每张切片加上 50~100 μl 预稀释的羊抗小鼠二抗,于室温反应 15 分钟。
21. 将切片用 PBS 缓冲液洗 3 次,每次 5 分钟。
22. DAB 显色,预先配好显色液(DAB 显色系统)。
23. 于显微镜下观察显色,待到在某些细胞核出现清晰的棕色信号并不再增加时,将切片放回缓冲液中停止反应。
24. 用苏木素复染细胞核。按标准操作对切片进行脱水,透明,封片。
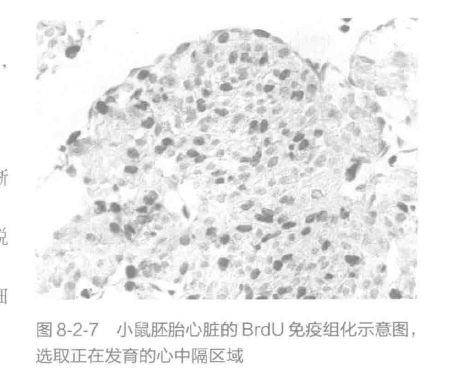
25. 待切片完全晾干后,用显微镜观察,拍照,统计细胞的增殖情况。结果示例见图 8-2-7。