简介
免疫放射分析(immunoradiometric assay , IRMA)的基本原理是用放射性同位素标记抗体,测定相应抗原,标记抗体与抗原结合产物的放射强度与抗原浓度成正比,因而灵敏度较 RIA 法更高。RIA 与 IRMA 相比通常存在以下不足:由于是竞争性结合,不能达到全部待测物与抗体结合;为了达到适宜的灵敏度,测定系统中标记抗原与抗体的结合 必须有一个较高的起点(基准);放射性同位素标记可能引起小分子抗原免疫反应性的改 变,因而标记物与标准或待测抗原同抗体的反应方式可能不完全相同;游离 Aundefined 与 Ag-Ab 的分离方法复杂、费事,不易大样本测定。而 IRMA 基本弥补了 RIA 的上述缺点,其反应式为:

随着单克隆技术的发展,IRMA 检测普遍采用了单克隆抗体,具有较高的特异性,并利用固相支持物,建立起固相 IRMA 检测方法。
原理
免疫放射分析的基本原理是用放射性同位素标记抗体,测定相应抗原,标记抗体与抗原结合产物的放射强度与抗原浓度成正比,因而灵敏度较 RIA 法更高。
固相 IRMA 检测方法的基本原理是:将单克隆抗体与乳胶颗粒或聚苯乙烯塑料试管偶联,然后加入抗原。由于单克隆抗体稍许过量,因此,可与抗原完全结合,并决定了反应的特异性;在反应结合完成后,将未结合抗原洗去,再加入 125I 标记的抗原特异抗体(Abundefined),与结合在单抗上的抗原反应,形成单抗-抗原-Abundefined 复合物,在反应结束后,洗去未结合的 Abundefined,测定结合于固相支持物上的单抗-抗原-Abundefined 复合物的放射性强度。因此,该方法分离 Ag-Aundefined 复合物与游离 Aundefined 的方法比较简单,而且放射强度与抗原量成正比(如图),适合大样本快速测定。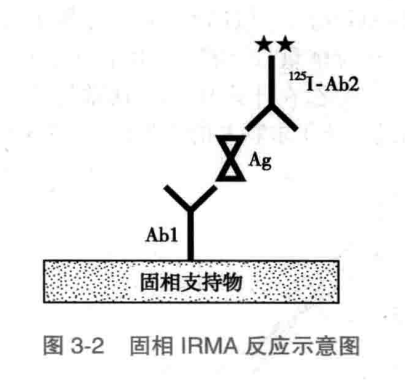

用途
免疫放射分析常用于大样本的测定。
材料与仪器
步骤
以人卵泡抑素免疫放射分析为例,其基本过程如下:
FST IRMA 检测程序:取星形免疫试管,每管包被 0.2 ml 单克隆抗体(2.5 μg/ml),包被液为 0.05 mol/L pH9.6 的碳酸盐缓冲液,4 ℃ 过夜,以 0.02 mol/L pH7.4 PBS 内含 0.05% Tween20 洗 3 次,加入 0.04 mol/L pH7.4 PBS 稀释的 2% BSA 阻断非特异吸附,室温反应 1.5 小时,洗 3 次,加入 0.04 mol/L pH7.4 PBS 稀释的标准 FST 100 μl,再加入 100 μl 兔抗 FST 多克隆抗体(以 0.04 mol/L pH7.4 PBS 内含 0.1% Tween20、0.04% NaN3、0.4% BSA 溶液,1:500 稀释),室温反应 2 小时,洗 3 次,加入 200 μl 125I 标记羊抗兔 IgG(100000 cpm),室温反应 2 小时,洗 3 次,在 γ 计数仪上测定反应管的放射计数率强度,绘制标准曲线,可在标准曲线上查出样品中的 FST 含量。
注意事项
(1)氯胺 T 标记过程,必须保证 pH 值的稳定,因此,常用 0.05~0.5 mol/L pH7.5 PB 缓冲液维持 pH 值的相对稳定。
(2)氯胺 T 标记过程包含了一个强的氧化和还原,可致某些多肽和蛋白质失活。因此,反应时间应控制在适度的范围内,一般以 30~60 秒氧化时间为宜。氯胺 T 标记法多用于小分子蛋白(多肽)标记,标记率较高。
(3)Iodogen 法中,如果没有 N2 气,也可采用 CO2 温和地吹干,其效果类似。
(4)Iodogen 法在标记大分子蛋白质方面比氯胺-T 法稳定,蛋白质活性保持较好,尤其是在 125I 标记 Ig 时更具有优越性,125I 利用率通常在 60% 以上,蛋白质标记可达 15000 cpm/ng 蛋白。
(5)根据抗原的不同,免疫复合物分离的二抗法,一般可根据情况加入 4% 左右的 PEG,促进 Ag-Ab 免疫复合物的沉淀形成。
(6)固相 IRMA 采用单克隆抗体包被时,高 pH 值缓冲液有时会损伤抗体的生物学活性,因此,包被液也经常采用 pH7.5 磷酸盐缓冲液或 pH8.0 硼酸盐缓冲液替代 pH9.5 碳酸盐缓冲液。
来源:丁香实验


![碘[125I]-糖类抗原242(CA242)磁性微粒子](https://custom.dxycdn.com/trademd/upload/pic/2015/03/09/A1425631748.jpg!small.t.1)



