标记抗体的免疫放射技术(IRMA)
互联网
1925
- 相关专题
(一)原理
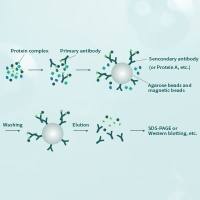
IRMA是采用过量的标记抗体与待测抗原 的非竞争性结合反应,然后加入固相的抗原吸附剂以结合游离的标记抗体,离心去沉淀,测定上清液中的放射性强度,从而推算出待测样品的抗原含量。
(二)放射免疫 检测与免疫放射检测(即IRMA与RIA)的区别见表13-4。
表13-4 IRMA与RIA的区别
IRMARIA标记物质抗体抗原标记物用量过量限量反应方式直接结合竞争性结合B、F分离方式固相抗原免疫吸附剂第二抗体等(三)标记抗体的制备 特异性抗体的制备,质量要求及125I标记方法与RIA基本相同。抗体IgG分子中含有多个氨基酸残基,经过碘化反应后,不影响其免疫学 活性,并能结合上较多的碘原子,标记物的比放性高,克服了RIA中某些抗原不易标记,或在标记过程中容易发生化学或放射性损伤等缺点。同时纯化的抗体比抗原的纯品来源更为丰富。标记抗体的方法比较单一,也易于掌握,不同于标记抗原,每一种抗原必须标记一次,且抗原复杂,多种多样,标记方法也多种多样。如果将抗体分子酶解成Fab片段,形成单价抗体,再进行标记,这样其敏感性将显著高于一般的IRMA。 (四)免疫吸附剂的制备 免疫吸附剂是将高纯度的抗原连接在固相载体上而制成。所用固相载体要求对抗原的结合力强,对非特异性蛋白质的吸附性能低,且具有高度的分散性,这样才能大量地结合特异性抗体。一般采用重氮化的纤维素、溴化氰化的纤维素、琼脂糖4B珠、聚丙烯酰胺、葡聚糖凝胶和玻璃粉等作为抗原吸附剂的固相载体。 近年来发展建立的双抗体夹心IRMA法,用固相抗体代替抗原免疫吸附剂,反应后形成固相抗体-抗原-标记抗体复合物,经过洗涤即可除去游离的剩余标记抗体,简化了分离步骤,并保证了较高的特异性。固相抗体的制备方法有两种:一种是物理吸附法,将塑料小珠浸泡在稀释的抗体中,用前经过洗涤即可。或者将抗体吸附在塑料试管中;另一种是采用化学连接法,将抗体较牢固的结合,这样洗涤时不易脱落,塑料小珠浸泡的条件是50mMol/L pH9.5碳酸盐缓冲液,抗体的浓度为IgG 0.1μg/ml~100μg/ml。塑料试管吸附抗体的条件是抗体浓度0.1μg/ml~100μg/ml 37℃、4h~6h或4℃ 24h。(四)测定方法 根据试验设计的特点,可分为以下几种类型。1.直接IRMA法 将待测抗原与过量的标记抗体进行温育,使二者结合。然后加入固相抗原免疫吸附剂再次温育,吸附游离的标记抗体。离心去除沉淀物,测定上清液中放射性强度。根据标准曲线即可得知待测样品中的抗原含量。2.双抗体夹心IRMA法 在待测抗原内依次加入固相抗体(或将待测品直接加入抗体包被管内)和标记抗体,反应后形成固相抗体(Abl)-抗原-标记抗体(Ab2)复合物。洗涤除去未结合的游离标记抗体。测定固相抗体或载体上免疫复合物的放射活性,根据标准曲线求得待测得抗原量。此法仅适用于检测有多个抗原决定簇的多肽和蛋白质抗原。3.间接IRMA法 此法是在上述双抗体夹心法的基础上,进一步改良为125I标记Ab2的抗体,反应形成的固相抗体(Ab1)-抗原-Ab2-标记抗体(﹡Ab3)的四重免疫复合物。其中标记抗体(﹡Ab3)可做为通用试剂,由于同种Ab2的各种IRMA,省去了标记针对不同抗原的特异性抗体。4.BAS-IRMA法 是将生物素-亲和素系统引入免疫放射分析,建立了新一代IRMA。此法的最大优点是使用生物素的抗体和以125I标记亲和素为示踪剂,可以通用于甾体类、甲状腺素、前列腺素等多种分子物质的检测。固相半抗原结合物经过无水乙醇处理,结合非常牢固,可长期保存;反应和测定在同一试管内完成,操作十分简便,适用于IRMA技术自动化检测。