Western 印迹技术检测蛋白质实验的基本原理是将经聚丙烯酰胺凝胶分离的蛋白转移至硝酸纤维膜,然后将膜片与特异的抗体作用,抗体与膜片上的蛋白的条带结合后可被进一步检测到,如用酶标的二抗或生物素标记的二抗进行作用,可再以发色底物显色。
Western 印迹技术检测蛋白质实验的基本过程可分为如下几步:
(一)提取蛋白质
A 将培养细胞用 PBS 洗 1 次。
B 0.025% 胰酶消化细胞至细胞呈疏松状态,倒掉胰酶。
C PBS 吹打细胞,收集于离心管。
D 转入 Eppendorf 管内,用 PBS 洗 1 次。
E 加入 100 μl 细胞裂解液,打匀。
F 冰浴 20 min。
G 13000 r/min 离心 5 min。
H 吸上清液,加等量上样缓冲液。
I 煮沸变性 5 min,- 20 ℃ 保存。
(二)电泳
A 灌胶 将电泳玻璃板安置于电泳槽上,灌制 8% 分离胶 15 ml,分离胶上以 5 ml 正丁醇或 0.1% SDS 覆盖;待胶凝固后,倒去覆盖物,细胞总蛋白提取物用去离子水冲洗凝胶上部;将成层胶 8 ml 灌注于分离胶上,插入梳子。
B 上样 1 ml 上样缓冲液加入 9 μl 巯基乙醇;待测样品与上样缓冲液以 1:2 混合,100 ℃ 煮沸 5 min;成层胶凝固后拔出梳子,电泳缓冲液冲洗梳空;将蛋白质分子质量标准参照物和样品上样。
C 电泳 样品侧接负极,电流 10 mA,样品进入分离胶后,电流加大到 20 mA,电泳 4~6 h 左右,直到染料达分离胶底部。
(三)转膜
A 将凝胶拆下,左上角切下做标记,凝胶、PVDF 膜、滤纸在转膜缓冲液中平衡 30 min。
B 安装转膜装置(图 8-4)如下。
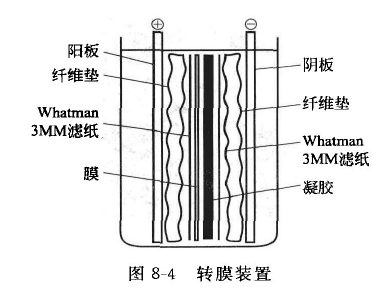

C 接通电源,恒流状态,按膜大小选择电流,≤ 0.8 mA/c㎡,转膜 6 h。
D 取出 PVDF 膜,左上角剪切口做标记,TTBS 洗膜 5 min,3 次,除去 Tris 及甘氨酸。
E 丽春红 S 染色 5 min,水脱色 2 min,可以看到膜上的电泳条带,据蛋白质分子质量标准参照物,在与所测蛋白肌动蛋白相应分子质量中间将膜剪为上下两半,再脱色 10 min,使其完全褪色。
F 把膜放入可热封的塑料袋,按滤膜面积加入封闭液,0.1 ml/c㎡,密封,4 ℃ 过夜。
(四)抗体反应
A 过夜后的膜,TTBS 洗膜 10 min,3 次。
B 分别加入用封闭液稀释的一抗,抗体稀释倍数为 1:200~1:2000(视抗体的效价的高低而定),25 ℃ 平缓摇动孵育 1 h。
C TTBS 洗膜 10 min,3 次。
D 将膜转入另一热封的塑料袋中,加入二抗工作液(1:1000),0.1 ml/c㎡,25 ℃,摇动孵育 45 min。
E TTBS 洗膜 10 min,3 次。
F ECL 试剂盒显影。










