简介
随着近年来荧光标记技术的发展,定量荧光原位杂交法(quantitative fluorescence in situ hybrid-ization,Q-FISH)也被用于端粒的显示及长度的测量,其优点首先是可以对组织切片进行原位的检测;其次,在测量端粒长度的同时,可以观测端粒的长度、完整性,以及是否存在染色体末端端粒粘连等情况;再次,对于培养细胞而言,不仅可以检测间期细胞的端粒长度,而且可以用来测量制备好的分裂期细胞单个染色体上每一个端粒的长度。因此,Q-FISH 检测也是目前应用最为广泛的端粒检测方法之一。
原理
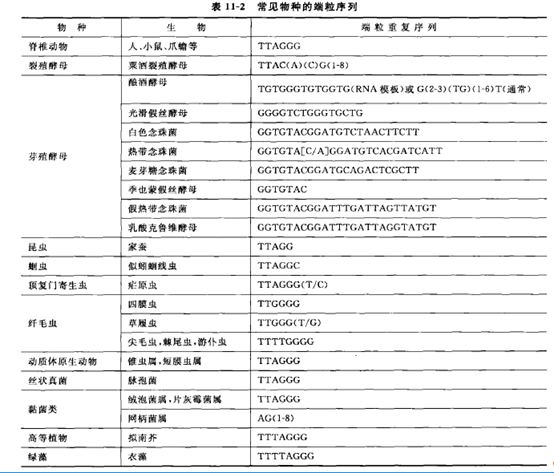
Q-FISH法检测端粒形态及长度的基本原理是尽管不同物种的端粒的重复序列可存在差异(表11-2),但在同一种生物体内为特定序列,如人端粒是由 6 个碱基重复序列(TTAGGG)和结合蛋白组成。因此,对于端粒长度的检测,传统上可以对上述重复序列设计探针,采用核酸分子杂交技术进行测量。
材料与仪器
步骤
Q-FISH法检测端粒形态及长度的基本过程可分为如下几步:
A 细胞的处理及染色体制备,培养细胞生长至盖玻片上,或取组织切片,采用 4% PFA 固定待测组织或细胞 10 min,1 x PBS 洗涤两次后,4 ℃ 保存。
B 分裂期细胞染色体制备,如需要检测单个染色体的端粒长度,可首先采用 200 μg/mL 秋水仙素处理细胞,待出现大量分裂中期细胞(染色体浓缩,细胞变圆)时,收集细胞并用 65 mmol/L KC1 低渗溶液处理细胞 1 h 使之膨胀,1500 r/min 离心浓缩细胞悬液后,用甲醛-醋酸(3:1 混合)固定液在冰上固定细胞 1 h x 4 次。将固定好的细胞悬液滴至盖玻片上,使染色体展开,继续以上述固定液处理玻片 1 h,然后以 1 x PBS 洗涤两次,4 ℃ 保存。依次采用 70%、80%、90%、100% 乙醇处理上述玻片各 10 min,脱水干燥细胞,用于下步荧光原位杂交。
C 端粒 PNA 探针的 FISH 杂交,取荧光染料标记的端粒 PNA 探针,用水调整浓度至 100 nmol/L。与杂交缓冲液混匀,滴加到脱水处理好的玻片表面。85 ℃ 加热 5 min,冷却到室温后,于湿盒中孵育过夜。
注意事项
1 PFA 有致癌作用且有挥发性,配制时应佩戴口罩避免吸入粉末,配制与固定细胞时均应在通风橱中完成,废液应专门收集处理。
2 检测单个染色体的端粒长度制备分裂中期细胞(染色体浓缩,细胞变圆)时,加入秋水仙素的量因细胞不同而异,一般应观察到分裂中期细胞多于 30% 方可收集细胞。如分裂期细胞不足,可补入少许间期细胞一同处理,避免在繁琐的处理过程中,细胞丢失而观察不到分裂期细胞。
采用 KCl 低渗溶液处理细胞时,应及时观察细胞形态,通常细胞会涨大成为一巨大球形,应同时观察细胞核也涨大,否则效果不佳,但也应避免膨胀过度导致细胞膜破裂,染色体散失于溶液中。
制备染色体滴片时,一般每个盖玻片滴加 10~20 μL 固定好的细胞,注意应调定细胞至合适浓度,以使其在盖玻片表面均匀铺开,并应注意从一定的高度(约 30~40 cm)滴下,使染色体充分展开在盖玻片表面。
来源:丁香实验








