简介
原理
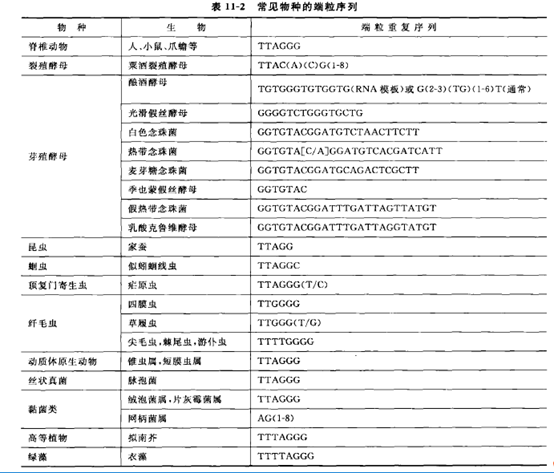
材料与仪器
步骤
Southern印迹法检测端粒长度的基本过程可分为如下几步:
(1)基因组 DNA 的抽提
A 收集好细胞或组织样品后(约 2.5 x 106 个细胞),采用 1x PBS 洗涤细胞后,加入裂解缓冲液,在 37 ℃ 孵育 30 min,然后加入 100 μg/mL蛋白酶K 55 ℃ 孵育 4 h,并每小时缓慢混匀 5~10 次。
B 待溶液冷却到室温后,加入等体积的苯酚进行抽提,30 min x 4 次,然后加入等体积苯酚-氯仿-异戊醇(25:24:1)以及氯仿-异戊醇(24:1)进行抽提,然后用 2 倍体积的 100% 乙醇-0.1 倍体积 3 mol/L 乙酸钠(pH5.2)沉淀上清液中的 DNA,将絮状沉淀挑出后,用 70% 的乙醇洗涤沉淀,室温下干燥 30 min,避免彻底干燥,然后在 4 ℃ 下溶解过夜,并采用紫外分光光度仪测定 DNA 浓度。
(2)制备 32P-标记的端粒探针
A 选用 y-32P-ATP 以末端标记法标记端粒探针(TTAGGG)4,具体探针序列可根据不同物种端粒重复序列进行设计,一般重复 3~4 次。
B 取 100 ng 寡核苷酸(TTAGGG)4,置于 T4 激酶缓冲液中,然后加入 50 μCi y-32P-ATP(1 Ci=37 GBq),以及 10 U T4 激酶,于 37 ℃ 水浴中孵育 30 min,然后采用 QIAquick Nucle-otide Removal 试剂盒(QIAGEN)纯化探针。
(3)端粒长度及数量检测的 Southern blot 杂交
A 在 2.5 μg 基因组 DNA,加入限制性内切酶Hinf、Rsa I 各 10 U,以及反应缓冲液,置于 37 ℃ 消化过夜
B 测定浓度后,将消化好的 DNA 置于 1% 的琼脂糖凝胶中电泳,以 90 V 电压在 1x TBE 中电泳 6 h,然后将凝胶浸入到 0.25 mol/L HCl 中 11~15 min,用水润洗后,将胶浸入 0.4 mol/L NaOH 中 30 min,然后用水将膜浸湿,0.4 mol/L NaOH 平衡 15 min,并以 0.4 mol/L NaOH 通过毛细现象转印法转印 18 h。
C 以 2x SSC 洗涤膜后,用紫外交联仪将 DNA 交联在膜上,并将膜置于杂交瓶中,加入 10 mL 预杂交缓冲液,42 ℃ 反应 2 h。弃去预杂交缓冲液后,将标记好的端粒探针加入到杂交缓冲液中,然后置于杂交瓶中 42 ℃ 杂交过夜。
(4)洗膜及放射性自显影
A 杂交完成后,将膜取出,加入 20 mL 洗液于室温下洗涤 10 min x 4次。
用便携式剂量仪检测膜上的放射性信号及背景,将膜封入塑料袋后,在暗室中与胶片一同置入胶片夹中,-80 ℃ 曝光 12~24 h。
注意事项
1 抽提 DNA 时应注意细胞或组织量不应过大,否则不能完全裂解,导致抽提效率不高。细胞裂解后溶液较为黏稠,应注意充分和混匀,但需注意避免因动作剧烈而导致的机械剪切力对端粒完整性的影响。采用苯酚、氯仿抽提时,可将离心管置于台式微型摇床上以 40 r/min 左右的速度摇动,以充分混匀。
3 y-32P-ATP半衰期为 14 d 左右,使用前需新鲜定购,因试剂具有放射性,操作中需要注意防护,放射性同位素沾染的废弃物以及废液应丢弃在专门的容器中统一处理。
4 洗膜过程中应注意及时用便携式剂量仪检测膜上的杂交信号以及膜周围的背景信号,以获得最佳信噪比。
来源:丁香实验








