材料与仪器
甲醛 甘氨酸 TBS 蛋白酶抑制剂 裂解缓冲液 免疫共沉淀洗脱液 TES TE
超声波粉碎仪
超声波粉碎仪
步骤
1.培养要分析的细胞。每一个样品,需要在三角瓶中培养 50~100ml 细胞至 OD600 大约为 1。
2.甲醛处理细胞交联蛋白质和 DNA。加甲醛到细胞中至终浓度为 1%(37% 的甲醛按 1:36 与细胞悬液混合),在室温维持 10~120 min,期间颠倒几次。
>注意:最佳的固定时间对不同的蛋白质是不同的,对于不同的分析要加以优化。
3.制备加有蛋白酶抑制剂的裂解/免疫沉淀缓冲液。使用 5~8 ml 裂解/免疫沉淀缓冲液 (用量根据需要而变化,详见程序 6 和 7) 来收集每个染色质免疫沉淀样品。lml 裂解/免疫沉淀缓冲液加 20ul 50 倍的蛋白酶抑制剂储存液。将缓冲液储存在冷室中。
>注意:PMSF 最好使用时加入,因其在水相中不稳定,pH 8 时的半衰期约 35 min。每毫升反应缓冲液中加入 20 一 50 倍浓度的蛋白质抑制剂储存液。
4.停止交联反应。加入 2.5mol/L 的甘氨酸至终浓度为 125 mmol/L,室温温育样品 5 min 停止交联反应。
5.用 TBS 洗细胞三次。转移样品到 GSA 瓶或 50 ml 聚丙烯管中,收集并清洗细胞。用冰冷的 TBS 洗三次,前两次用 20 mlTBS 洗,最后一次用少量洗。最后一次洗应该使用 50 ml 管,尽可能去净 TBS 以便裂解。
6.加玻璃珠裂解细胞。
A. 重悬细胞在裂解/免疫沉淀缓冲液中。在 50 ml 管中用 25ul 冰冷的裂解/免疫沉淀缓冲液重悬细胞。
B. 加玻璃珠(0.5 mm) 振荡细胞。加 3~6 ml 玻璃珠至重悬细胞(细胞量为 1X109~2X109 个),用旋涡振荡器以最髙速振荡细胞。在最初混合裂解物和玻璃珠之后,添加足够的玻璃珠在混合物中以达到混合物中含有将近 1 ml 的干玻璃珠。这可能需要 1~2 ml 的玻璃珠。在液体相对少的情况下,玻璃珠的研磨作用最好。振荡每个样品 6~8 次,每次 30s,或 4、5 次,每次 1min。最好在冷室中完成该步操作。如果在室温操作,最好间隔地把样品置于冰上冷冻。
>注意:在显微镜下检测细胞是否有效裂解。如果裂解不完全,视需要重复振荡程序。
7.收集细胞粗裂解物。加 2~3 ml 新鲜的裂解/免疫沉淀缓冲液,从玻璃珠子上洗净细胞粗裂解物。收集粗裂解物到一个 15 ml 有盖的试管中。为了收集裂解物,使用 lml 自动移液器,将移液管尖伸入管底吸取裂解物。反复吸几次,尽可能吸干净裂解物。
由于玻璃珠的吸附作用,吸取的裂解物总体积会少于添加时的体积。不用担心吸走少量玻璃珠,在后面的步骤中残存的玻璃珠会被去除。
>注意:在吸取样品或超声破碎时,不要交叉污染各裂解样品,因为此后的 PCR 扩增是很灵敏的。
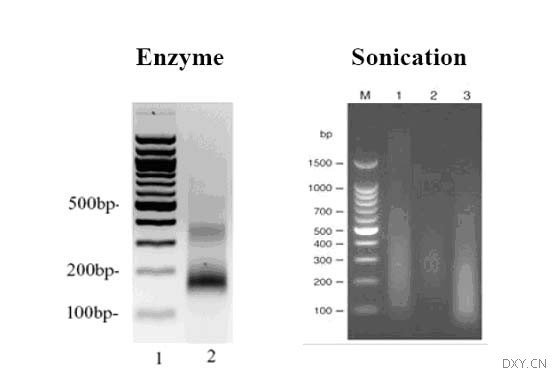
8.超声粗裂解物剪切染色质。用超声波处理上清 3 次,每次 12~15s,剪切样品中的染色质。使用 Branson250 超声器,用最小的探头,功率设为 3,100% 的有效循环。
在超声间隙,至少在冰上冷冻样品 2 min。超声后 DNA 的平均长度应为 500bp,分布在 100?lOOObp。
>注意:超声波处理后检测 DNA 片段的大小以确定有小的 DNA 片段。为了降低交叉污染,在每个样品超声波处理后仔细地清洁超声探头。
9.离心去除裂解物中的细胞碎片。在冷冻离心机中 5000r/min 离心几分钟,移去细胞碎片。转移上清到新的 15 ml Corex 离心管中进一步于 4°C 离心 5 min 后,吸去位于 10.75000 处的细胞碎片,并将上清转移到新管中。重复离心 10 min,再将上清转移到新管中。最终裂解物应该略呈乳白色。
>注意:在此步骤,可暂时将样品保存在 -80°C。
10.均化裂解物中的蛋白质的量。对每个裂解样进行总蛋白质定量。由于样品较浓,定量时需要作 10 倍的稀释。加裂解/免疫沉淀缓冲液调浓度,使每个样品的蛋白质浓度相同用于免疫沉淀。
11.移去总的染色质样。从各个样品中移出 50ul 样,加 20ul 的 TE/1%SDS。这就是总的染色质样。样品含有剪切的基因组 DNA,用来判断免疫沉淀之前的 DNA 的量。不要用这些样品做免疫沉淀,但是应该对它们进行与免疫沉淀的样品同样的操作,为控制 PCR 提供内参 DNA。
12.免疫沉淀选择的蛋白质。完成三步免疫沉淀,在每个免疫沉淀实验中使用细胞裂解液应该含有 30 mg 总蛋白质。
预清除:裂解物跟血清孵化除去非专一性结合的抗原。如果可以得到,使用免疫前的血清。若不能得到就使用标准血清。
一抗:添加适当量的抗体到裂解物中,4°C 温育一至几个小时。
无抗体免疫沉淀对照:对应每个一抗样品,做无抗体免疫沉淀对照。这个对照表明玻璃珠或其他因素对非专一性免疫沉淀的水平检测结果的影响。
二抗:添加 40ul 50% 抗体 A(兔抗)或抗体 G(鼠抗)琼脂糖珠。4°C 温育样品 lh。这是高亲和结合程序,延长时间不可能提高免疫沉淀效果。
13.为免疫沉淀后清洗准备含有蛋白酶抑制剂的裂解缓冲液。在免疫沉淀后清洗的程序中,每个样品需要 2 ml 裂解缓冲液和 lml 裂解缓冲液/500 mmol/L NaCl。
14.洗涤免疫沉淀珠子。
A. 去除免疫沉淀上清。3000 r/min 离心 lmin 沉降珠子,去除上清。如有必要可以保存上清以备后面的分析。
B. 按以下程序洗免疫沉淀珠子。在每次清洗后,1000 g 转速振荡珠子 lmin(同步骤 13),用小枪头移除液体,避免吸到珠子。加 1ml 清洗溶液,室温洗 3~5 min,重复 3 次。每次洗后,3000r/min 离心去除洗液。清洗步骤如下:
a.用裂解液洗两次
b.用裂解液/500 mmol/L NaCl 洗一次
c.用免疫沉淀洗脱液洗两次
d.最后用 TE 洗一次
15.用 TES 洗脱免疫沉淀样(TE/1%SDS)
a.加100ul TES 在 65°C 温育 15 min,从抗体珠子上洗脱免疫共沉淀样。
b.13000r/min 离心,沉降珠子,将上清吸到一个新管子中。
c.再用 150ul TE/0.67%SDS 混合液洗脱一次,上清与第一次的合并。
d.离心上清,将清液转移到另一只新管子中,以去除残余的珠子。离心后,能合并上清 250ul,剩余约 10ul 与珠子一起残留在管底。
16.温育所有的样品逆转交联。在 68°C 温育洗脱样和总的染色质样,逆转交联。
17.用蛋白酶 K 处理样品。
a.加 TE 到样品中。交联逆转后,加 250ul TE 使总体积为 500ul。
b.加糖原和蛋白酶 K 到各样品中。加糖原 DNA 担体和 100 吨蛋白酶 K。
c.37°C 温育样品至少 2 h。
18.加氯化锂。加 55ul 4mol/L 的氯化锂到样品中。将使得 DNA 在步骤 22 中沉淀。
19.酚氯仿抽提样品。用酚氯仿抽提样品(酚:氯仿:异戊醇比例为 25:24:1) 两次。
20.DNA 沉淀。
a.加 lml 无水乙醇到各样品中混合一下。将样品放人冰箱将有利于沉淀(一般放于一 20°C 或一 70°C) 至少 15 min。
b.12000 g 0°C 离心 10min 沉降 DNA,但若 DNA 浓度过低,可适当延长离心时间。用 75% 乙醇洗沉淀,离心去上清,空气干燥沉淀。
21.RNase 处理样品:重悬沉淀在 25~50ul 含 10 ug RNaseA 的 TE 中,37°C 温育 lh。
22.PCR 分析各样品。使用专一性引物扩增靶 DNA。同时引入阴性对照。
2.甲醛处理细胞交联蛋白质和 DNA。加甲醛到细胞中至终浓度为 1%(37% 的甲醛按 1:36 与细胞悬液混合),在室温维持 10~120 min,期间颠倒几次。
>注意:最佳的固定时间对不同的蛋白质是不同的,对于不同的分析要加以优化。
3.制备加有蛋白酶抑制剂的裂解/免疫沉淀缓冲液。使用 5~8 ml 裂解/免疫沉淀缓冲液 (用量根据需要而变化,详见程序 6 和 7) 来收集每个染色质免疫沉淀样品。lml 裂解/免疫沉淀缓冲液加 20ul 50 倍的蛋白酶抑制剂储存液。将缓冲液储存在冷室中。
>注意:PMSF 最好使用时加入,因其在水相中不稳定,pH 8 时的半衰期约 35 min。每毫升反应缓冲液中加入 20 一 50 倍浓度的蛋白质抑制剂储存液。
4.停止交联反应。加入 2.5mol/L 的甘氨酸至终浓度为 125 mmol/L,室温温育样品 5 min 停止交联反应。
5.用 TBS 洗细胞三次。转移样品到 GSA 瓶或 50 ml 聚丙烯管中,收集并清洗细胞。用冰冷的 TBS 洗三次,前两次用 20 mlTBS 洗,最后一次用少量洗。最后一次洗应该使用 50 ml 管,尽可能去净 TBS 以便裂解。
6.加玻璃珠裂解细胞。
A. 重悬细胞在裂解/免疫沉淀缓冲液中。在 50 ml 管中用 25ul 冰冷的裂解/免疫沉淀缓冲液重悬细胞。
B. 加玻璃珠(0.5 mm) 振荡细胞。加 3~6 ml 玻璃珠至重悬细胞(细胞量为 1X109~2X109 个),用旋涡振荡器以最髙速振荡细胞。在最初混合裂解物和玻璃珠之后,添加足够的玻璃珠在混合物中以达到混合物中含有将近 1 ml 的干玻璃珠。这可能需要 1~2 ml 的玻璃珠。在液体相对少的情况下,玻璃珠的研磨作用最好。振荡每个样品 6~8 次,每次 30s,或 4、5 次,每次 1min。最好在冷室中完成该步操作。如果在室温操作,最好间隔地把样品置于冰上冷冻。
>注意:在显微镜下检测细胞是否有效裂解。如果裂解不完全,视需要重复振荡程序。
7.收集细胞粗裂解物。加 2~3 ml 新鲜的裂解/免疫沉淀缓冲液,从玻璃珠子上洗净细胞粗裂解物。收集粗裂解物到一个 15 ml 有盖的试管中。为了收集裂解物,使用 lml 自动移液器,将移液管尖伸入管底吸取裂解物。反复吸几次,尽可能吸干净裂解物。
由于玻璃珠的吸附作用,吸取的裂解物总体积会少于添加时的体积。不用担心吸走少量玻璃珠,在后面的步骤中残存的玻璃珠会被去除。
>注意:在吸取样品或超声破碎时,不要交叉污染各裂解样品,因为此后的 PCR 扩增是很灵敏的。
8.超声粗裂解物剪切染色质。用超声波处理上清 3 次,每次 12~15s,剪切样品中的染色质。使用 Branson250 超声器,用最小的探头,功率设为 3,100% 的有效循环。
在超声间隙,至少在冰上冷冻样品 2 min。超声后 DNA 的平均长度应为 500bp,分布在 100?lOOObp。
>注意:超声波处理后检测 DNA 片段的大小以确定有小的 DNA 片段。为了降低交叉污染,在每个样品超声波处理后仔细地清洁超声探头。
9.离心去除裂解物中的细胞碎片。在冷冻离心机中 5000r/min 离心几分钟,移去细胞碎片。转移上清到新的 15 ml Corex 离心管中进一步于 4°C 离心 5 min 后,吸去位于 10.75000 处的细胞碎片,并将上清转移到新管中。重复离心 10 min,再将上清转移到新管中。最终裂解物应该略呈乳白色。
>注意:在此步骤,可暂时将样品保存在 -80°C。
10.均化裂解物中的蛋白质的量。对每个裂解样进行总蛋白质定量。由于样品较浓,定量时需要作 10 倍的稀释。加裂解/免疫沉淀缓冲液调浓度,使每个样品的蛋白质浓度相同用于免疫沉淀。
11.移去总的染色质样。从各个样品中移出 50ul 样,加 20ul 的 TE/1%SDS。这就是总的染色质样。样品含有剪切的基因组 DNA,用来判断免疫沉淀之前的 DNA 的量。不要用这些样品做免疫沉淀,但是应该对它们进行与免疫沉淀的样品同样的操作,为控制 PCR 提供内参 DNA。
12.免疫沉淀选择的蛋白质。完成三步免疫沉淀,在每个免疫沉淀实验中使用细胞裂解液应该含有 30 mg 总蛋白质。
预清除:裂解物跟血清孵化除去非专一性结合的抗原。如果可以得到,使用免疫前的血清。若不能得到就使用标准血清。
一抗:添加适当量的抗体到裂解物中,4°C 温育一至几个小时。
无抗体免疫沉淀对照:对应每个一抗样品,做无抗体免疫沉淀对照。这个对照表明玻璃珠或其他因素对非专一性免疫沉淀的水平检测结果的影响。
二抗:添加 40ul 50% 抗体 A(兔抗)或抗体 G(鼠抗)琼脂糖珠。4°C 温育样品 lh。这是高亲和结合程序,延长时间不可能提高免疫沉淀效果。
13.为免疫沉淀后清洗准备含有蛋白酶抑制剂的裂解缓冲液。在免疫沉淀后清洗的程序中,每个样品需要 2 ml 裂解缓冲液和 lml 裂解缓冲液/500 mmol/L NaCl。
14.洗涤免疫沉淀珠子。
A. 去除免疫沉淀上清。3000 r/min 离心 lmin 沉降珠子,去除上清。如有必要可以保存上清以备后面的分析。
B. 按以下程序洗免疫沉淀珠子。在每次清洗后,1000 g 转速振荡珠子 lmin(同步骤 13),用小枪头移除液体,避免吸到珠子。加 1ml 清洗溶液,室温洗 3~5 min,重复 3 次。每次洗后,3000r/min 离心去除洗液。清洗步骤如下:
a.用裂解液洗两次
b.用裂解液/500 mmol/L NaCl 洗一次
c.用免疫沉淀洗脱液洗两次
d.最后用 TE 洗一次
15.用 TES 洗脱免疫沉淀样(TE/1%SDS)
a.加100ul TES 在 65°C 温育 15 min,从抗体珠子上洗脱免疫共沉淀样。
b.13000r/min 离心,沉降珠子,将上清吸到一个新管子中。
c.再用 150ul TE/0.67%SDS 混合液洗脱一次,上清与第一次的合并。
d.离心上清,将清液转移到另一只新管子中,以去除残余的珠子。离心后,能合并上清 250ul,剩余约 10ul 与珠子一起残留在管底。
16.温育所有的样品逆转交联。在 68°C 温育洗脱样和总的染色质样,逆转交联。
17.用蛋白酶 K 处理样品。
a.加 TE 到样品中。交联逆转后,加 250ul TE 使总体积为 500ul。
b.加糖原和蛋白酶 K 到各样品中。加糖原 DNA 担体和 100 吨蛋白酶 K。
c.37°C 温育样品至少 2 h。
18.加氯化锂。加 55ul 4mol/L 的氯化锂到样品中。将使得 DNA 在步骤 22 中沉淀。
19.酚氯仿抽提样品。用酚氯仿抽提样品(酚:氯仿:异戊醇比例为 25:24:1) 两次。
20.DNA 沉淀。
a.加 lml 无水乙醇到各样品中混合一下。将样品放人冰箱将有利于沉淀(一般放于一 20°C 或一 70°C) 至少 15 min。
b.12000 g 0°C 离心 10min 沉降 DNA,但若 DNA 浓度过低,可适当延长离心时间。用 75% 乙醇洗沉淀,离心去上清,空气干燥沉淀。
21.RNase 处理样品:重悬沉淀在 25~50ul 含 10 ug RNaseA 的 TE 中,37°C 温育 lh。
22.PCR 分析各样品。使用专一性引物扩增靶 DNA。同时引入阴性对照。
来源:丁香实验