材料与仪器
步骤
3.1 非变性条件下重组激酶的纯化
用于磷酸化筛选的激酶必须是可溶和有活性的,且无其他激酶参杂的纯化激酶。因此,我们可以从 cDNA 表达文库中,大量生产和纯化组氨酸标记的重组蛋白质激酶,这些 cDNA 表达文库包括,用大肠杆菌载体 PQE30NST ( 检索编号:AF074376;22 ) 构建的大麦表达文库,或用 pQE30NASTattB 载体(检索编号:AY386205;23;也可见 28.3.1 ) 构建的拟南芥表达文库。我们用以下方法从这些文库中表达并纯化蛋白激酶。
表达:
( 1 ) 在 Falcon 离心管(50 ml ) 中加入 10 ml 细胞培养基。
( 2 ) 将培养物与表达组氨酸标记蛋白激酶的细菌一起接种到培养基中,这些细菌取自于保存于 -80°C 的 384 微孔板。
( 3 ) 经 37°C 剧烈摇晃过夜培养后,将细胞培养物转移至含有 90 ml 预热的 2YT 培养基的 300 ml 三角瓶中,2YT 培养基中含 100 μg/ml 氨苄青霉素,15 μg/ml 卡那霉素。继续培养至 OD 值达到 0.7。
( 4 ) 为了诱导蛋白质的表达,加入终浓度为 1 mmol/L 的 IPTG,继续在 37°C 培养 4 h。
( 5 ) 将细胞培养物转移至 50 ml 的 Falcon 离心管中(每种细胞培养物转移到两个离心管中),1900 g 离心 10 min,收集细胞,并立即保存于 -80℃。
非变性蛋白质纯化(以下步骤均在 0~4°C 下操作):
( 1 ) 取出 -80°C 冰冻保存的沉淀物,在冰上解冻。
( 2 ) 用 0.5 ml 含 0.25 mg/ml 溶菌酶和 0.1 mmol/L PMSF 的裂解液裂解处理细胞。
( 3 ) 汇总裂解产物,用设置为一半功率的超声匀浆器在冰浴条件下剪切处理裂解产物中的 DNA 3 次,每次 1 min。
( 4 ) 将裂解产物转移至 1.5 ml 离心管中,20000 g,4°C 离心 30 min。
( 5 ) 将上清液转移至新的离心管中。
( 6 ) 加入 250 μl 的 NiNTA-琼脂糖,4°C 300 r/min 振摇 1 h,以结合组氨酸标记的蛋白质。
( 7 ) 将混合物转移至 1 ml 的聚丙烯柱子中。
( 8 ) 用 10 倍体积的非变性洗涤液洗涤柱子。
( 9 ) 蛋白质分 4 步洗脱步骤洗脱,每次洗脱用 0.5 ml 非变性洗脱液。
( 10 ) 蛋白质与甘油 [ 终浓度为 20% ( V/V) ] 混合后保存于 -80℃ ( 见注释 1)。我们建议在每一步的离心、裂解、洗涤和洗脱过程中,取小样进行聚丙烯酰胺凝胶 ( 如 15% ) 电泳(图 29-1),检验这些纯化步骤的效率。用 Bradford 检测方法确定蛋白质浓度 [26] 。

3.2 蛋白质芯片上的激酶检测建议在进行芯片实验之前,先用一个已知的底物作正对照,检测激酶的活性(见注 释 2,3) 。同时还必须排除这个激酶对重组蛋白质对 3' 或 5' 端标记物磷酸化作用的可能性,如组氨酸标记 ( 见注释 4) 。
在此,我们介绍一种激酶检测后的信号分析方法。我们将样品蛋白质和对照(见注释 3 ) 用 10 X 10 的点样模式 ( 见注释 6) ,点样在 FSAT 片基上(见注释 5 ) ,每个样品重复点样 4 次。用于定量分析的点样模式最近已被报道 [23] 。
激酶检测:
( 1 ) 将在 4°C 密封保存的头一天点样的蛋白质芯片(构建方法参见第 28 章)室温下用 TBST 剧烈振摇洗涤 1 h ( 见注释 7 ) 。
( 2 ) 用 2% BSA/TBST 在室温条件下对洗过的芯片进行封闭处理 1 h。
( 3 ) 将封闭处理过的芯片放置在用 TBST 浸泡过的 Whatman 滤纸上,这样可以使芯片在接下来的激酶反应过程中不会干燥。
( 4 ) 室温下,将芯片置于 250 μl 激酶溶液中孵育 1 h,激酶溶液包含 13 μg/ml 的 CK2α 和 25 μCi/ml 放射性标记的 [ y33-P] ATP ( 见注释 1) 。孵育过程要加盖进行。
( 5 ) 用 TBST 洗涤 6 次,每次 30 min。
( 6 ) 最终,芯片用微量滴定板离心机(如 Eppendorf, Hamburg,Germany,产品目录号:5810 R ) 干燥,或者手动吹干,然后转移至 X 射线盒。
( 7 ) 用 X 射线胶片进行信号检测,将胶片放在芯片上,X 射线盒在 -80°C 保存适当的时间(见注释 8) 。然后,胶片在暗室中冲洗显影。另一种检测方法是,将胶片曝光于成像板上,然后用磷屏显像仪进行信号检测(见注释 8) 。
图 29-2 ( 左)显示了 CK2α 磷酸化筛选实验中,芯片对 X 射线胶片曝光后的典型结果,几个蛋白质的4 次重复点样在胶片上给出了不同的信号。
为了确定组氨酸标记的重组蛋白质在芯片上的定位,我们用本书中介绍的(见第 28 章)一种抗 RGS-His6 的抗体筛选这些蛋白质。几乎所有点样蛋白质都可以被检测到(约 95% ) ,如图 29-2 ( 右)所示。

3.3 潜在激酶靶蛋白的选择
在进行信号分析时,需要这个激酶不同方式的两个独立的实验结果。
潜在激酶靶蛋白的选择标准:
( 1 ) 在一个实验中如果一个样品的所有 4 个点样点在 X 射线胶片或磷屏显像仪上都给出一个相同的信号(图 29-2),那么这个蛋白质被认为是阳性的。
( 2 ) 如果在两次实验中都得到了阳性结果,这个蛋白质就被认为是一个可能的靶蛋白。
例如,从接近 800 个不同的大麦蛋白中鉴定出 21 个可能的 CK2α 靶蛋白「 22 」。最近报道了一种芯片磷酸化后用基于阈值的定量系统筛选潜在靶蛋白的方法。
3.4 潜在磷酸化靶蛋白的验证
当使用这种基于芯片的磷酸化方法作为一种离体外鉴定潜在磷酸化靶蛋白质的筛选工具时,这些被鉴定的蛋白质要用其他方法进行验证,包括离体与活体的方法,其中一些方法已在前言中提及。
我们用印迹磷酸化检测来离体验证潜在底物:
( 1 ) 用 SDS-PAGE 分离蛋白质,如用 15% SDS-PAGE,然后将蛋白质转移到 PVDF 膜上。转膜后,用考马斯亮蓝染色凝胶,检验蛋白质的转移效率。
( 2 ) 用本书中介绍的基于芯片检测的反应条件以及适当的体积,在印迹膜上进行磷酸化反应。
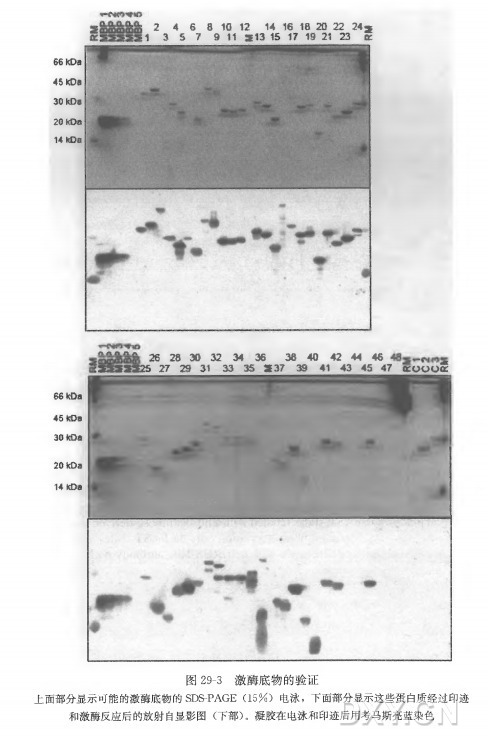
图 29-3 显示了印迹磷酸化实验的一个经典的例子。我们对在两个芯片实验中用 MAP 激酶鉴定为潜在底物的 48 个蛋白质进行验证,几乎所有的蛋白质都得到了确认,如图 29-3 所示。我们使用与芯片实验相同的阳性对照:不同浓度的髓鞘碱性蛋白 ( MBP、MAP 激酶的人工底物)。阴性对照蛋白用那些在基于芯片的激酶检测中检测 到,但还未被鉴定为是潜在底物的蛋白质(图 29-3)。
其他的体外验证方法是在溶液中进行的磷酸化检验,应用 SDS 电泳和放射性自显影检测磷酸化蛋白质 [ 8,23] 。Fukunaga 和 Hunter 曾用这种方法来验证用噬菌体 cDNA 表达文库磷酸化筛选鉴定的激酶底物。
用于磷酸化筛选的激酶必须是可溶和有活性的,且无其他激酶参杂的纯化激酶。因此,我们可以从 cDNA 表达文库中,大量生产和纯化组氨酸标记的重组蛋白质激酶,这些 cDNA 表达文库包括,用大肠杆菌载体 PQE30NST ( 检索编号:AF074376;22 ) 构建的大麦表达文库,或用 pQE30NASTattB 载体(检索编号:AY386205;23;也可见 28.3.1 ) 构建的拟南芥表达文库。我们用以下方法从这些文库中表达并纯化蛋白激酶。
表达:
( 1 ) 在 Falcon 离心管(50 ml ) 中加入 10 ml 细胞培养基。
( 2 ) 将培养物与表达组氨酸标记蛋白激酶的细菌一起接种到培养基中,这些细菌取自于保存于 -80°C 的 384 微孔板。
( 3 ) 经 37°C 剧烈摇晃过夜培养后,将细胞培养物转移至含有 90 ml 预热的 2YT 培养基的 300 ml 三角瓶中,2YT 培养基中含 100 μg/ml 氨苄青霉素,15 μg/ml 卡那霉素。继续培养至 OD 值达到 0.7。
( 4 ) 为了诱导蛋白质的表达,加入终浓度为 1 mmol/L 的 IPTG,继续在 37°C 培养 4 h。
( 5 ) 将细胞培养物转移至 50 ml 的 Falcon 离心管中(每种细胞培养物转移到两个离心管中),1900 g 离心 10 min,收集细胞,并立即保存于 -80℃。
非变性蛋白质纯化(以下步骤均在 0~4°C 下操作):
( 1 ) 取出 -80°C 冰冻保存的沉淀物,在冰上解冻。
( 2 ) 用 0.5 ml 含 0.25 mg/ml 溶菌酶和 0.1 mmol/L PMSF 的裂解液裂解处理细胞。
( 3 ) 汇总裂解产物,用设置为一半功率的超声匀浆器在冰浴条件下剪切处理裂解产物中的 DNA 3 次,每次 1 min。
( 4 ) 将裂解产物转移至 1.5 ml 离心管中,20000 g,4°C 离心 30 min。
( 5 ) 将上清液转移至新的离心管中。
( 6 ) 加入 250 μl 的 NiNTA-琼脂糖,4°C 300 r/min 振摇 1 h,以结合组氨酸标记的蛋白质。
( 7 ) 将混合物转移至 1 ml 的聚丙烯柱子中。
( 8 ) 用 10 倍体积的非变性洗涤液洗涤柱子。
( 9 ) 蛋白质分 4 步洗脱步骤洗脱,每次洗脱用 0.5 ml 非变性洗脱液。
( 10 ) 蛋白质与甘油 [ 终浓度为 20% ( V/V) ] 混合后保存于 -80℃ ( 见注释 1)。我们建议在每一步的离心、裂解、洗涤和洗脱过程中,取小样进行聚丙烯酰胺凝胶 ( 如 15% ) 电泳(图 29-1),检验这些纯化步骤的效率。用 Bradford 检测方法确定蛋白质浓度 [26] 。

3.2 蛋白质芯片上的激酶检测建议在进行芯片实验之前,先用一个已知的底物作正对照,检测激酶的活性(见注 释 2,3) 。同时还必须排除这个激酶对重组蛋白质对 3' 或 5' 端标记物磷酸化作用的可能性,如组氨酸标记 ( 见注释 4) 。
在此,我们介绍一种激酶检测后的信号分析方法。我们将样品蛋白质和对照(见注释 3 ) 用 10 X 10 的点样模式 ( 见注释 6) ,点样在 FSAT 片基上(见注释 5 ) ,每个样品重复点样 4 次。用于定量分析的点样模式最近已被报道 [23] 。
激酶检测:
( 1 ) 将在 4°C 密封保存的头一天点样的蛋白质芯片(构建方法参见第 28 章)室温下用 TBST 剧烈振摇洗涤 1 h ( 见注释 7 ) 。
( 2 ) 用 2% BSA/TBST 在室温条件下对洗过的芯片进行封闭处理 1 h。
( 3 ) 将封闭处理过的芯片放置在用 TBST 浸泡过的 Whatman 滤纸上,这样可以使芯片在接下来的激酶反应过程中不会干燥。
( 4 ) 室温下,将芯片置于 250 μl 激酶溶液中孵育 1 h,激酶溶液包含 13 μg/ml 的 CK2α 和 25 μCi/ml 放射性标记的 [ y33-P] ATP ( 见注释 1) 。孵育过程要加盖进行。
( 5 ) 用 TBST 洗涤 6 次,每次 30 min。
( 6 ) 最终,芯片用微量滴定板离心机(如 Eppendorf, Hamburg,Germany,产品目录号:5810 R ) 干燥,或者手动吹干,然后转移至 X 射线盒。
( 7 ) 用 X 射线胶片进行信号检测,将胶片放在芯片上,X 射线盒在 -80°C 保存适当的时间(见注释 8) 。然后,胶片在暗室中冲洗显影。另一种检测方法是,将胶片曝光于成像板上,然后用磷屏显像仪进行信号检测(见注释 8) 。
图 29-2 ( 左)显示了 CK2α 磷酸化筛选实验中,芯片对 X 射线胶片曝光后的典型结果,几个蛋白质的4 次重复点样在胶片上给出了不同的信号。
为了确定组氨酸标记的重组蛋白质在芯片上的定位,我们用本书中介绍的(见第 28 章)一种抗 RGS-His6 的抗体筛选这些蛋白质。几乎所有点样蛋白质都可以被检测到(约 95% ) ,如图 29-2 ( 右)所示。

3.3 潜在激酶靶蛋白的选择
在进行信号分析时,需要这个激酶不同方式的两个独立的实验结果。
潜在激酶靶蛋白的选择标准:
( 1 ) 在一个实验中如果一个样品的所有 4 个点样点在 X 射线胶片或磷屏显像仪上都给出一个相同的信号(图 29-2),那么这个蛋白质被认为是阳性的。
( 2 ) 如果在两次实验中都得到了阳性结果,这个蛋白质就被认为是一个可能的靶蛋白。
例如,从接近 800 个不同的大麦蛋白中鉴定出 21 个可能的 CK2α 靶蛋白「 22 」。最近报道了一种芯片磷酸化后用基于阈值的定量系统筛选潜在靶蛋白的方法。
3.4 潜在磷酸化靶蛋白的验证
当使用这种基于芯片的磷酸化方法作为一种离体外鉴定潜在磷酸化靶蛋白质的筛选工具时,这些被鉴定的蛋白质要用其他方法进行验证,包括离体与活体的方法,其中一些方法已在前言中提及。
我们用印迹磷酸化检测来离体验证潜在底物:
( 1 ) 用 SDS-PAGE 分离蛋白质,如用 15% SDS-PAGE,然后将蛋白质转移到 PVDF 膜上。转膜后,用考马斯亮蓝染色凝胶,检验蛋白质的转移效率。
( 2 ) 用本书中介绍的基于芯片检测的反应条件以及适当的体积,在印迹膜上进行磷酸化反应。
图 29-3 显示了印迹磷酸化实验的一个经典的例子。我们对在两个芯片实验中用 MAP 激酶鉴定为潜在底物的 48 个蛋白质进行验证,几乎所有的蛋白质都得到了确认,如图 29-3 所示。我们使用与芯片实验相同的阳性对照:不同浓度的髓鞘碱性蛋白 ( MBP、MAP 激酶的人工底物)。阴性对照蛋白用那些在基于芯片的激酶检测中检测 到,但还未被鉴定为是潜在底物的蛋白质(图 29-3)。
其他的体外验证方法是在溶液中进行的磷酸化检验,应用 SDS 电泳和放射性自显影检测磷酸化蛋白质 [ 8,23] 。Fukunaga 和 Hunter 曾用这种方法来验证用噬菌体 cDNA 表达文库磷酸化筛选鉴定的激酶底物。
来源:丁香实验