10
离子交换层析实验
最新修订时间:
简介
离子交换层析(Ion Exchange Chromatography简称为IEC)是以离子交换剂为固定相,依据流动相中的组分离子与交换剂上的平衡离子进行可逆交换时的结合力大小的差别而进行分离的一种层析方法。
来源:丁香实验
操作方法
1. 配制离子交换层析缓冲液,安装好层析柱,但以离子交换层析缓冲液取代其中的凝胶过滤缓冲液。 图一、用于蛋白质离子交换层析的梯度混合仪器 2. 用起始梯度的缓冲液溶解含蛋白质混合物的样品。 3. 弃去柱床上部的大部分缓冲液,并将样品加在凝胶的顶上。只要样品的离子强度不超过起始缓冲液的离子强度,上样体积不限。 4. 让样品流入凝胶柱床,并用缓冲液冲冼
离子交换层析介质和层析柱的选择1. 离子交换凝胶的选择依据: (1)根据蛋白质的pH只稳定范围。蛋白质在等电点pI以上pH稳定时选择阴离子交换凝胶介质,在pI以下pH的稳定时,则选用阳离子交换凝胶介质。 (2)根据特分离蛋白质的分子大小。分子量在10 000~100 000 0 Da 的蛋白,选用如DEAE-Sephacel和DEAE-Sepharose样凝胶;更大的分子,用Sephadex A-25或C-25。
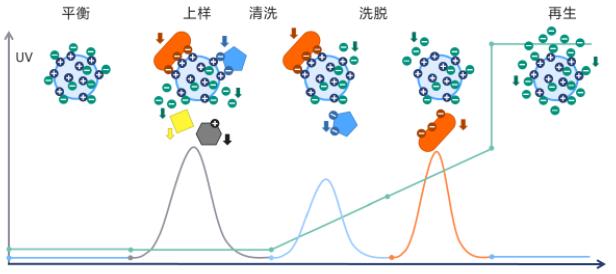
🔥 离子交换层析实验(IEC)一、IEX 分离将 IEX 介质填充到柱中以形成填充床,然后用填充基质孔隙和颗粒之间空间的缓冲液平衡床。 二、平衡1、将固定相平衡到所需的起始条件:当达到平衡时,所有固定相带电基团都与可交换的反离子(例如Na+ 或 Cl-)结合。2、选择起始缓冲液的 pH 值和离子强度,以确保在上样时,介质与目标蛋白质结合,尽量避免与杂质结合。 三、上样和清洗1、结合目标分子:样品缓冲液应具有与起始缓冲液相同的
提问
扫一扫

实验小助手

扫码领资料
反馈
TOP
打开小程序