CCK8实验时发现中间浓度梯度的吸光度反而最大,超过对照组
普通中学中下游
最近一直在做CCK8测定药物对于细胞杀伤的IC50曲线,曲线时灵时不灵,目前遇到两个问题,求大神们帮忙解答,谢谢!
第一个问题(也是最困惑我的):做了13个梯度的浓度曲线,分别是 0.018311,0.073242,0.292969,1.171875,4.6875,18.75,75,150,300,600,1200,4800,10000nM。查询文献可以知道我的药物的IC50值应该在5-20左右,但是每次做出来曲线在中间几个梯度,例如:75,150nM开始突然吸光度变得特别大,甚至超过了对照组的读数,换算成抑制率的话可以到-20%左右,而在最大浓度4800nM和10000nM的时候,吸光度又恢复正常,算下来抑制率大概在80%。并且显微镜下也可以明显看到明显高剂量处理的细胞数是少于低剂量处理的孔,但是就是加完cck8后变得更黄,想问下各位大神,这是什么问题?目前的解决办法也只有多做几个梯度,然后一个个删了,这样做13个梯度虽然作废5个点,勉强还能用剩下8个点画图,但是曲线非常不连贯。
PS:
试验用细胞:BaF3细胞,稳转过表达了激酶,撤去了IL3,用1.5ug/ml嘌呤霉素的1640++进行培养,384孔板每孔9000个细胞,总体积每孔60ul,种板当天加药,与药物共同孵育3d后加CCK8 6ul每孔,孵育大约2-3h进行读数,读取的吸光度值对照组一般在1.2-1.3左右。
1)个人认为可以排除药物溶解度问题,因为每次加药前都会吹打混匀,而且每次配一次药会同时加2块384孔板,有时候2块都没问题,有时候一块384会出现这样的情况,另一块则不会。并且查询过药物说明书,药物的在DMSO中溶解度有100mM+,所以应该不是药物析出导致的?
2)个人认为应该也不是药物具有还原性的问题?因为查询了相关文献,也是用CCK8进行试验的,同样的药物就是在有时候好用有时候不好用。药物都是从10mM的储存液稀释成1mM的工作液储存在-20℃中,需要用的时候,现用现配的。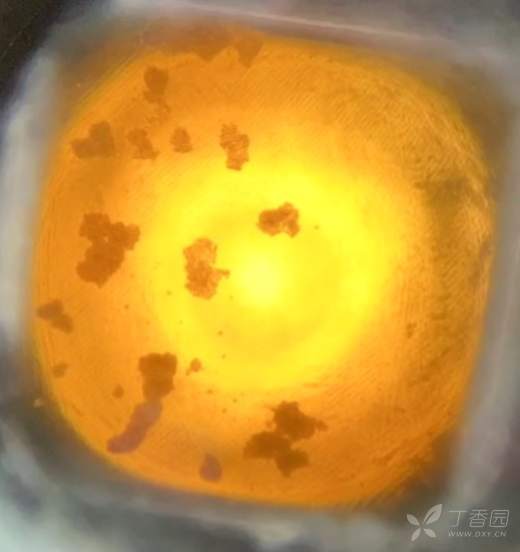
Fig1. 高剂量处理组 A 可以明显看到细胞数少但是颜色更深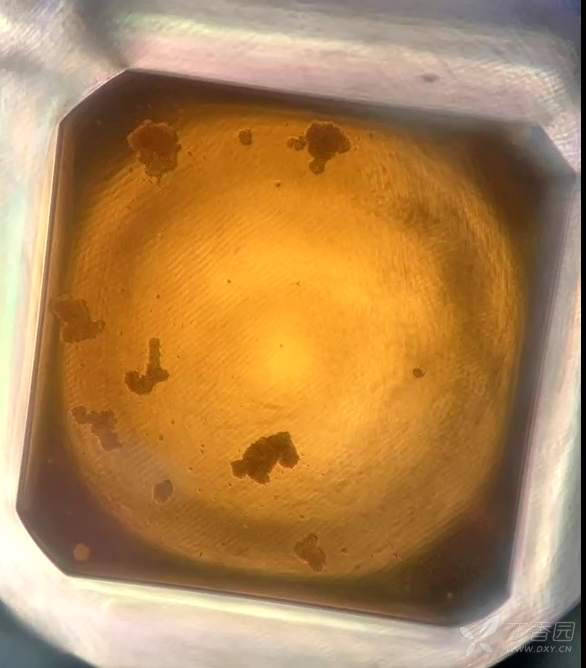
Fig2. 高剂量处理组B (独立实验) 同样的BaF3细胞,只是稳转了不同的激酶,可以看到细胞少但是颜色相对深

Fig3. 低剂量处理组 可以看到相较于Fig1和2,细胞数多但是颜色更浅

Fig4. 低剂量处理组(独立试验) 可以看到细胞数多但是颜色更浅
Fig5. 吸光度值
这是比较有代表性,也是Fig2和4对应的实验测出来的吸光度值。第2列为处理组,C、D、E行为药物处理组,浓度梯度自左向右逐渐增大,可以看到0.018至18.75nM时还是有吸光度逐渐降低,提示细胞被杀伤的趋势,但是从9-12列突然吸光度逐渐变大了。。随后在13,14,15时又恢复正常。
期待各位大神解答!
第二个问题:最高的几个浓度处理细胞抑制率无法达到90%以上。这是最近几次出现的问题,以前的IC50去掉翻车的,画出来的曲线可以顶天立地,从5%-97%左右,但是最近几次做实验发现最高浓度4800nM和10000nM处理的细胞抑制率最高也就在85%左右了,很少能到90%
目前考虑应该不是细胞的问题?因为当时怀疑是这批细胞传代了1-2个月,大概穿了10几代,可能传代过程导致细胞稳转的激酶表达降低?所以高浓度杀伤不明显?但是复苏了高代数的稳转株后发现依旧无法到达95%以上,请问各位大神有遇到这样的情况嘛?
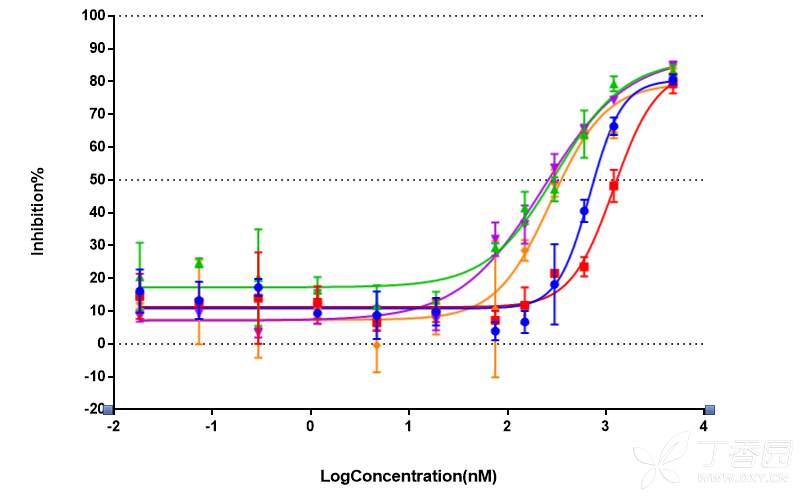
Fig6. IC50曲线示例
如图中所示,最大抑制率也就停在85%左右了,请问各位有遇到这样的情况嘛?
麻烦各位大神答疑解惑!放养的研究生在此拜谢!祝各位新年SCI多发!
1 个回答
土井挞克树
考虑还是细胞传代次数太多了,细胞内激酶浓度降低
相关产品推荐
相关问答