4 个回答
dxy_ri21al48
请问现在分离成功了吗?方便写到这个回答里面吗?
土井挞克树
一.实验方法
1.将实验小鼠脱颈处死,75%乙醇浸泡5min,固定,备皮,取背部皮肤至于含双抗的冷PBS缓冲液中。
2.仔细剥离脂肪,血管等多余组织,PBS清洗,加胰酶消化1h。
3.分离真表皮,去除表皮后,PBS清洗3次。
4.将真皮部分于培养皿内剪碎,加入适量胰酶,转移至15ml离心管内,37℃恒温水浴消化1h。
5.消化结束后,加入H-DMEM完全培养基终止反应,1000rpm离心5min,弃上清。
6.PBS清洗一遍,离心弃上清。
7.将清洗后的组织块均匀铺于6cm培养皿内,加入2ml完全培养基,37℃,5%CO2培养箱内培养24h。
8.第二天,补充培养基至5ml,继续培养,3-4天后有细胞游出。
9.7天后已有大量细胞游出,去除组织块并换新鲜培养基继续培养。
huarenqiang5
1)颈部脱臼法处死妊娠第4天(d4)的孕鼠,在无菌条件下摘取小鼠的子宫;
(2)在超净工作台上将子宫组织在无钙、镁的0.01MPBS中洗去血块和黏液,在低倍解剖镜下用眼科剪去除组织周围的脂肪块和血管;
(3)在解剖镜下沿子宫腔将其纵向切开,内膜面朝上展平于培养皿中。加入1g/LⅠ型胶原酶消化液,37℃消化30min,其间可振荡数次;
(4)消化结束后轻轻吹打组织块,挑出大块组织,按10%的浓度加入胎牛血清(fetalbovineserum,FBS)或培养液终止消化,将消化后的细胞悬液经150μm筛网过滤,除去黏液和未消化的组织,将消化液转移至含10mLPBS的离心管中静置10min;
(5)弃去上层液,下层液500×g离心10min;离心结束后弃去上清液,而后血清培养液重新悬浮细胞,500×g离心10min。重复此操作清洗细胞2次;
(6)检查细胞悬液中细胞密度,并将其密度调整到5×105个细胞/mL;(7)以0.5mL/孔将细胞接种于24孔培养板中,置入37℃、5%CO2的培养箱中培养。
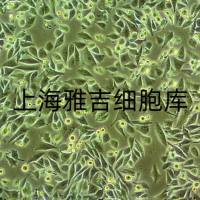
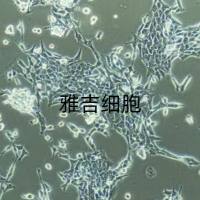
培养4~5h后细胞可以贴壁生长,24h细胞即可生成单层,单层细胞排列紧密,呈长、圆或多角形生长。
loveliufudan
小鼠子宫内膜上皮细胞的分离和培养可以采用以下方法:
准备工具和试剂:含有10%静脉血清(FBS)的DMEM / F12培养基,适当浓度的胰酶,PBS等。
将小鼠宰杀,将子宫迅速取出,并在无菌环境下进行操作。
用PBS洗涤子宫,将子宫的肌层切除。
使用含胰酶的DMEM / F12培养基,将子宫组织分离并在37°C的孵化箱中消化约30分钟。
过滤细胞悬液并离心沉淀,用含有10%FBS的DMEM / F12培养基重新悬浮细胞。
将细胞悬液转移到培养皿中,并放置在37°C的培养箱中。
24小时后更换培养基,每两天更换一次,观察细胞生长和分裂情况。
需要注意的是,成功的分离和培养小鼠子宫内膜上皮细胞需要严格控制操作过程中的无菌和时间,胰酶的消化浓度和时间要根据实验情况调整,同时保证培养基的组成和pH值符合要求。
相关产品推荐
所属专题
相关问答