分泌性蛋白浓缩后做WB,如何选择内参?
丁香实验
各位老师好,我想收集培养基后,浓缩后做WB。有几个问题想要咨询:
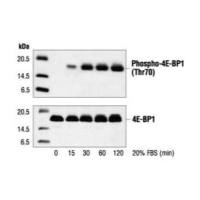
1,分泌型的蛋白必须浓缩吗?我想检测的那个蛋白,文献上是20倍超滤浓缩,我使用的是Millipore的超滤离心管。这个浓缩20倍是怎么操作的?
2,分泌型的蛋白做WB,需要内参吗?文献上的20ug是什么意思。是用BCA检测?我浓缩后用BCA检测总是失败,不知道是不是浓度太高了。一般2.5ML培养液,4000G,20min后浓缩后只有150UML左右。
我上传了文献上的方法,希望老师们能帮我解读一下这句话。谢谢

分享
32 个回答
我也是锦鲤ye
有帮助
内参的选择需要考虑实际的试验环境。
dxyhsx123
有帮助
外分泌蛋白主要是表达量低,加上提取损耗,所以真正跑胶蛋白量少,一定要浓缩,增加样本量,Mark的范围,一开始可以选的大一些,后期可以再调整。
dxy_9kptsiw
有帮助
蛋白浓度测不出来?是超过线性标准还是没有显色呢?超过要稀释蛋白样品,没有显色也是蛋白浓度低,需要重新调整提蛋白的方法
20ug指每个泳道上样量吧,定量出来后计算即可。
JCorona
有帮助
1.通常分泌蛋白在培养基中的含量都比较低,故需要浓缩,否则若浓度低于检测方法、试剂盒或仪器的检测下限就测不到或者测不准了
2.若是做定量检测,则需要内参,否则组间不可比较;20ug应该是指每个泳道的蛋白上样量,可以用BCA法检测总蛋白浓度后,计算每个泳道的样品加入量;检测失败要看具体是怎么失败的,若是浓度太高超出线性范围,则可适当稀释后再检测
于小闹0808
有帮助
不一定需要浓缩;必须需要设置内参的
是小杨同学
有帮助
1.不必须浓缩吧,操作的话我认为要先把它浓缩为1/20,2.一般是要内参吧,然后20ug的话好像是蛋白总量,需要bca定量吧
dxy_w4oj7yoe
有帮助
1.不一定要浓缩,但一般情况下分泌蛋白被分泌到细胞外培养基中浓度都会偏低,不利于检测,浓缩后浓度高才能进行后续实验,但如果一开始浓度就很高就不必浓缩了
文献意思应该就是把培养基用浓缩管浓缩到原来体积的二十分之一吧
2.wb不一定要内参吧,主要看你的目的是什么
如果需要内参的话就得看一下你的细胞还有没有什么其他的可以检测的分泌蛋白了
Guoood
有帮助
1.收集的细胞培养上清量比较大,提取分泌蛋白建议浓缩后提取,浓缩20倍的意思是比如20ml上清,浓缩成2ml即可。
2.分泌蛋白一般是胞质分泌,内参选择GAPDH
3.BCA测不出浓度的话,不排除蛋白分泌量少,可能需要收集更大量的上清浓缩后提取蛋白再测定浓度
内科小护士
有帮助
先进行浓缩,再根据蛋白表达位置选择不同的内参,不同的细胞器中选择的内参也是不一样的。
医往情深丁香园
有帮助
一般做蛋白分泌实验,是需要设置内参的,因为要确保细胞没有破裂,你得到的分泌蛋白确实是分泌蛋白而不是细胞破裂的内含物流出。
dxy_rlratyf3
有帮助
1. 不一定做浓缩,看你蛋白的具体功能和需求,但是建议先制备浓缩蛋白液,因为提取出来的蛋白浓度都低的可怜。Millipore的超滤管用前加入MilliQ水放冰箱预冷十几分钟,再加入蛋白液4度低加速度离心,记得离心机配平哈。将蛋白液浓缩到原体积的1/20即可,然后再用Bradford溶液检查膜是否漏了。
2.需要的。20ug指取部分浓缩后蛋白跑SDS-PAGE看是否浓缩了你的目的蛋白。可以用Bradford来测蛋白浓度,灵敏度高准确性好。
bamboopiggy
有帮助
1.20倍超滤,是指将收集的上清,离心后,体积为原来的1/20。你的理解没错。如果如果浓缩后的体积小于1/20,我是用pbs稀释到原体积的1/20。
2.这个没法用内参。我是用bca法测的浓度。我感觉是你上清的量太少了测不到,我一般是用10ml-20ml,用0.45的滤器过滤后,用Millipore的超滤管收集的,
水深先试浅
有帮助
没做过这个实验,但我觉得需要超滤吧,肯定需要内参呀,具体选那种看和你实验相关文献哪种用得多决定吧,文献上的20ug是指蛋白上样量吧,需要bca定量,你失败的原因找一下,会不会是操作错误的原因
一支肾上腺素
有帮助
从细胞培养上清中提取分泌蛋白的首先一步是将上清中悬浮的细胞碎片等去除掉,通常使用低速离心法去除。我一般采用800g,4C,5min离心两次的方法去除,之后再以12000rpm,30min, 4C条件进一步去除,经过这些步骤,基本上细胞碎片是去除干净了。
dxy_pni5ki46
有帮助
分泌蛋白用超滤管浓缩是比较方便的,不知道bca失败是指的什么,是超出标曲或者酶标仪检测值超上限了吗。不知道浓缩后有没有用pbs洗两遍,检测时有没有稀释过,如果没洗过并且稀释过仍然超检测限可能是培养基中的成分的影响,血清中蛋白很丰富,培养基中的氨基酸也会影响bca定量。可以试试bradford检测。
jey1235
有帮助
1、当然不必须啊,看分泌水平。看WB的话甚至换buffer都不是必须的。
2、20倍就是缩小体积20倍,直接用millipore的管子直接离心。(水平转子,温度看需要,我一般控制在3000g离心力)
3、内参看你是否有其他分泌蛋白,但是一般要给抗体设置内参,比如大小和其他来源的同种蛋白。
4、20ug就总蛋白量,使用BCA,检测失败就是检测的问题,可能是没有浓缩好。(是不是超滤管的孔径不符合要求,过大?或者管子漏了)问题很多,也可能压根没有分泌出来。
zxb597
有帮助
根据样本的种属来源选择,分析目的蛋白的分子量大小,一般需要相差5kd以上,根据蛋白表达位置选择不同的内参,不同的细胞器中选择的内参也不一样。
大番茄abcde
有帮助
建议浓缩,楼主从培养基里提取蛋白,本身细胞含有的蛋白量就少,如果不浓缩,最后可能就跑不出来,在刚开始提取的时候可以选择多提几皿,最后上样时可以选择加大上样浓度。几乎所有的蛋白需要内参,不然没有内参怎么说明问题,我们实验室多数都用BCA检测浓度,但是也有其他方法,结果都挺不错的
杨瑞瑞EZRF
有帮助
这个问题提问方式不好,“bca检测失败”,说结果不要说结论,具体怎么失败了。
1.分泌蛋白不是必须浓缩,蛋白表达量相对高,抗体特异性好的话是可以直接检测到的;20倍浓缩指的就是体积了,有专门的培养基浓缩转置,你用millipore的也是可以的,用对对用的cutoff。
2.分泌蛋白一步不用内参,收集培养基之前可以对细胞进行计数,算单位细胞的表达量。分泌蛋白怕浓度低的话可以多上一点体积。
xumusuo301
有帮助
分泌型的蛋白必须浓缩,浓缩方法就用蛋白离心管离心后用BCA定量。
做WB都需要内参。不同蛋白需要的内参不一样,可以根据需要选择。
相关产品推荐
提问
扫一扫

实验小助手

扫码领资料
反馈
TOP
打开小程序