做 WB 要了解的有关 SDS-PAGE 的基本知识
实验万事屋
今日跟大家分享关于 WB 实验的要点及背后的原理。
开场时,先 bia 个概念~蛋白质印迹法(免疫印迹试验)即 Western Blot:它是通过特异性抗体对凝胶电泳处理过的细胞或生物组织样品进行着色,通过分析着色的位置、深度获得特定蛋白质在所分析的细胞或组织中表达情况的信息。虽然此定义言简意赅,但总觉其好生硬费解,而对于得花近 2 天时间才能搞定的实验,我们如果没有较充分地理解它,就会很容易出现各种各样的 bug,最后结果也呵呵,对此自己确实深有体会。
总的来说,WB 分很多种,比如 SDS - 聚丙烯酰胺凝胶电泳 (SDS-polyac1ylarnide gelelectrophoresis, SDS-PAGE)、Native-PAGE 等,比较常用的是前者。SDS-PAGE 中的蛋白需先变性展开再进行研究,主要是根据蛋白的质量在凝胶中进行分离,特别适用于评估蛋白质量的变化。与之相反的便是 Native-PAGE:其实验原理是蛋白质保留其原生的折叠状态,并根据其净电荷、质量、形状在凝胶中分离,如体积小、结构紧凑的蛋白会迁移更快,可用于评估蛋白的化学修饰。
嗦,接下来我主要 bia 下常用的 SDS-PAGE 的相关知识。
(PS:附带一张简单明了的 DNA 印迹、RNA 印迹及蛋白质印迹流程图~~)

一、配胶、制胶
首先 SDS(十二烷基硫酸钠,一种阴离子洗涤剂)能使蛋白变性,并使所有蛋白质颗粒表面覆盖一层 SDS→使蛋白均匀地带上负电荷→从而使质量相似但形状或电荷不同的蛋白在电泳液中能以相似的速度进行迁移→→因此 SDS 被加到凝胶溶液、蛋白样品和电泳液中,以确保蛋白在整个过程都展开并保持负电荷。
其实所谓的凝胶,其本质是聚丙烯酰胺。过程中,多格聚丙烯酰胺分子相互交联,最后形成一个蛋白可以通过的三维网状结构(即聚丙烯酰胺凝胶)。配胶时会用到催化剂(AP)和加速剂(如 TEMED)、丙烯酰胺(原料)、Tris-HCl 等。AP(即过硫酸铵)能提供驱动丙烯酰胺和亚甲丙烯酰胺聚合所必需的自由基。由于过硫酸铵会缓慢分解,故应隔周新鲜配制,且置于 4 度保存。TEMED (即 N,N,N』,N』- 四甲基乙二胺) 通过催化 AP 形成自由基而加速丙烯酰胺和 N,N』- 亚甲丙烯酰胺的聚合。在加速剂和催化剂的作用下,丙烯酰胺会形成长链聚合物。我们可通过改变丙烯酰胺和双丙烯酰胺的浓度来控制凝胶孔径,如低浓度的聚丙烯酰胺孔径大,易分离较大蛋白,反之则反。而且蛋白越大,其在凝胶中迁移所需时间越长。
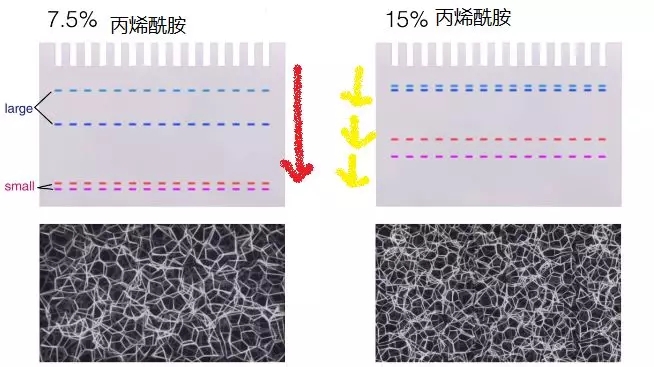
二、电泳
结合 SDS-PAGE 原理,加样前蛋白样品会先加热→蛋白去折叠。电泳槽中含有缓冲液,使得电流通过凝胶传导。加入蛋白样品和 Marker 后进行电泳。放置电极时注意将负电极置于顶部而正电极置于底部。
顺带说下,Marker 中的标准蛋白(由多种已知分子量大蛋白组成)可对照形成蛋白阶带→测量凝胶电泳后蛋白的分子量。且一般买回来的 Marker 会对标准蛋白进行预染色以提高其可见度→监测跑蛋白的进展。

三、转膜
由于凝胶太脆难以进行抗体与蛋白的自由结合及检测、显影等操作,故需转膜。目前常用 NC 膜(硝化纤维膜)、PVDF 膜(聚偏二氟乙烯膜)。通过电转移法即将电场加于凝胶 —— 使蛋白移出并附着在薄膜上。除此之外,为了防止过热导致转膜板夹层中形成气泡,故转膜时应该置于冰槽中,且注意将冰块置于黑板所在处。
四、封闭与一抗孵育
因为用于 WB 的膜对蛋白包括抗体具有高度亲和力,故加抗体前可通过封闭→减少非特异性抗体与膜结合,毕竟封闭剂内的蛋白可覆盖膜上尚未结合蛋白的区域。然后再将膜置于封闭液和能特异性识别目标蛋白的一抗溶液中孵育。其中 TBST 洗涤也起到洗去非特异性结合的一抗的作用哦。
五、二抗孵育与显影
二抗是能与荧光酶等结合并能识别一抗→使目标蛋白易于检测,并具有放大效应(一个二抗可以结合多个一抗),最后通过其能与辣根过氧化物酶聚合并产生光(HRP 法)或其他方法等进行曝光检测。
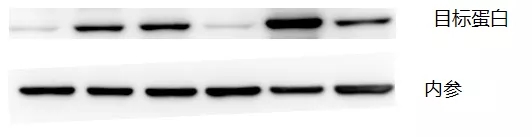
当然 WB 实验中的内参选择也是至关重要,毕竟它以表达水平不变的蛋白作为对照,能确保不同操作孔中所加样品量相接近,减少误差。选择的依据主要是分子量大小、表达水平、表达因素等,常用的如 Actin、GAPDH 等。
絮絮叨叨了一番,希望对大家特别是刚进实验室的小伙伴们有些帮助。如有纰漏,敬请谅解,并欢迎欢迎大家交流讨论。当然总不能让大家 88 看到最后,最后的最后安利个学习实验的好网站,叫做「斯达赛姆」,说好的网址据说在星球。