γδT细胞与肿瘤
三一造血技术有限公司
1934
一.γδT简介
γδ T细胞是表面具有独特T细胞受体(TCR)的T细胞。大多数T细胞是αβ T细胞,其TCR由两个糖蛋白链组成,称为α和β TCR链。相比之下,γδ T细胞具有由一个γ 链和一个δ 链组成的TCR。αβT和γδT细胞谱系起源于缺乏CD4和CD8共受体(CD4-CD8-)的T前体细胞,也称为双阴性(DN)胸腺细胞(图1)。γδT细胞通常不如αβ T细胞常见,但在粘膜和上皮部位显着富集,例如皮肤和呼吸道,消化道和生殖道。与αβT细胞相比,γδT细胞是主要的组织相容性复合物(MHC)非限制的先天样淋巴细胞,具有更独特的抗原受体,产生细胞因子如IL-17 / IFN-γ / IL-22。同时γδT细胞桥接了先天性和适应性免疫系统。虽然它们只占总T细胞的一小部分,但在修复宿主组织,病原体清除,肿瘤监测和炎症调节等方面具有多种作用。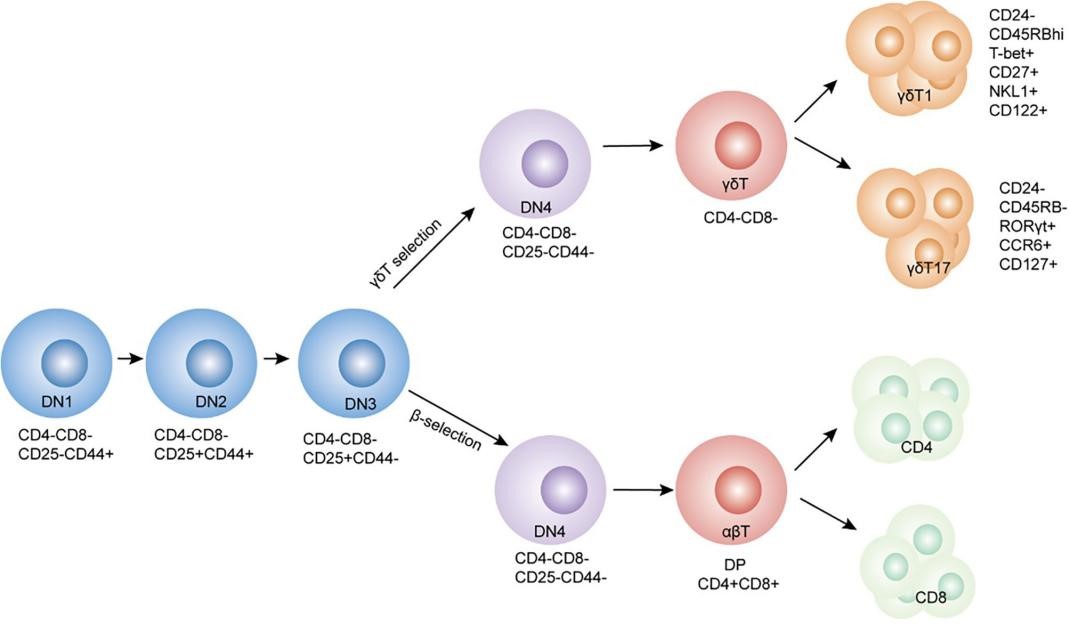
图 1 .γδT细胞的胸腺选择和发育
- γδT细胞分布及作用
Vδ1 T细胞主要存在于肠道上皮、皮肤、脾脏和肝脏中,参与维持上皮组织的完整性。它们约占外周血(PB)中γδT细胞的30%。Vδ1T细胞在维持屏障组织完整性和建立抗病毒免疫中起着至关重要的作用。研究表明,Vδ1细胞参与几种疾病,如疟疾,人类免疫缺陷病毒(HIV),巨细胞病毒(CMV),炎症性肠病和克罗恩病通过其细胞毒性和分泌细胞因子发挥作用。值得注意的是,活化的Vδ1T细胞通过NKp30识别B7-H6.B7-H6是仅在肿瘤细胞上表达的B7家族成员,并参与抗肿瘤作用。
Vδ2 T细胞主要分布在血液和淋巴系统中,是健康人类中发现的主要亚群。它占外周血γδT细胞群的50%-90%。Vδ2T细胞分为先天样(Vγ9 +)和适应性(Vγ9-)亚群,大多数Vδ2T细胞为Vδ2Vγ9 + T细胞。Vδ2Vγ9 + T细胞对细胞因子有反应,例如CCR1,CCR2,CCR5和CXCR6配体以及IL-12,并产生促炎因子,例如IFN-γ,TNF-α,IL-17,IL-21和IL-24。此外,活化的Vδ2Vγ9+T细胞获得抗原呈递细胞(APC)特性,并表现出很强的细胞因子分泌能力,如Th1/Th2 /Th17型细胞因子。这些诱导树突状细胞(DC)成熟为APC。Vδ3T细胞是外周血淋巴细胞的最小亚群,占循环细胞的0.2%。它们表达CD56,NKG2D,CD28,HLA-DR,CD161和T细胞活化标志物CD69,但不表达CD25,NKG2A或NKG2C。Vδ3T细胞在肝脏和肠道中是丰富的,并且参与慢性病毒感染和白血病。扩增的Vδ3T细胞仅识别CD1d并释放Th1,Th2和Th17细胞因子以诱导树突状细胞成熟成APC。它们不识别 CD1a、CD1b 或 CD1c 。Vδ3 T细胞和B细胞相互调节成熟标志物CD40,CD86和HLA-DR的表达,并促进B细胞的IgM释放。
此外,在淋巴瘤患者的PB中观察到Vδ4,Vδ6,Vδ7和Vδ8 T细胞,但它们的作用机制尚有待阐明。
三.γδ T细胞与肿瘤
1. 概述
目前,免疫治疗已经成为除手术、化疗和放疗之外的抗肿瘤治疗的第四大支柱,其中基于T细胞的免疫治疗是一种有效的癌症治疗策略。根据αβ和γδT细胞受体(TCR)的表达,T细胞可分为两个主要亚群。αβT细胞识别非自身的抗原肽,如癌细胞表达的抗原。αβT细胞是适应性免疫的效应细胞,这些细胞以主要组织相容性复合体(MHC)限制的方式发挥细胞毒性。然而,由于肿瘤细胞MHC分子的丢失或者低表达,肿瘤细胞通常抵抗αβT细胞的攻击。 相比之下,γδT细胞是固有免疫系统中的效应细胞,这些细胞以MHC不受限制的方式发挥作用,使它们成为癌症免疫治疗的理想介质。最近的研究表明,γδT细胞对各种类型的癌细胞具有强大的细胞毒性作用。然而,γδT细胞仅占循环淋巴细胞的一小部分,临床效益并不令人满意。目前,如何在体外获得数量充足且功能强大的γδT细胞正在成为研究的热点,一些改进方法,如双特异性抗体和CAR-γδT可能突破γδT细胞的局限性,提高抗肿瘤效果。
- γδT细胞的激活
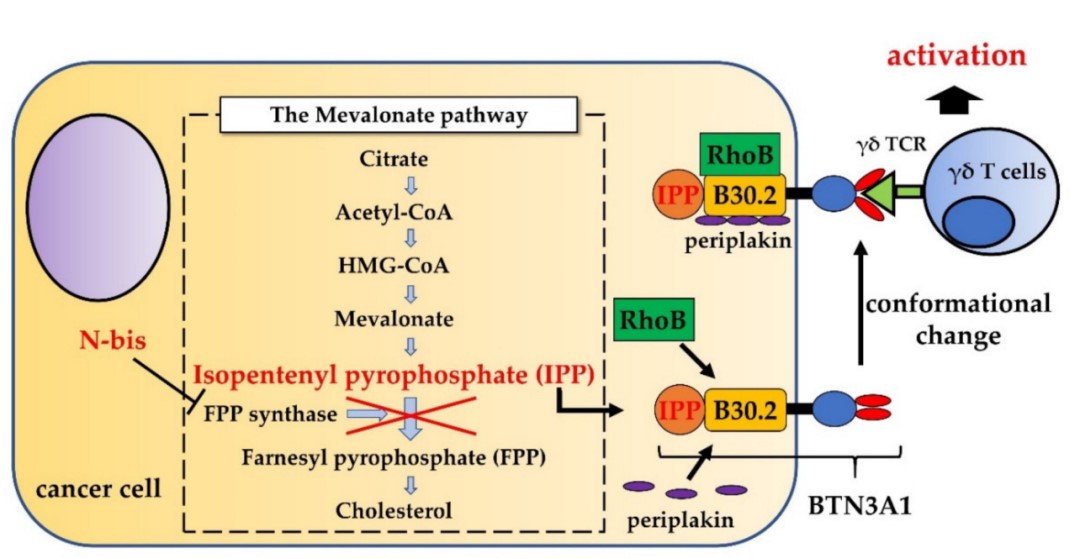
图2. γδT细胞的激活
- γδT细胞与肿瘤细胞的相互作用
互作用对癌细胞识别和γδT细胞介导的细胞毒性非常重要(图3)。
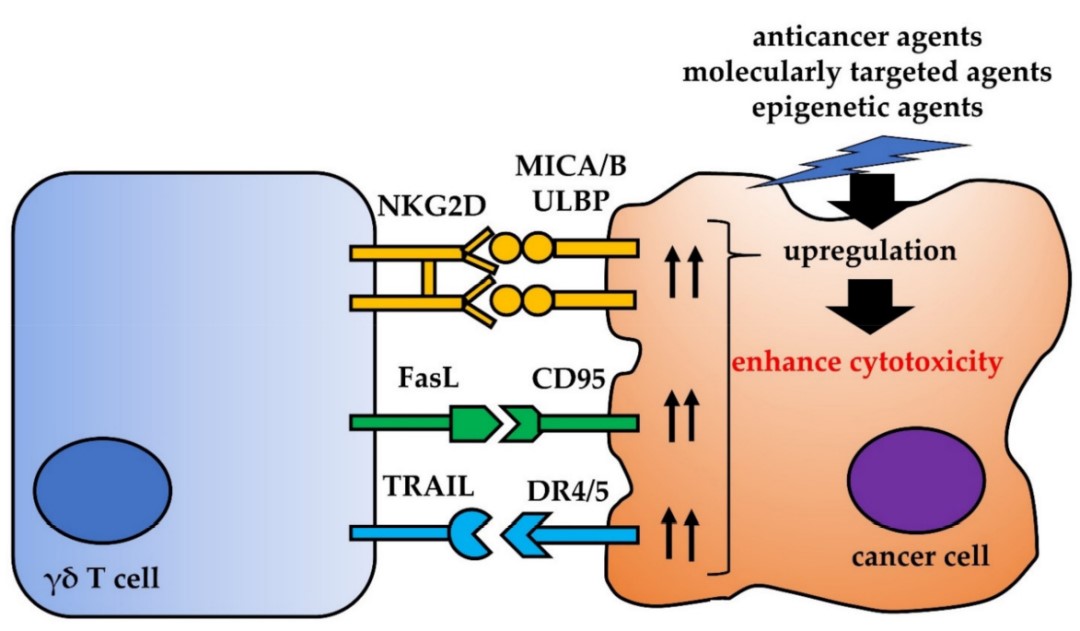
图3. γδT细胞与肿瘤细胞的相互作用
在活化的γδT细胞中,Fas配体 (FasL) 和TNF相关凋亡诱导配体 (TRAIL) 的表达上调。FasL与CD95 (也称为Fas或APO-1) 相互作用, FasL结合CD95后激活caspase级联反应,从而启动癌细胞凋亡。 TRAIL与五种受体 (TRAILRs) 相互作用:DR4、DR5、DcR1、DcR2和骨保护素。死亡受体DR4和DR5含有一个称为死亡域的胞内结构域,当这些受体与TRAIL结合时,该区域使这些受体能够启动细胞毒性信号。因此,肿瘤细胞中CD95或死亡受体DR4或DR5的上调可能增强γδT细胞介导的细胞毒性。
- 肿瘤微环境与γδT细胞
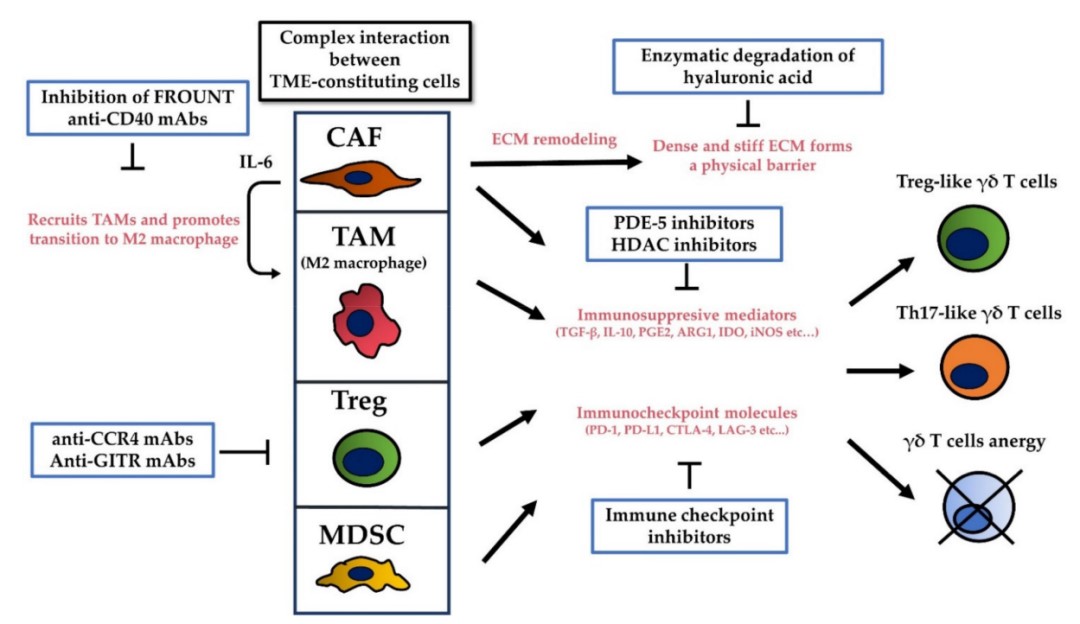
图4. 肿瘤微环境与γδT细胞
靶向TME的治疗,可以通过激活和改善γδT细胞的细胞毒性,增强抗肿瘤作用。在这些TME靶向治疗中,针对抑制性免疫检查点分子的治疗性抗体是克服TME免疫抑制效应的有效手段。过继性γδT细胞与免疫检查点抑制剂的结合是提高其细胞毒性的一种有希望的策略,因为PAG刺激的γδT细胞表达PD-1,阻断PD-1可能增强γδT细胞的抗肿瘤作用。
- 使用γδT细胞进行肿瘤治疗
图5. GD2特异性CAR-γδT细胞治疗原理
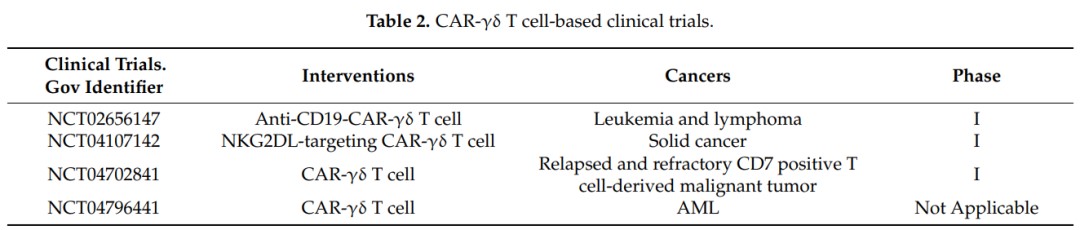
目前,一些临床研究正在进行中。CAR-γδT细胞有望成为一种新型的γδT细胞免疫疗法(表)。
表. 目前正在进行的γδT细胞临床试验
四. 总结
基于γδT细胞的免疫治疗非常有吸引力,这些细胞在体外和小鼠模型中对各种类型的癌症都显示出强烈的细胞毒性作用。然而,临床试验显示临床效益有限。新的方法,包括γδT细胞和免疫检查点抑制剂联合免疫治疗,双特异性抗体和CAR-γδT细胞都是有望克服目前治疗局限性的新策略。TME对γδT细胞免疫抑制作用的进一步研究,以及抗癌药物联合治疗、分子靶向药物、表观遗传药物、双特异性抗体以及CAR-γδT细胞的临床研究,将为未来γδT细胞免疫治疗的临床应用奠定基础。