利用 Millicell 培养小室培养皮肤及肺类器官的实验方案
默克生命科学
2904
气液界面培养(ALI)3D培养类器官实验方案- 皮肤类器官和肺类器官
1. 生成3D 皮肤类器官作为人体表皮的体外模型
皮肤是人体最大的器官,具有多种功能,包括保护、吸收物质和调节体温。皮肤具有复杂的分层结构,由三个主要层组成:1) 表皮紧密排列的细胞形成了防止物质入侵和水分流失的屏障,并包括一个称为角质层的外层,由重叠的、无活的角质细胞组成,可防止例如紫外线辐射和病原体的威胁;2)真皮,它支持着表皮,包含神经末梢、汗腺、皮脂腺、毛囊和血管。真皮的基底层是由角质形成细胞不断进行有丝分裂以补充细胞的位置; 3) 皮下层,或皮下组织,主要包含脂肪细胞并起到保护下层组织的作用,可以作为能量储备,并通过绝缘提供一定的温度调节。历史上,动物模型被用于测试化妆品的毒性和功效1 以及测试透皮药物吸收功效2。然而,出于伦理考虑,这些动物模型已逐渐被“零残忍”体外皮肤器官模型所取代,该模型使用人原代细胞及小室细胞培养来再现层状表皮结构。32013 年,欧盟率先全面禁止对化妆品进行动物试验。在此,我们将介绍一种利用人原代角质形成细胞 (PHK)、真皮成纤维细胞(人原代成纤维细胞,PHF),胶原蛋白涂层的 MilliCell® 培养插入式小室及专有的 3dGRO™ 皮肤分化培养基,在空气:液体界面培养中,引导角质形成细胞多种分化的人表皮皮肤模型的分步培养方案。
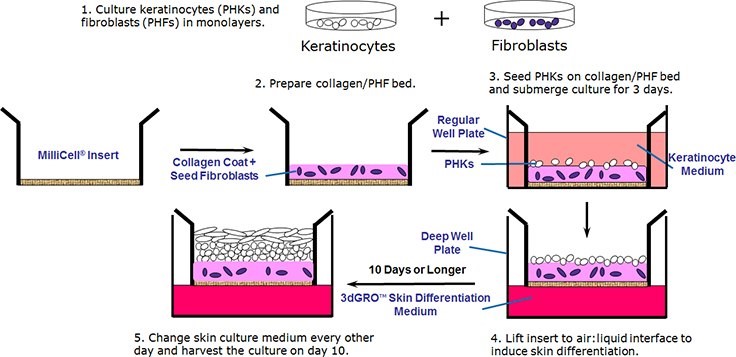
图1.类器官人体皮肤培养方案概述。
皮肤细胞培养方案
重要提示: 产生高质量3D皮肤培养的关键是人原代角质形成细胞(PHKs)和成纤维细胞(PHFs)的质量。只使用第1代或第2代的原代细胞,不要让细胞过度汇合。- 复融一支人原代角质形成细胞(C-12001, C-12005, 102-05N)和人真皮成纤维细胞(C-12300, 106-05N)或NIH 3T3细胞(93061524)在适当的生长培养基( 胎儿和新生儿细胞的角质形成细胞无血清生长培养基131-500, 成纤维细胞生长培养基116-500)。每隔一天更换新鲜的培养基,培养至细胞达到80 - 90%的融合。
- 准备胶原蛋白/PHF层(冰上准备)(总容量8ml)
a.将6ml大鼠尾胶原蛋白(08-115)加入15ml锥形管中(浓度见批次特定数据表)。
b.加入1.6 mL 5X缓冲液(1.1% NaHCO3, 0.025N NaOH, 100 mM HEPES, 5X DMEM/F12)
混合均匀。避免在胶原蛋白中产生气泡。
c.加入400µl PHFs (4 × 106细胞/mL细胞悬液)或NIH 3T3细胞。完全混合,但避免产生胶原蛋白泡沫。本步骤在冰上进行。
d.将400µL的胶原蛋白/PHF混合物直接等分加入到每个MilliCell插入式细胞培养小室(MCHT12H48)的中心。
- 在每个胶原蛋白/PHF层上放加入0.5 mL PHKs (4x105细胞/mL细胞悬液)。小心不要破坏胶原蛋白/PHF层,因为这可能会导致渗漏或收缩。在培养小室的外侧加入2ml角质细胞培养液,放入12孔的常规培养皿中。37°C过夜孵育。第二天,在不移除原培养基的情况下,在每个培养小室的内侧添加0.5 mL角质细胞培养基,并在37°C下孵育2天。PHKs应在胶原层上进行三天的液体培养。在第三天液体培养后,高质量的PHKs将接近100%聚合。
- 第 4 天,从每个小室轻轻中吸出培养基。避免接触或损坏胶原蛋白层的表面。用无菌镊子将小室转移到每孔含有 4.5 mL 3dGRO™ 皮肤分化培养基 (SCM310) 的深孔 12 孔板 (Greiner Bio-One 665110)中。
注意:您必须在细胞培养小室外部添加完全等量的培养基,以使皮肤类器官保持在空气:液体界面中。如果在培养小室的外部添加了过多的培养基,这可能会迫使额外的培养基进入小室并浸泡皮肤表层,从而导致分化中断。 - 在 37°C 下再培养皮肤类器官10 天。在 10 天的培养过程中,每隔一天更换一次 3dGRO™ 皮肤分化培养基,并去除细胞培养小室膜下方的气泡。 3D 皮肤培养 10 天后,应产生大约 8 至 10 层的活性上皮层。
结果
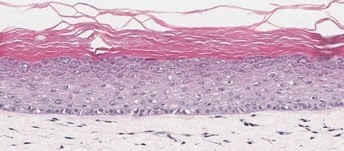
体外皮肤类器官 (A)
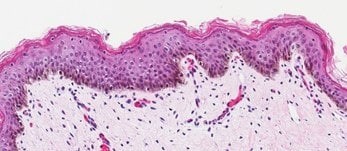
新生儿皮肤组织 (B)
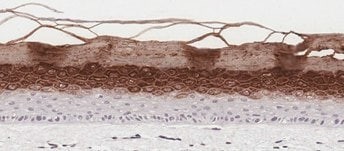
(C)
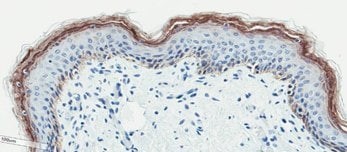
(D)
图 2. 皮肤类器官模型具有与新生儿皮肤组织相当的分层上皮形态。 H&E 染色的含有真皮和表皮分层层的体外皮肤类器官和离体皮肤切片(A、B)。丝聚蛋白染色可识别角化角质形成细胞层(棕色)(C、D)。
A
B
C
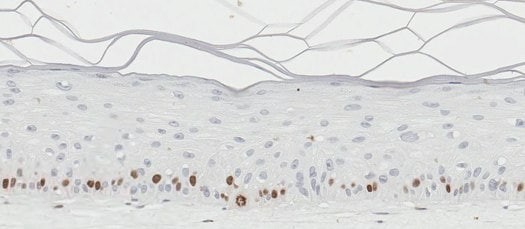
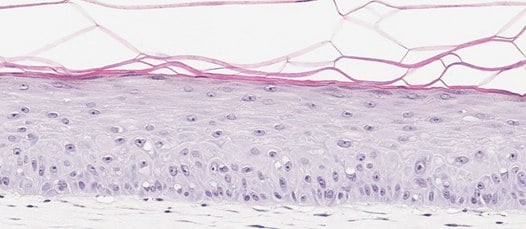
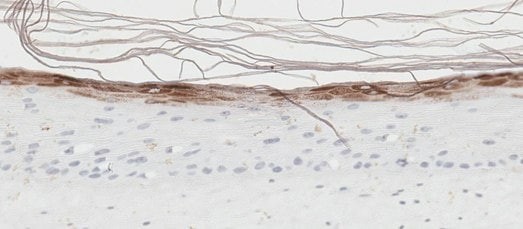
图 3. 皮肤类器官模型包含活跃增殖的角质形成细胞。BrdU(溴脱氧尿苷/5-溴-2'-脱氧尿苷)是核苷胸腺嘧啶的类似物,可用于使用BrdU特异性抗体鉴定增殖细胞。用抗BrdU抗体(棕色)(A)、H&E抗体(B)和抗聚丝蛋白抗体(棕色)(C)染色的体外皮肤模型识别真皮基底层内增殖的细胞。
材料

References
1.Adler S, Basketter D, Creton S, Pelkonen O, van Benthem J, Zuang V, Andersen KE, Angers-Loustau A, Aptula A, Bal-Price A, et al. 2011. Alternative (non-animal) methods for cosmetics testing: current status and future prospects?2010. Arch Toxicol. 85(5):367-485. http://dx.doi.org/10.1007/s00204-011-0693-22.Abd E, Yousuf S, Pastore M, Telaprolu K, Mohammed Y, Namjoshi S, Grice J, Roberts M. Skin models for the testing of transdermal drugs. CPAA. Volume 8163-176. http://dx.doi.org/10.2147/cpaa.s64788
3.Vörsmann H, Groeber F, Walles H, Busch S, Beissert S, Walczak H, Kulms D. 2013. Development of a human three-dimensional organotypic skin-melanoma spheroid model for in vitro drug testing. Cell Death Dis. 4(7):e719-e719. http://dx.doi.org/10.1038/cddis.2013.249
4.Wang H, Broker TR, Chow LT. 2015. Robust HPV-18 Production in Organotypic Cultures of Primary Human Keratinocytes.93-109. http://dx.doi.org/10.1007/978-1-4939-2013-6_7
5.Wilson J. 1992. Epithelial-specific gene expression during differentiation of stratified primary human keratinocyte cultures. Cell Growth Differ. 3(8):471-483.
2.气液界面 (ALI) 3D 培养人支气管上皮细胞
气液界面 (ALI)3D 细胞培养技术支持将人支气管上皮细胞从 16HBE14o-等细胞分化为成熟的肺表型。使用 ALI 细胞培养技术培养的支气管上皮细胞可以形成极化细胞层和紧密连接,并且可以分化和呈现功能性纤毛。ALI细胞培养方法依赖于 Millicella/Transwell插入式细胞培养小室来支持类体内观察到的假复层粘液纤毛表型的发展。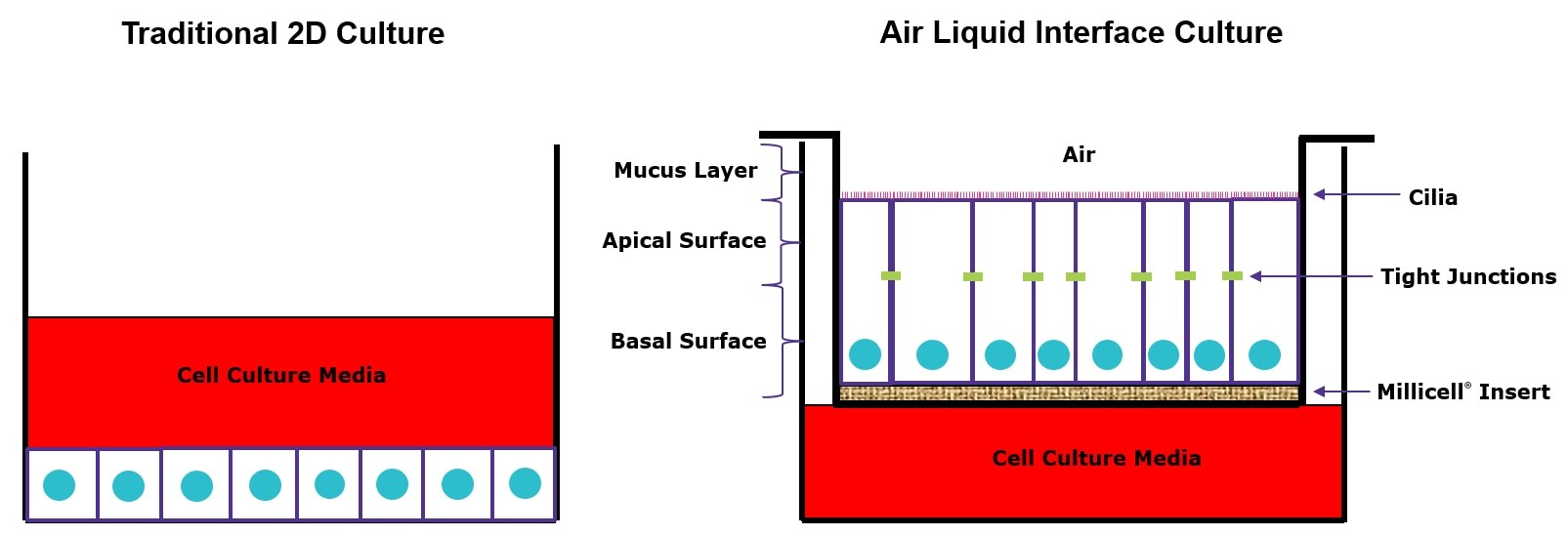 图 1. 在传统2D(左)与3D气液界面(ALI)(右)中培养的气道上皮细胞。
图 1. 在传统2D(左)与3D气液界面(ALI)(右)中培养的气道上皮细胞。气液界面细胞培养方案
- 用ECM 混合物涂抹组织培养瓶:
-
-
-
- 纤连蛋白 (FN) (10 μg/mL, F2006)
- 胶原蛋白(30 μg/mL, 5006)
- BSA (100 μg/mL 126575)
-
-
-
- 将16HBE14o- 细胞接种以105个细胞/cm2的密度接种到 Millicellx 细胞培养小室 (MCHT12H48)中,将细胞浸入上述步骤 1中列出的 1-2mL 扩增培养基中。将细胞在37°C的培养箱中培养24 小时。
- 开始气液界面培养,将培养小室/细胞转移到新的深 12 孔板 (Greiner Bio-One ThinCert板)中。可以去除小室中的整个培养基,使细胞暴露在空气中。每2天更换一次小室背面外侧的培养基。
- 在第8天或之后,可以使用常见的基于细胞的测定或抗体染色来分析细胞。

图2 . 人支气管上皮细胞人支气管上皮细胞的ALI培养。人支气管上皮细胞细胞在气-液界面( ALI ) (红蓝色)培养时呈现极性(蓝色)、细胞内紧密连接ZO-1 ( 红色 , AB2272 )和顶端CFTR表达( 绿色 , MAB3484 ),具有上皮屏障功能。
研究代表性文献:
囊性纤维化细胞模型和 CFTR 功能
囊性纤维化是一种遗传性疾病,影响包括肺和消化系统等多个器官系统。这种疾病的特征是黏液分泌腺体异常,导致分泌物扰乱气道,粘稠的黏液堵塞肺部,可能导致死亡。囊性纤维化跨膜电导调节蛋白 (CFTR)有助于维持体内包括肺表面的盐水平衡。CFTR 基因的突变或缺失可导致囊性纤维化。
16HBE14o- 细胞系 (SCC150) 是一种野生型气道上皮细胞系,可表达高水平的 CFTR mRNA 和蛋白质。亲本 CFBE41o- 细胞系 (SCC151) 源自 CF 患者的 ΔF508 CFTR 突变纯合子。已创建该系的后续克隆,并校正了 ΔF508 CFTR 突变 (SCC158-SCC161)。
相关文献:
Andersson C, Al-Turkmani MR, Savaille JE, Alturkmani R, Katrangi W, et al. 2008. Cell culture models demonstrate that CFTR dysfunction leads to defective fatty acid composition and metabolism. J Lipid Res. 49(8):1692-700
Muir A, Soong G, Sokol S, Reddy B, Gomez MI, et al. 2004. Toll-like receptors in normal and cystic fibrosis airway epithelial cells. Am J Respir Cell Mol Biol. 30(6):777-83.
Luciani A, Villella VR, Esposito S, Brunetti-Pierri N, Medina D, et al. 2010. Defective CFTR induces aggresome formation and lung inflammation in cystic fibrosis through ROS-mediated autophagy inhibition. Nat Cell Biol. 12(9):863-75.
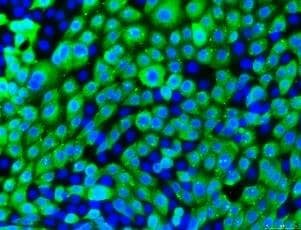
细胞角蛋白18
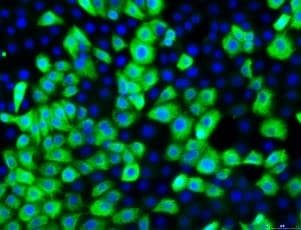
泛细胞角蛋白
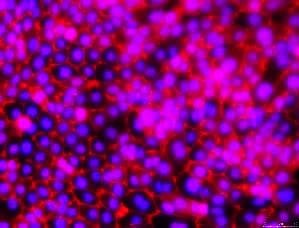
ZO-1紧密连接
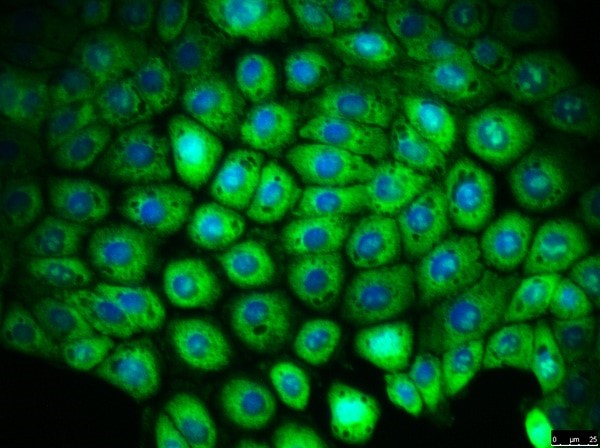
CFTR (WT)
图3.16HBE14o细胞系的抗体鉴定。从左至右:16HBE14o-细胞表达肺上皮关键标志物细胞角蛋白18,泛细胞角蛋白(绿色,MAB3412), TJ蛋白ZO-1证实形成紧密连接(红色,AB2272),并表达野生型CFTR(绿色,MAB3484)。
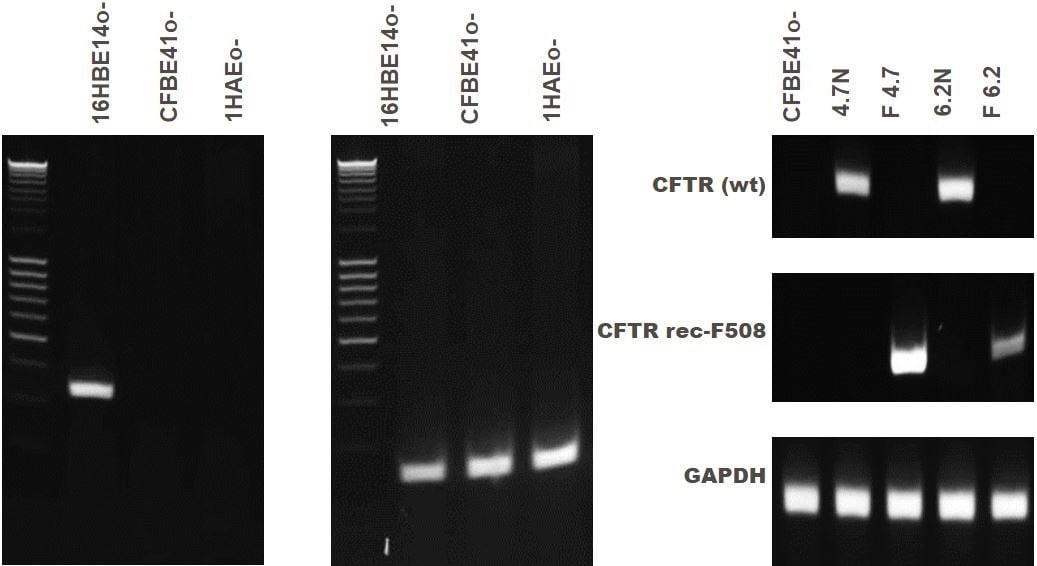
图 4. 支气管上皮细胞系的 CFTR 基因表达。16HBE14o- 细胞表达野生型 CFTR,而 CFBE41o- 和 1HAEo- 缺乏 CFTR 基因表达。 CFBE41o-细胞系来自不表达野生型 CFTR 的囊性纤维化患者。已产生了四个克隆,并纠正了突变(4.7N、delta F4.7、6.2N 和 delta F6.2)。
呼吸道病毒疾病机制(H1N1、SARS-COV、COVID-19)
支气管上皮细胞构成沿着进入肺部的主要通道的功能屏障,构成抵御呼吸道病原体(包括流感 H1N1、SARS-CoV、MERS-CoV、RSV 和 COVID-19)的关键防线。 16HBE14o- 细胞系已用于研究和表征多种病毒感染机制,以支持疫苗和药物开发的研究。例如,16HBE14o-细胞表达血管紧张素转换酶 2 (ACE2) 和丝氨酸蛋白酶 TMPRSS2,它们在 SARS-CoV 感染和病毒复制中起重要作用。相关文献:
Kam YW, Okumura Y, Kido H, Ng LF, Bruzzone R, Altmeyer R. 2009. Cleavage of the SARS coronavirus spike glycoprotein by airway proteases enhances virus entry into human bronchial epithelial cells in vitro. PLoS One. 4(11):e7870.2
Wu XL, Ju DH, Chen J, Yu B, Liu KL, He JX, et al. 2003. Immunologic mechanism of Patchouli alcohol anti-H1N1 influenza virus may through regulation of the RLH signal pathway in vitro. Curr Microbiol. 67(4):431-6.
Qin L, Peng D, Hu C, Xiang Y, Zhou Y, et al. 2014. Differentiation of Th subsets inhibited by nonstructural proteins of respiratory syncytial virus is mediated by ubiquitination. PLoS One. 9(7):e101469.

ACE2 DAPI

TMPRSS2 DAPI
图5. 16HBE细胞表达ACE-2和TMPRSS2。从左至右:用气液界面(ALI)技术培养的16HBE14o-细胞8天显示血管紧张素转换酶2 (ACE2)和丝氨酸蛋白酶TMPRSS2的表达,它们在新冠病毒(SARS-CoV, COVID-19)感染和病毒复制中发挥重要作用。
用于哮喘和慢性阻塞性肺病研究的细胞模型
支气管哮喘和慢性阻塞性肺疾病 (COPD) 是阻塞性肺疾病,其特征是潜在的气道炎症,可导致呼吸困难、黏液过多和肺损伤。 16HBE14o- 细胞系已用于细胞模型,以研究炎症细胞募集、激活及研究哮喘和 COPD 肺病的基本机制。相关文献:
Hackett TL, de Bruin HG, Shaheen F, van den Berge M, van Oosterhout AJ, et al. 2013. Caveolin-1 controls airway epithelial barrier function. Implications for asthma. Am J Respir Cell Mol Biol. 49(4):662-71.
Leino MS, Loxham M, Blume C, Swindle EJ, Jayasekera NP, et al. 2013. Barrier disrupting effects of Alternaria alternata extract on bronchial epithelium from asthmatic donors. PLoS One. 8(8):e71278.
Pace E, Ferraro M, Minervini MI, Vitulo P, Pipitone L, et al. 2012. Beta defensin-2 is reduced in central but not in distal airways of smoker COPD patients. PLoS One. 7(3):e33601.
暴露于空气污染
汽车尾气排放和燃烧液化石油气中的臭氧 (O3)、苯和二氧化氮 (NO2) 等有毒空气污染物在过敏性气道疾病和肺癌的发展中起着重要作用。 16HBE14o-细胞系已作为细胞模型,以研究空气污染对人体支气管黏膜的破坏性影响。相关文献:
Jiang CL, He SW, Zhang YD, Duan HX, Huang T, et al. 2017. Air pollution and DNA methylation alterations in lung cancer: A systematic and comparative study. Oncotarget. 8(1):1369-1391
Zhou Z, Liu Y, Duan F, Qin M, Wu F, et al. 2015. Transcriptomic Analyses of the Biological Effects of Airborne PM2.5 Exposure on Human Bronchial Epithelial Cells. PLoS One. 10(9):e0138267.
Marano F, Boland S, Bonvallot V, Baulig A, Baeza-Squiban A. 2002. Human airway epithelial cells in culture for studying the molecular mechanisms of the inflammatory response triggered by diesel exhaust particles. Cell Biol Toxicol. 18(5):315-20.
吸烟和电子烟对肺功能的影响
吸烟传统香烟和电子烟(蒸汽烟草)的损害已被证明会增加上皮炎症和损伤的实例,并破坏气道上皮的宿主防御功能。此外,吸烟可损害气道上皮屏障功能,有助于肺癌的发生。16HBE14o-细胞系已被用于细胞模型研究吸烟和电子烟对人气道上皮细胞的损伤作用。相关文献:
Heijink IH, Brandenburg SM, Postma DS, van Oosterhout AJ. 2012. Cigarette smoke impairs airway epithelial barrier function and cell-cell contact recovery. Eur Respir J. 39(2):419-28.
Hodge S, Hodge G, Ahern J, Jersmann H, Holmes M, et al. 2007. Smoking alters alveolar macrophage recognition and phagocytic ability: implications in chronic obstructive pulmonary disease. Am J Respir Cell Mol Biol. (6):748-55.
Gerloff J, Sundar IK, Freter R, Sekera ER2, Friedman AE. 2017. Inflammatory response and barrier dysfunction by different e-cigarette flavoring chemicals identified by gas chromatography-mass spectrometry in e-liquids and e-vapors on human lung epithelial cells and fibroblasts. Appl In Vitro Toxicol. 3(1):28-40.