在无血清细胞培养条件下将人 iPS 细胞体外分化为结肠类器官
默克生命科学
Kevin Su , Nick Asbrock , Vic Chu, Ph.D. , Stefanie Hoffmann, M.S. , Philip Hewitt, Ph.D
类器官是一种复杂的自组织 3D 细胞培养模型,通常源自于干细胞。1类器官已报道可由多种组织产生,包括脑、2 肠、3 胃、4 结肠、5 肝脏、6 胰腺、6 肺、7 肾脏 8 和患者来源的肿瘤。9 上皮肠类器官,通常称为肠样或小肠,可维持胃肠系统的生理特征,并且已成为模拟肠道发育和疾病(包括结肠癌、乳糜泻、炎症性肠病和宿主微生物组相互作用)的一种有用细胞培养工具。10 Clevers等人1开发的传统分离技术依赖于耗时的原发组织分离,其中包括从小鼠或难以获取的人体组织样本中进行分离。诱导多能干细胞衍生的类器官将能够从更广泛的人类供体中快速生成患者特异性细胞模型。目前,我们已经生成了一个人 iPSC 衍生的结肠类器官系统,该系统包含高度表征、可直接进行分析的冻存人类结肠类器官以及扩增培养基。此外,我们优化的无血清培养基和试剂可用于通过简单的三步分化过程从任何人 iPS 细胞系中分化结肠类器官。
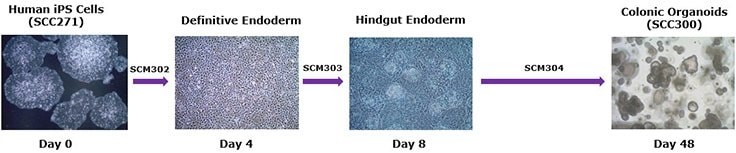
SCM302:定形内胚层诱导培养基,SCM303:后肠诱导培养基,SCM304:3dGRO™ 人结肠类器官扩增培养基
类器官培养方案
步骤1:人 iPS 细胞分化为定形内胚层(第 0-4 天)
注意:起始材料为高品质未分化的人 ES/iPS 细胞(SCC271)(细胞融合度约为 70-80%,且含有 <5% 的分化细胞)。以下方案用于分化六孔组织培养处理孔板中的单孔。文中所指的体积均为针对单孔体积。请根据需要调整体积。- 准备单细胞传代培养基。将 ROCK 抑制剂 (ROCKi) Y-27632(SCM075)添加到 7-10 mL 人 ES/iPS 扩增培养基(SCM130)中,终浓度为 10 μM。
- 用 为干细胞优化的ECM GEL(CC131-5ML)涂覆 6 孔板。
- 吸出培养基。用 2 mL 的 DMEM/F12 或 1X PBS 清洗孔壁。吸出并加入 1 mL Accumax™ (A7089)并将其添加至孔中。在 37̣ °C 下孵育 5-6 分钟。用手掌拍打孔板,以帮助解离结块细胞。
- 向孔中加入 1 mL 单细胞传代培养基(同步骤 1)。用 5 mL 移液管上下吹打 1-3 次,以解离细胞。小心不要引入任何气泡。
- 将解离的细胞收集在 15 mL 锥形管中。将 1 mL 单细胞传代培养基添加至孔中,收集剩余残留的细胞,并转移至含有细胞悬液的 15 mL 锥形管中。以 140 x g 离心5 分钟并吸出上清液。
- 将细胞沉淀重悬于 1 mL 单细胞传代培养基中。使用台盼蓝(T8154)和血细胞计数板计算活细胞总数。
- 将每孔 1x106 个细胞加入 ECM Gel (CC131-5ML)涂覆的 6 孔板中。使用的培养基为单细胞传代培养基(同步骤 1 ); 总体积 = 每孔 3 mL。37°C孵育过夜。
- 从孔中吸出培养基。将 2 mL 的定形内胚层诱导培养基(SCM302)添加至孔中,并37°C孵育过夜。
- 在第 2 天和第 3 天重复第 8 步。在第 4 天通过流式细胞术分析细胞。在进行接下来步骤2之前,细胞的内胚层标志物 CXCR4、c-Kit、Sox-17 和 FOXA2 的阳性率应 >85%,PDGFR 为阴性。
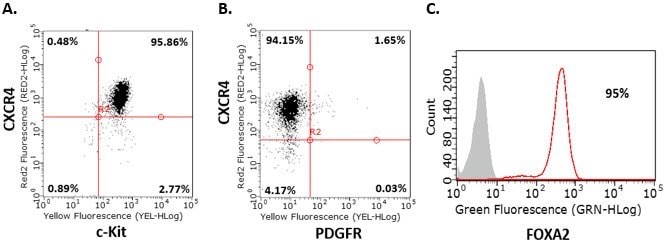
图 2. 人iPS细胞的内胚层分化。对人iPSC分化的定形内胚层细胞的内胚层标志物进行流式细胞分析表明,分化四天后,细胞为CXCR4+、c-Kit+、Sox-17+、PDGFR-和FOXA2+。
步骤2:后肠内胚层分化(第 4-8 天)
- 从培养箱中取出含有第 4 天定形内胚层培养物的 6 孔板。
- 从每个孔中吸出培养基。
- 用 3 mL 1X PBS 清洗每个孔。
- 在每个孔中加入 2 mL 预热的后肠诱导培养基(SCM303)。
- 立即将板转移到 37 °C ,5% CO2培养箱中 孵育24 小时。
- 重复步骤 2-5,共 5 天。
- 后肠内胚层分化的第5天是确定 CDX2 表达的关键时间点。CDX2 的表达必须 >60% 才能进行步骤 3。如果 CDX2 的表达低于 60%,则再进行一天HE分化并重新检查 CDX2 的表达。
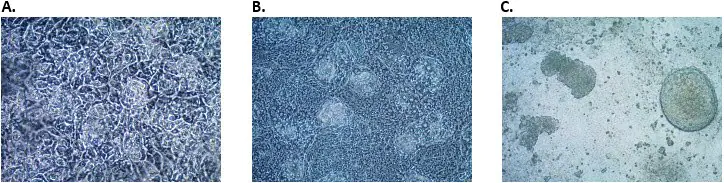
图 3. 定形内胚层细胞分化为后肠内胚层细胞。后肠内胚层诱导后A) 第2 天 B) 第 3 天和 C) 第 4 天后肠内胚层细胞的形态。
步骤3:结肠类器官的扩增和冷冻保存(第 8-48 天)
结肠类器官的扩增- 从培养箱中取出含有第 8 天后肠内胚层培养物的 6 孔板。
- 从每个孔中吸出培养基。
- 用 3 mL 1X PBS 清洗每个孔。
- 将 2 mL 预热的 3dGRO™ 人类结肠类器官扩增培养基(SCM304)添加到每个孔中。
- 立即将板转移到 37 °C ,5% CO2 培养箱中培养 48 小时。
- 每 2 天用 3dGRO™ 人结肠类器官扩增培养基 (SCM304) 更换培养基,直到分化第 12 天。
注:结肠球状体将在第 12 天结束时形成,使用 3dGRO™ 人类结肠类器官扩增培养基(SCM304),其将嵌入ECM 基质胶中以生成成熟的结肠类器官。 - 将终浓度为 10 µM 的 ROCKi Y-27632 (SCM075)添加到人结肠类器官扩增培养基(SCM304)中。
- 4 °C过夜或在冰上解冻足量的减生长因子的ECM基质胶(E6909)。
- 在结肠上皮细胞分化的第 12 天,从培养箱中取出细胞并将漂浮在培养基中的球状体收集到 15 mL 锥形管中。
- 用 3 mL 1X PBS 清洗每个孔。
- 用 1 mL Accumax (A7089) 解离含有球状体(非悬浮球状体)的单层细胞,并37 °C孵育 5-10 分钟。
- 解离单层后,用 P-1000 移液器轻轻移取细胞 4-5 次,然后将 1 mL 细胞悬液转移到上述步骤 9 中制备的锥形管中。
- 4 °C下265 x g离心5分钟。
- 吸出上清液并用 4 mL 1X PBS 洗涤一次。
- 4 °C下265 x g离心5分钟并吸出上清液。
- 轻弹锥形管的底部,使沉淀物脱落。
- 将 ECM基质胶置于 TC 操作台中,快速取出 1 mL 并将其添加到步骤 16 中脱落的细胞沉淀中。
- 用设置为 900 µL 的 P-1000 移液管在 ECM 基质胶中轻轻重悬细胞沉淀。 避免在在悬浮过程中引入气泡。
- 立即将细胞悬液置于冰上 5 分钟以防止凝胶化。
- 以1:50-1:100 将 1 mL ECM基质胶/细胞悬液混合在新鲜的 ECM 基质胶中,并在 24 孔板的每个孔中接种 50 µL/孔(例如:对于 1:100 稀释, 将步骤 18 中的 10 µL 基质/细胞悬液与 40 µL 新鲜基质混合。接种 50 µL/孔)。 见下图 4。
- 立即将 24 孔板37 °C孵育10分钟。
- 待液滴凝胶化后,加入 1 mL 3dGRO™ 人结肠类器官扩增培养基 (SCM304) + 10 µM ROCKi (SCM075)。
- 可以每两天使用 1 mL 新鲜的 3dGRO™ 人结肠类器官扩增培养基 (SCM304)) 更换培养基。
- 可每 10-12 天以 1:3 至 1:4的比例,使用 3dGRO™ 类器官解离试剂 (SCM300)对类器官进行传代。

图 4. 人结肠类器官。A) 解冻后两天,结肠类器官封装在基质胶穹顶胶滴中。 B) 培养至第 10-12 天,结肠类器官占据 85-90% 的胶滴穹顶,并进行传代。
结肠类器官的冷冻保存
人结肠类器官可以使用 3dGRO™ 类器官冻存培养基(SCM301)进行冷冻保存。 该实验方案针对传代过程中不使用任何解离试剂的人结肠类器官进行冷冻保存。 建议胶滴的起始数量为每管四个(假设每个胶滴的密度为 90%)。如果密度低于 90%,则每管可冷冻更多胶滴。- 当类器官准备好传代进行冷冻保存时,将板从培养箱中取出。
- 用 P-1000 移液器上下吹打 5 次,将每个 ECM 基质胶胶滴重悬在其现有的 1 mL 培养基中。
- 将类器官悬液转移至锥形管中。
- 用 10 mL 移液器沿锥形管壁侧吹打 10 次,继续分散类器官。
- 以 265 x g 至 700 x g 离心锥形管。
- 吸出上清液并用 1 mL 1X PBS 重悬沉淀。
- 继续用 P-1000 移液器上下吹打 20 次以分散类器官沉淀团。
- 向类器官悬浮液中加入 5 mL 1X PBS,并在 4 °C 下以 700 x g 离心 5 分钟。如果上清液中存在残留的类器官碎片,则再离心 5 分钟。
- 吸出上清液并用 1 mL 3dGRO™ 类器官冷冻培养基 (SCM301) 重悬沉淀。
- 用 P-1000 移液器重悬沉淀 5 次,加入冷冻培养基以获得四个胶滴每毫升每管
- 将冷冻保存管中的细胞转移到冷冻容器(例如 Mr. Frosty)中,然后放入 -80 °C 冰箱中 24-72 小时。
- 将冷冻保存的人结肠类器官转移至液氮罐中长期储存。
结果
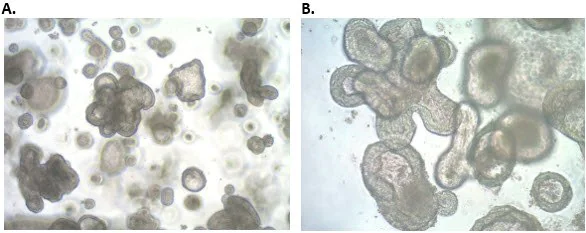
图 5. 人 iPS 细胞衍生的结肠类器官的形态。成熟的人结肠类器官在三维培养时具有复杂的形态。A) 4X放大倍数 B) 10X 放大倍数。
人结肠类器官表征

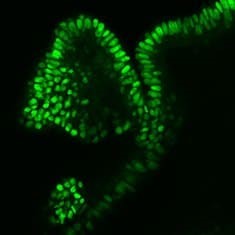
CDX2
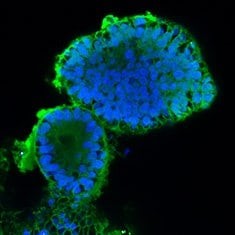
CA-II/DAPI
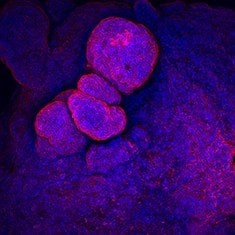
CA-IV/DAPI
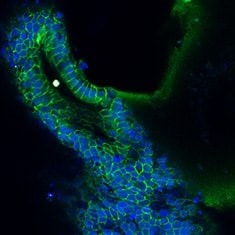
粘蛋白5B/DAPI
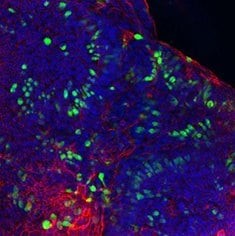
粘蛋白2/ F-肌动蛋白/DAPI
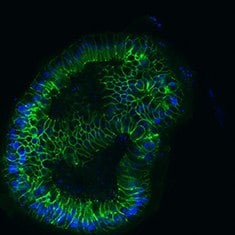
E-钙粘蛋白/DAPI
图 6. 人结肠类器官的免疫细胞化学 (ICC) 表征。人 iPS 细胞衍生的结肠类器官对 CDX2、α-碳酸酐酶-II、α-碳酸酐酶-IV、粘蛋白 5B、粘蛋白 2 和 E-钙粘蛋白呈阳性。
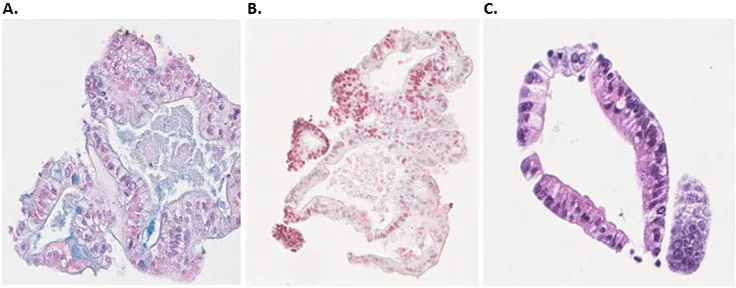
图 7. 人结肠类器官的免疫组化 (IHC) 表征。A) 用阿尔新蓝染色鉴定的杯状细胞 B) 用 Ki67 抗体(红色)鉴定的增殖细胞 C) 用 H&E 染色鉴定的细胞核和血浆蛋白。
结论
我们开发了一个强大的三步分化方案,以从人类诱导的多能干细胞 (iPSC) 中分化出人结肠类器官。使用该实验方案生成的结肠类器官能够表达成熟的结肠标志物 CDX2、α-碳酸酐酶-II、α-碳酸酐酶-IV、粘蛋白 5B、粘蛋白 2 和 E-钙粘蛋白,并且可以连续传代多次而不会丢失结肠表型。这些类器官和无血清培养基将为研究人员和药物发现提供经过高度验证的全新 3D 细胞模型,以帮助用于研究肠道疾病。实验方案--使用抗体对包埋类器官进行免疫荧光染色
类器官具有复杂的三维结构,并且嵌入在ECM水凝胶中使表征变得困难。使用抗体对类器官进行免疫荧光(IF)染色,可以观察细胞行为、增殖、分化、细胞健康和识别的分子标记物。包埋免疫染色适用于小块组织,无需切片,方法与冷冻切片的免疫细胞化学(ICC)或免疫组化(IHC)染色非常相似。类器官包埋染色可用于基于抗体的鉴定。在该类器官染色方案中,我们详细介绍了通过免疫荧光共聚焦显微镜分析固定、渗透和染色包埋类器官的方法。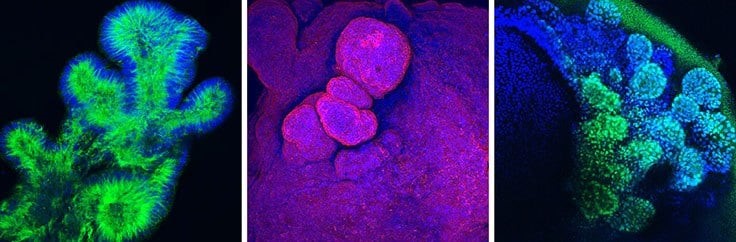
图1。使用抗体的类器官免疫荧光检测。使用乙酰-α-微管蛋白(A)、α-碳酸酐酶IV (B)和Sox-9 (AB5535) (C)抗体染色的人上皮肠类器官和肺类器官。
类器官染色方案
- 从类器官培养中移除培养基,用1X PBS (D8537)轻轻清洗2遍。
- 用15-20 mL 4% PFA (1.00496)在10厘米的培养皿中固定30-40个类器官ECM基质胶胶滴穹顶结构,室温下放置30-60分钟。
- 不时地旋转培养皿,分离ECM基质胶胶滴,从ECM基质胶中释放类器官。
- 将15-20 mL的固定液从10厘米的培养皿中倒入到50 mL锥形管中,让类器官凭借重力沉降在管底部(~10-15分钟)。
- 当类器官凭重力沉降在50 mL锥形管底部后,小心地抽吸固定液,尽量避免在过程中抽吸类器官沉淀。
- 在第4步的培养皿中加入15-20 mL 1X PBS (D8537),在室温下静置15-20分钟。
- 15-20分钟后,旋转培养皿以进一步分离ECM基质胶胶滴穹顶结构,并将1X PBS (D8537)倒入第5步中含有类器官沉淀的50mL锥形管中。
- 将步骤5-7再重复三次。
- 在不伤害类器官沉淀的情况下吸出溶液,沿着含有类器官沉淀的50 mL锥形管的一侧慢慢加入5 mL 1X PBS (D8537),并旋转试管使类器官团块重悬。
- 将5 mL含有类器官团块的1X PBS (D8537)直接倒入含有未分离类器官ECM 基质胶胶滴结构的10 cm培养皿中。
- 将另一份5 mL 1X PBS (D8537)加入到50 mL锥形管中,采集尽可能多的类器官块,并直接将其倒入含类器官的10厘米培养皿中。
- 如果不立即使用,用封口膜封住10厘米培养皿,并在4℃冰箱中保存不超过1个月。
- 准备好进行免疫荧光染色时,从冰箱取出含固定类器官的10厘米培养皿,并在解剖显微镜下观察。
- 剪去1 mL移液管的尖端,使移液管尖端足以通过类器官,而不会有剪切效应或被破坏。
- 将类器官(1-4)转移到8孔腔载玻片中,用P-200移液管去除残留的1X PBS (D8537)。避免通过未剪去尖端的P-200移液管吸入类器官。
- 用0.5 mL Blocking Buffer(5%马血清+ 0.5% Triton X-100,溶于1X PBS中)在4℃留置一夜或室温下留置2-4小时,渗透固定类器官。注:推荐使用与二抗宿主同物种的血清。
- 用P-200移液管从含类器官的载玻片上移除Blocking Buffer。避免P-200移液管头吸入类器官。
- 在Blocking Buffer中制备一抗(300-500 µL)或制备直接偶联的抗体(300-500 µL)。
- 将稀释后的抗体加入含类器官的适当标记的孔中。
- 在4 °C下孵育一夜。
- 第二天,用1X PBS (D8537)清洗3次,每次10-15分钟。注:如果使用直接偶联抗体,样品便可在共聚焦显微镜上成像。
- 如果使用未偶联的一抗,在Blocking Buffer中制备二抗(300-500 µL),并将二抗添加到相应标记的样品中。
- 在4℃下用二抗染色一夜。
- 第二天,用1X PBS (D8537)清洗3次,每次10-15分钟。
- 用P-200移液管从每个含类器官的孔中移除Blocking Buffer。避免P-200移液管头吸入类器官。
- 通过添加5 µg/mL DAPI (D9542) 在1X PBS(每份样品300-500 µL)中准备核染色。
- 为每个样品添加DAPI染色液,在室温下孵育15-20分钟。
- 用1X PBS (D8537)清洗3次,每次10-15分钟。
材料

References
1.Sato T, Stange DE, Ferrante M, Vries RG, van Es JH, van den Brink S, van Houdt WJ, Pronk A, van Gorp J, Siersema PD, et al. 2011. Long-term Expansion of Epithelial Organoids From Human Colon, Adenoma, Adenocarcinoma, and Barrett's Epithelium. Gastroenterology. 141(5):1762-1772. http://dx.doi.org/10.1053/j.gastro.2011.07.0502.Lancaster MA, Renner M, Martin C, Wenzel D, Bicknell LS, Hurles ME, Homfray T, Penninger JM, Jackson AP, Knoblich JA. 2013. Cerebral organoids model human brain development and microcephaly. Nature. 501(7467):373-379. http://dx.doi.org/10.1038/nature12517
3.Schwank G, Koo B, Sasselli V, Dekkers J, Heo I, Demircan T, Sasaki N, Boymans S, Cuppen E, van der Ent C, et al. 2013. Functional Repair of CFTR by CRISPR/Cas9 in Intestinal Stem Cell Organoids of Cystic Fibrosis Patients. Cell Stem Cell. 13(6):653-658. http://dx.doi.org/10.1016/j.stem.2013.11.002
4.Bartfeld S, Bayram T, van de Wetering M, Huch M, Begthel H, Kujala P, Vries R, Peters PJ, Clevers H. 2015. In Vitro Expansion of Human Gastric Epithelial Stem Cells and Their Responses to Bacterial Infection. Gastroenterology. 148(1):126-136.e6. http://dx.doi.org/10.1053/j.gastro.2014.09.042
5.Crespo M, Vilar E, Tsai S, Chang K, Amin S, Srinivasan T, Zhang T, Pipalia NH, Chen HJ, Witherspoon M, et al. 2017. Colonic organoids derived from human induced pluripotent stem cells for modeling colorectal cancer and drug testing. Nat Med. 23(7):878-884. http://dx.doi.org/10.1038/nm.4355
6.Broutier L, Andersson-Rolf A, Hindley CJ, Boj SF, Clevers H, Koo B, Huch M. 2016. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nat Protoc. 11(9):1724-1743. http://dx.doi.org/10.1038/nprot.2016.097
7.Miller AJ, Dye BR, Ferrer-Torres D, Hill DR, Overeem AW, Shea LD, Spence JR. 2019. Generation of lung organoids from human pluripotent stem cells in vitro. Nat Protoc. 14(2):518-540. http://dx.doi.org/10.1038/s41596-018-0104-8
8.Takasato M, Er PX, Chiu HS, Maier B, Baillie GJ, Ferguson C, Parton RG, Wolvetang EJ, Roost MS, Chuva de Sousa Lopes SM, et al. 2015. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526(7574):564-568. http://dx.doi.org/10.1038/nature15695
9.van de Wetering M, Francies H, Francis J, Bounova G, Iorio F, Pronk A, van Houdt W, van Gorp J, Taylor-Weiner A, Kester L, et al. 2015. Prospective Derivation of a Living Organoid Biobank of Colorectal Cancer Patients. Cell. 161(4):933-945. http://dx.doi.org/10.1016/j.cell.2015.03.053
10.Bartfeld S. 2016. Modeling infectious diseases and host-microbe interactions in gastrointestinal organoids. Developmental Biology. 420(2):262-270. http://dx.doi.org/10.1016/j.ydbio.2016.09.014








