人 iPS 细胞体外分化为气道上皮肺类器官用于呼吸系统疾病研究应用以及iPSC操作指南
默克生命科学
2783
Min Lu , Kevin Su , Nick Asbrock , Vi Chu
肺类器官是常用的三维(3D)细胞培养模型,用于研究人类肺部发育和呼吸道疾病,包括病毒感染(SARS-CoV、H1N1、MERS)、囊性纤维化、哮喘/COPD、空气污染暴露和吸烟的影响。与传统的永生化肺细胞系和原代细胞不同,肺类器官包含各种分化的细胞类型,具有复杂的组织结构,更接近于体内组织和功能。 此外,肺类器官可以从少量患者组织或多能干细胞中提取,以创建有助于个性化生物医学研究的活体生物库。
3dGRO™ 人肺类器官培养系统是一种无血清、多阶段培养系统,常用于将人诱导多能干细胞(iPS)有效分化为结构类似于体内分支气道和早期肺泡结构的成熟肺类器官。 使用 3dGRO™ 人肺类器官培养系统,可以生成大量成熟的肺类器官,这些类器官表达适当的标志物,标志着成熟肺和气道中发现的多种细胞类型,包括在中发现的 SFTPB 和 SFTPC(表面活性物质相关蛋白B 和表面活性物质相关蛋白C) II 型肺泡上皮 (ATII) 细胞、MUC5AC(气道杯状细胞)、EpCAM、Sox9 和 Nkx2.1(肺内胚层)、乙酰-α-微管蛋白(纤毛细胞)和间充质标记波形纤维蛋白。
此外,肺类器官还表达血管紧张素转换酶 2 (ACE2),它是导致 COVID-19 的新型 SARS-CoV-2 病毒的受体,以及 TMPRSS2,一种协助SARS-CoV-2 病毒入侵的丝氨酸蛋白酶。

图 1. 人肺类器官分化实验流程。
使用诱导培养基(SCM302)在4天内将人多能干细胞分化成定型内胚层细胞。 在第4-8天,诱导培养基 (SCM305、SCM306) 将人定型内胚层细胞分化为前肠内胚层 (AFE)。 AFE细胞可以冷冻保存 (商业化产品货号SCC301) 或使用 3dGRO™ 肺类器官分支培养基 (SCM307) 进一步分化成分支肺芽型类器官,并使用 3dGRO™ 肺类器官成熟培养基 (SCM308) 进一步成熟为分支型和肺泡型类器官。
肺类器官分化方案
第 1 步:人 iPS 细胞分化为定型内胚层(第 0-4 天)
注意:从高品质未分化的人 ES/iPS 细胞 (SCC271) 开始,这些细胞汇合度约为 70-80%,且含有 <5% 的分化细胞。以下方案用于六孔组织培养处理板中的一孔。 指示的体积针对单孔。请根据需要调整用量。
1. 准备单细胞传代培养基。 将 ROCK 抑制剂 (ROCKi) Y-27632 (SCM075) 添加到 7-10 mL 人 ES/iPS 细胞扩增培养基 (SCM130) 中,最终浓度为 10μM。
2. 用 ECM 凝胶 (CC131) 涂层 6 孔板。
3. 吸出培养基。用 2 mL 的 DMEM/F12 或 1X PBS 清洗孔。吸出 1 mL Accumax™ 溶液 (A7089) 并将其添加到孔中。在 37°C下孵育 5-6 分钟。手掌敲击板,以帮助解离细胞。
4. 向孔中加入 1 mL 单细胞传代培养基(来自步骤 1)。用 5 mL 移液器上下吹打 1-3 次以分离细胞。小心不要吸入任何气泡。
5. 将解离的细胞收集在 15 mL 锥形管中。将 1 mL 的单细胞传代培养基添加到孔中,并将收集的所有剩余细胞转移到含有细胞悬液的 15 mL 锥形管中。140 x g 离心试管5分钟并吸出上清液。
6. 将细胞沉淀重悬于 1 mL 单细胞传代培养基中。使用自动细胞计数器或Trypan blue (T8154) 和血细胞计数器计算活细胞总数。
7. 将每孔 1x106个细胞加入ECM Gel (CC131) 涂布后的6孔板中。使用单细胞传代培养基(来自步骤 1 )。总体积=每孔3 mL。在 37°C下孵育过夜。
8. 从孔中吸出培养基。将2 mL的定型内胚层诱导培养基 (SCM302) 添加到孔中,并在 37°C 下孵育过夜。
9. 在第 2 天和第 3 天重复第 8 步。在第 4 天通过流式细胞术分析细胞。在进行第 2 步之前,细胞的内胚层标志物 CXCR4、c-Kit、Sox-17 和 FOXA2 的阳性率应 >80% , PDGFR 应为阴性。
第 2 步:DE 细胞分化为前肠内胚层细胞(第 4-8 天)
注意:在定型内胚层细胞的第 4 天和分化为前肠内胚层 (AFE) 细胞后的第 8 天,应观察到较高细胞密度。下面的方案提供了 6 孔板型的参考接种密度。其他板型的接种密度需做调整
1. 从培养箱中取出含第4天定型内胚层培养物的6孔板。
2. 从每个孔中吸出培养基。用2ml 1X PBS (BSS-1006-B)洗净每孔。
3. 每孔加入1ml Accumax™溶液(A7089),分离定型内胚层细胞。37°C孵育6-8分钟。
4. 5分钟后,目测检查培养板。轻轻敲击培养板的边缘,使细胞进一步分离。大多数细胞应该分离开并悬浮于液体中。如果不是,再孵育2分钟。
5. 每孔加入2ml 1X PBS (BSS-1006-B)稀释AccuMax™溶液(A7089)。将细胞悬浮液置于50ml锥形管中。用1ml 1X PBS冲洗每孔,收集任何剩余的细胞,并加入到50ml锥形管中。移液器上下吹打几次以实现单细胞悬浮状态。
6. 室温下,细胞悬液130 x g离心5分钟。
7. 吸出上清液。 在 2 mL 的 AFE 诱导培养基 I (SCM305) 中重新悬浮细胞沉淀。 使用自动细胞计数器或血细胞计数器对细胞进行计数。 在 PBS 中配制4μg/mL的纤连蛋白 (F0895)涂布在6孔板上。 每个孔加入 1.5 mL 稀释的纤连蛋白。将涂有涂层的培养板放置在2-8°C下过夜。 吸出涂层溶液。 打开盖子,在超净台中风干 5 分钟。 当板干燥后,将板盖好盖子待用,直到细胞准备好。
8. 将1X106 个细胞铺板到纤连蛋白包被的 6 孔板的每个孔内。将适当体积的 AFE 诱导培养基I (SCM305) 添加到每个孔中,以达到每孔 2 mL 的总体积。
9. 将培养板置于 37 °C培养箱中。轻轻晃动板,以确保细胞均匀分布在每个孔的板底。在 37°C 下孵育过夜。
10. 第 5 天:每孔更换 2 mL AFE 诱导培养基II (SCM306)。在 37 °C 下孵育 24 小时。
11. 第 6 天:用每孔 2 mL 的 3dGRO™ 肺类器官分支培养基 (SCM307) 更换培养基。在 37 °C 下孵育 24 小时。
12. 第 7 天:用每孔 2 mL 的 3dGRO™ 肺类器官分支培养基 (SCM307) 更换培养基。在 37 °C 下孵育 24 小时。
13. 第 8 天:AFE 细胞应表现出形态变化,由细胞簇/聚集体散布组成汇合区域。按照方案将进一步分化为成熟的肺类器官。多余的 AFE 细胞可以使用 3dGRO™ 类器官冷冻培养基 (SCM301) 以每管3-6 x 106 个细胞进行冷冻保存。
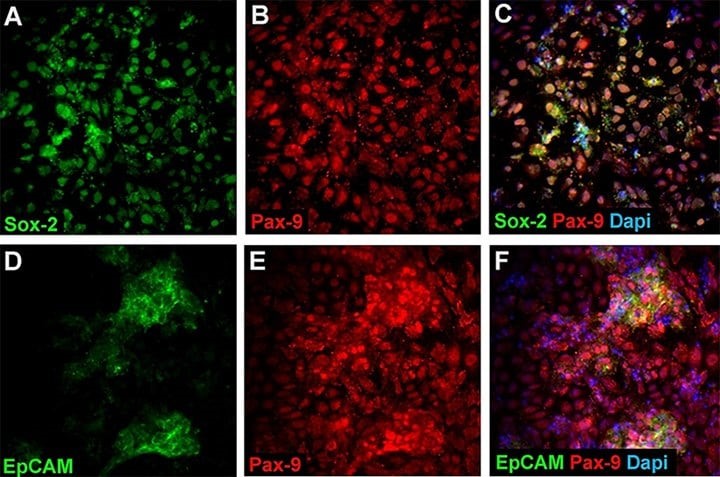
图 2. 前肠内胚层 (AFE) 标记表达。 大约 95-100% 的 AFE 细胞对 Sox2(A、C、AB5603A4)和 Pax9(B、C)呈双阳性。 大约 20-30% 的 AFE 细胞对 EpCAM(D、F、MAB4444)和 Pax9(E、F)呈双阳性。
第 3 步:将 AFE 细胞分化为肺芽类器官(第 8-25 天)
1. 将 1 mL 新鲜的 3dGRO™ 肺类器官分支培养基 (SCM307) 吸出并添加到包含 AFE 细胞汇合层的 6 孔板的每个孔中。
2. 使用 5 mL 移液器,沿每个孔的表面轻轻刮擦,将细胞单层聚集并提取。 小心不要研磨成单细胞。 将细胞聚集体从 6 孔板的 1 孔转移到 Costar® 超低附着 24 孔板 (CLS3473) 的孔中。
3. 加入 0.5 mL 3dGRO™ 肺类器官分支培养基 (SCM307) 以收集所有剩余细胞并添加到低附着 24 孔板的细胞孔中。 总体积 = ~ 1.5 mL 细胞悬浮液。 在 37°C 下孵育。
4. 每隔一天更换一次培养基,直到第 20-25 天。
由于类器官处于悬浮培养中,因此请根据方案进行培养基更换:
1. 使用 1 mL 玻璃血清移液器将漂浮的类器官转移到无菌的 15 mL 锥形管中。等待 10 分钟,使类器官沉淀到试管底部。
2. 将 2 mL 吸液管连接真空泵。在 2 mL 吸气移液器上,连接一个无菌的 20 μL 非屏障移液器枪头。小心地吸出培养基。注意在类器官上方留下少量培养基作为缓冲液,以避免干扰类器官。
3. 将 0.5 mL 3dGRO™ 肺类器官分支培养基 (SCM307) 添加到含有类器官沉淀的 15 mL 管中。用 1 mL 玻璃移液器上下吹打两次。将类器官转移回超低附着24 孔板中的同一孔中。
4. 将 0.5 mL 3dGRO™ 肺类器官分支培养基 (SCM307) 添加到 15 mL 锥形管中,冲洗并收集所有剩余的类器官。将冲洗液添加到超低附着24 孔板的同一孔中。总体积 = 每孔 1 mL。
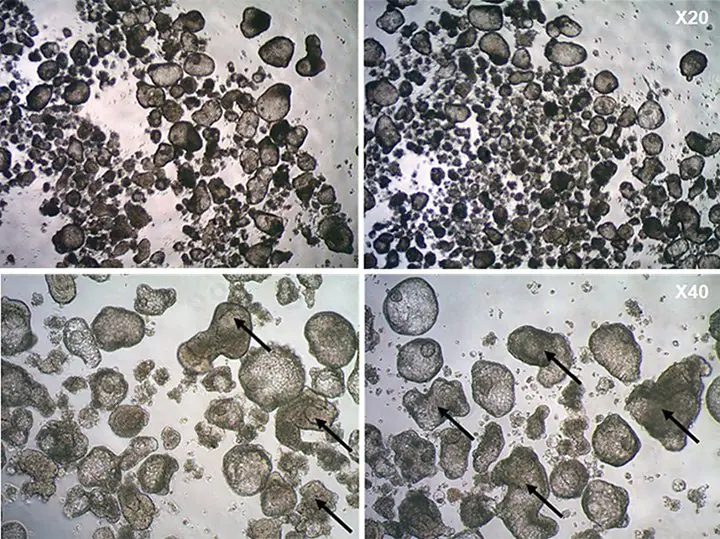
图3.悬浮培养的人肺芽类器官(LBO)。分化第23天未成熟人iPS细胞衍生LBO的形态学。
下图显示了具有折叠结构(箭头)的最佳类器官,可以选择这些类器官在使用 3dGRO™ 肺类器官成熟培养基(步骤 4)的 ECM基质胶包埋夹层培养中进一步成熟。
第 4 步:将肺芽类器官 (LBO) 分化为成熟的肺类器官(第 25-60 天)
1. 在冰上解冻降低生长因子浓度的ECM 基质胶 (E6909)。
2. 使用无菌镊子将无菌 24 孔细胞培养小室放到未经组织培养处理的 24 孔板中,每孔使用一个培养小室。
3. 将 50 µL 冷的含100% 减生长因子ECM基质胶分装到每个细胞培养小室中。 等待 5 分钟,让 ECM基质胶固化。
4. 同时,将一孔浮肺芽类器官 (LBO) 转移到 60 mm培养皿中。 在单独的 96 孔 U 型底板中,向每个孔中加入 60 µL 3dGRO™ 肺类器官成熟培养基 (SCM308)。
注意:培养至20-25 天,会有许多漂浮的肺类器官(图 3)。 每个 ECM基质胶 包埋夹层应包含大约 4-6 个类器官。根据您计划制作的 ECM基质胶包埋夹层的数量,计算96 孔板中制备类器官/ECM基质胶悬浮液所需的孔总数。
5. 在无菌解剖台中,使用体积设置为 10 µL的无菌 20 µL 移液器吸头从 60 mm 培养皿中6个较完整的类器官,并将其转移到 96 孔 U 型底板的 1 个孔中。
6. 将 96 孔板从解剖台转移到组织培养超净台中。
注意:为避免 ECM基质胶过早凝胶化,我们建议一次制备不超过 3 个细胞培养小室。
1. 将 60 µL 冷的 100%的减生长因子(GFR) ECM基质胶加入步骤 5 中的 96 孔板的每个孔中。通过移液器轻轻混合几次,避免产生任何气泡。 总体积 = 每孔130 µL。
2. 立即将类器官-GFR ECM基质胶混合物 (~130 µL) 转移到步骤 3 中制备的 24 孔板上每个细胞培养小室的中心。
3. 等待 5 分钟,让 ECM基质胶固化。
4. 重复以上步骤完成6 个包埋夹层的处理。
7. 将 75 µL 冷的 100%减生长因子(GFR) ECM基质胶添加到细胞培养小室顶部,形成 ECM基质胶夹层。将 24 孔板放入 37 °C 的培养箱中至少 30 分钟,以确保 ECM基质胶夹层已固化。如果要嵌入的夹层超过 6 个,请重复步骤 4-7。
8. 在每个培养小室顶部添加 500 µL 3dGRO™ 肺类器官成熟培养基 (SCM308),并在细胞培养小室下方的孔中加入 500 µL。
9. 每隔一天更换一次培养基。
1. 将 2 mL 吸液管连接到真空泵上。 在 2 mL 吸气移液器上,连接一个无菌的 20 μL 无滤膜的移液器枪头。 小心吸出 ECM基质胶夹层顶部和细胞培养小室下方的培养基。
2. 在每个细胞培养小室顶部和下方的孔中各加入 500 µL 3dGRO™ 肺类器官成熟培养基 (SCM308)。
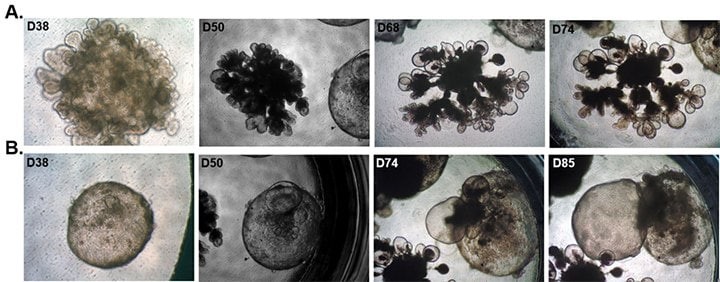
图 4. 肺类器官成熟的时间过程。 在两个单独的孔中追踪人iPS 细胞衍生的肺类器官分化。在第 20-25 天,使用 3dGRO™ 肺类器官成熟培养基将大约 4-6 个未成熟 LBO 嵌入到 ECM基质胶中。 观察到各种形态,包括在顶端的分支结构和/或圆形扩张,在中心有类似于肺泡球的致密组织。 当持续培养超过 60-70 天时,一些大的圆形结构可能会破裂,释放出粘液样物质。
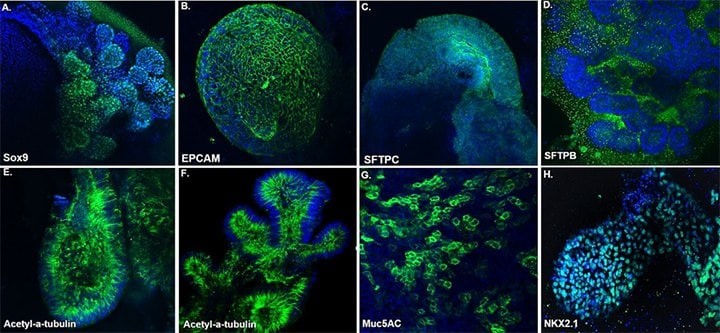
图 5. 肺类器官标记表达。 来自人外周血单核细胞 (PBMC) 和 HFF 人 iPS 细胞的成熟肺类器官在第70天表达产生表面活性物质相关蛋白的 II 型肺泡上皮细胞 (SFTPC 和 SFTPB)、气道杯状细胞 (Muc5AC)、肺内胚层(EPCAM、Sox9,NKX2.1) 和纤毛细胞 (Acetyl-α-Tubulin) 的标志物。 细胞核使用 DAPI 复染。
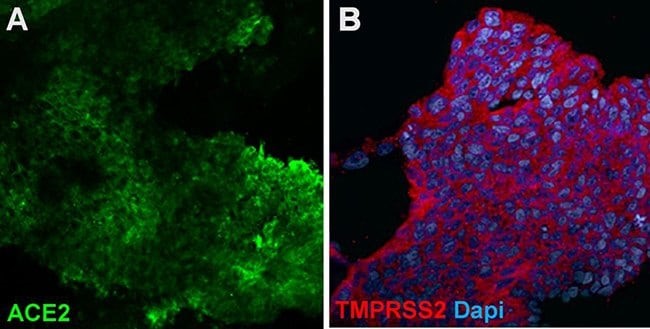
图 6. 肺类器官可用于研究 SARS-CoV-2 呼吸道病毒感染。
肺芽类器官表达 ACE2、SARS-CoV-2 结合受体 (A) 和丝氨酸蛋白酶 TMPRSS2 (B),可增加SARS-CoV-2 病毒入侵。
1. 3dGRO™ 肺类器官分支培养基 (SCM307) 和 3dGRO™ 肺类器官成熟培养基 (SCM308) 含有对温度和光敏感的成分。 根据实验计划准备等分的试样,避免反复冻融。 请务必遵循手册中“存储和稳定性”部分中的说明。 解冻并使用新的 3dGRO™ 肺类器官分支培养基 (SCM307) 和/或 3dGRO™ 肺类器官成熟培养基 (SCM308)。
2. 选择具有折叠结构的 LBO 进行转移以制作 ECM基质胶夹层。 有关具有折叠结构的 LBO 的示例,请参见图 3。
3. 悬浮培养开始前第4天和第8天应观察到细胞密度高; 根据细胞类型调整接种密度。
问题 2:在悬浮培养过程中,悬浮 LBO 会附着在板的底部。
使用超低附着 24 孔板,而不是组织培养处理的 24 孔板或培养皿。
问题 3:更换 ECM基质胶夹层的培养基后,顶层显得柔软或塌陷。
将 75 µL 的 100%减生长因子(GFR) ECM基质胶添加到夹层的顶层,而不是 50 µL。将 24 孔板放入培养箱中 ≥ 30 分钟,以确保 ECM基质胶 夹层已固化。
问题4:第4天c-kit+/CXCR4+阳性细胞比例低于80%。
应在第 4 天观察到紧凑的 c-kit+/CXCR4+ 细胞群,其中阳性细胞为 80-90% 或更高。 不建议在第 4 天没有成功的定型内胚层诱导的情况下继续分化。使用高质量、未分化的人iPS细胞培养物重新开始实验。
问题5:在成熟的后期,培养基可能很快变黄。
在此期间,嵌入的类器官可能会扩大,有些可能会发展出复杂的过程(图 5)。 将 750 µL 的 3dGRO™ 肺类器官成熟培养基 (SCM308) 添加到细胞培养小室顶部,并在小室下方的孔中添加 500 µL。
材料:

1. 应将冷冻管放在设置维持在37 °C的水浴中快速融化细胞。在水浴中轻轻涡旋冷冻管,以确保快速解冻,但请勿浸没冷冻管的盖子。打开前用70%乙醇(793213)或等效消毒剂对冷冻管进行消毒。
2. 用5 mL无菌移液管,将冷冻保护剂 / 细胞混合物从冷冻管转移到15 mL离心管中。应注意不要对细胞造成物理损伤。
3. 在室温下,缓慢地逐滴向15 mL离心管中的细胞中加入10 ml适当的培养基。轻轻前后摇动该15 mL离心管,同时加入几滴培养基。这是一个非常关键的步骤,可最大限度地减小对细胞的渗透冲击压,并且有助于确保尽可能温和地处理细胞。
4. 检查试管以确保除去了所有细胞内容物。如果需要,用1 mL适用培养基冲洗。
5. 少量细胞可用于进行细胞计数。应使用胰蛋白酶或其他合适的细胞分离培养基制成单细胞悬浮液。作为一般指导原则,6孔板的一孔接种密度范围介于2×105 - 1×106个活细胞之间。对于任何特定批号的EBiSC细胞系,其相应的指南请参阅分析证书。
6. 将细胞以200 x g离心2分钟。去除并倒掉上清液。
7. 添加适量的培养基(例如,6孔板每孔1.5 - 2 mL)以准备培养容器。
8. 轻拍15 mL离心管,以使细胞沉淀脱离,然后轻轻加入1 mL适当的培养基,并接种到包被的6孔板的2个孔中(如果使用其他培养形式,或者如果分析证书另有说明,则相应加以调整)。请勿过度吸取细胞,否则会因为单细胞悬液的生成而造成细胞活力下降。
9. 轻轻左右和前后摇动板,以使细胞均匀铺展在整个孔中。
10. 建议在解冻后立即、48小时、以及约达到70-80%汇合时,记录细胞图像。
人iPSC的培养
1. 良好的作业规范是,在相差显微镜(4x、10x、20x和40x放大倍数)下每天观察iPSC细胞系,以检查iPSC样形态、分化细胞的存在和汇合。典型评分总结如下:

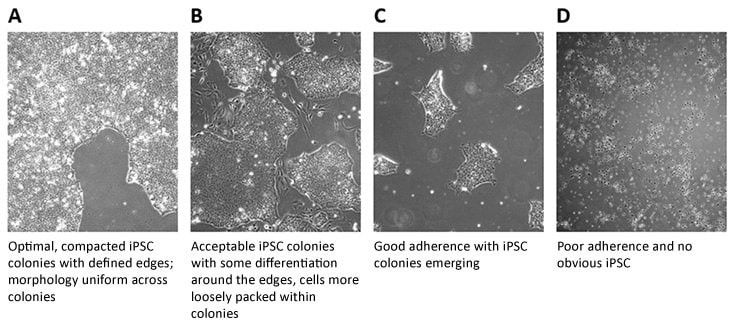
图 1.iPSC细胞集落的评分

图 2.iPSC培养基中的分化水平
2. 用吸移管从孔中除去约95%的培养基,以喂养细胞。请勿完全去除培养基,在细胞层上应覆盖薄薄一层培养基,以免细胞干燥。
3. 对6孔板的每个孔,顺着孔的侧面轻轻地无菌添加2 mL新鲜培养基。将细胞置于37 ℃、5% CO2培养箱中孵育。
4. 通常,七天当中有六天是每天更换培养基,但如果细胞需要更长的培养基更换间隔时间,则需要增加培养基的体积(正常量的1.5x - 2x,取决于细胞密度)。更换培养基的间隔时间请勿超过两天。
1. 开始之前,将EZ-LiFT™试剂(SCM139)温热至37 °C。
2. 吸除培养基,用1.5 mL EZ-LiFT™试剂(SCM139)洗涤孔两次。
3. 向每孔加入1 mL EZ-LiFT™试剂(SCM139)。 将板在37°C下孵育4分钟。
4. 4分钟后,快速拍打板底部(即在5秒内拍打20-25次)。
5. 将平板放回37 °C培养箱中再孵育4分钟。
6. 4分钟后,快速拍打板底部(即在5秒内拍打20-25次)。
7. 用显微镜快速检查孔。 1.如果可以看到大量脱落的团块,则继续执行步骤8。 2.如果没有观察到明显的脱落,则重复步骤4-7,除了在步骤5中,37 °C孵育 应该是2分钟而不是4分钟。 前往执行第8步。
8. 轻轻收集细胞悬液(~1 mL),并转移至15 mL锥形管中。 将5 mL培养基轻轻地加入细胞悬液中以中和。 请勿上下移液,否则可能会将细胞团块破碎成单细胞悬液。
9. 以800 rpm离心3分钟。吸除上清液。
10. 轻轻地将细胞沉淀重悬于1 mL支持多能性的培养基中,例如PluriSTEM®(SCM130)。 请勿上下移液两次以上。 过度移液可能会造成分离成单细胞。
11. 将脱离的细胞团块传代至新包被的6孔板中。分割率应在1:6至1:30之间。每天监测细胞。取决于分割率,细胞通常在6-8天内达到60-80%汇合。
Accutase传代实验方案
1. 等分足够的PluriSTEM®(SCM130)、Accutase(A6964)和DMEM/F12(D6421),以传代细胞。将试剂温热至室温。
2. 在细胞传代前一小时,将ROCK抑制剂(ROCKi)Y-27632(SCM075)加入到6孔板的每个孔中,终浓度为10 μM。
3. 1小时后,用解剖显微镜目视检查含有要传代的人多能细胞的平板。去除自发分化的区域。
4. 从孔的刮擦区域吸出含有细胞的培养基。用2 mL DMEM/F-12(D6421)培养基或1X PBS(D8537)冲洗每个孔。
5. 吸干净6孔板的每个孔,然后每孔替换为1 mL Accutase(A6964)。在37 °C孵育8-10分钟。
6. 对所使用的每mL Accutase,添加1 mL PluriSTEM®培养基(SCM130),以淬灭Accutase反应。使用无菌1000 μL移液器吸头轻轻分离细胞。
7. 将脱离后的细胞收集到15 mL锥形管中。用另外2 mL PluriSTEM® 培养基(SCM130)冲洗孔,以收集任何残留的细胞。将冲洗液加入到15 mL锥形管中。
8. 在室温下,将含有细胞悬液的15 mL锥形管以300 × g离心5分钟。
9. 吸除上清液。将细胞重悬于含有10 μM ROCK抑制剂Y-27632(SCM075)的新鲜PluriSTEM® 培养基(SCM130)中。
10. 用Scepter™细胞计数仪或血细胞计数仪计数细胞数。确保细胞处于单细胞悬液中。使用台盼蓝(T8154)排除法确定细胞活力。
11. 设置不同细胞密度的滴定,范围为0.5-1×104个细胞/cm2。这相当于含有10 μM ROCK抑制剂的PluriSTEM®培养基中,ECM基质胶包被的6孔板每孔50,000 - 100,000个细胞。
12. 第二天,更换新鲜的PluriSTEM®培养基(SCM130)。每2天更换一次新鲜的PluriSTEM®培养基(SCM130)(每孔3 mL)。细胞可以每5-7天传代一次。
分散酶传代实验方案
1. 等分足够的分散酶II 1 mg/mL(CC130)和DMEM/F12(D6421),以传代细胞。将试剂温热至室温。
2. 用解剖显微镜目视检查含有要传代的人多能细胞的平板。检查自发分化区域的细胞集落。
3. 使用连接到p200自动移液器的无菌p200移液器吸头刮掉自发分化区域。
4. 从孔的刮擦区域吸出含有细胞的培养基。用2 mL DMEM/F-12(D6421)培养基或1X PBS(D8537)冲洗每个孔。
5. 在含有要传代的多能人ES或iPS细胞的6孔板的每孔中,加入1mL分散酶II 1 mg/mL(CC130)。
6. 在37 °C孵育6-7分钟。孵育后,在显微镜下目视检查细胞集落。细胞集落的边缘可能看起来远离板表面略微上翘和/或上翻,但是大部分细胞集落仍应附着在板上。
7. 吸除分散酶II(CC130),并用2 mL 1X PBS(D8537)或DMEM/F12(D6421)培养基轻轻冲洗每个孔两次。
8. 向每个孔中加入1.5-2 mL PluriSTEM®培养基(SCM130)。用细胞刮刀轻轻地分开细胞集落。
9. 用5 mL血清移液管将细胞团收集到15 mL锥形管中。尽量减少上下移液,否则可能会将细胞集落破碎为不理想的小块。
10. 用另外2 mL PluriSTEM®培养基(SCM130)冲洗每个孔,以收集任何残留的细胞团。将冲洗液加入到15 mL锥形管中。
11. 在室温下,将含有细胞团的15 mL锥形管以300 × g离心5分钟。
12. 吸除上清液。将细胞团重悬于适当体积的PluriSTEM®培养基(SCM130)中以进行传代。取决于细胞团的数量,将细胞分割成1:3至1:6。
13. 将平板置于37oC培养箱中。轻轻地来回和左右摇动平板,以确保细胞团均匀地分布在孔的表面上。
14. 第二天,每孔用3 mL新鲜的PluriSTEM®培养基(SCM130)更换。细胞可以每5-7天传代一次。
人IPSC的深低温保存
1. 在执行深低温保存操作程序的过程中,要保持试剂和冷冻容器(例如Mr. Frosty)处于低温。
2. 细胞必须在其生长的对数期进行深低温保存,以提高解冻后的存活率。收获的最佳时间通常是细胞达到约70-80%汇合时。
3. 所使用的冷冻保护剂类型取决于培养条件和实验室偏好。使用基于市售的Cryostor® CS10(C2874)或DMSO(D2650)的冷冻混合液(FBS和培养基中含10% DMSO)。Cryostor®培养基可直接使用并保存在2-8 °C。为制备基于DMSO的冷冻保护剂,将40% FBS与10% DMSO混合,然后与50%适当的培养基混合。
4. 从组织培养容器中取出用过的培养基,并根据培养条件用推荐体积的洗涤缓冲液洗涤容器两次( ECM基质胶的洗涤缓冲液是0.5 mM EDTA,玻连蛋白的洗涤缓冲液是PBS)。
5. 为了使细胞脱离组织培养塑料表面,将 1mL 0.5 mM EDTA(03690)加入到组织培养容器中。根据所使用的基质,在建议的温度下,将细胞孵育建议的时间长度。从孔中吸除EDTA。必须小心,因为细胞集落非常松地附着在塑料上。
6. 在每孔中加入1 mL冷冻保护剂。用1 mL无菌移液管轻轻冲洗容器上的冷冻保护剂,使细胞脱离塑料表面。请勿吸移超过3次,以免细胞团破碎成单个细胞。将冷冻保护剂和细胞混合液放入适当标记的冷冻管中。
7. 如果需要深低温保存更多的孔,应将来自相同传代数和培养条件的细胞合并在一起。然后等分混合后的细胞,可用于细胞计数。将收获的细胞以200 x g离心2分钟,吸除用过的培养基,并将细胞沉淀轻轻地重悬于适当体积的冷冻保护剂中。6孔板的一个孔产生约1-2 × 106个细胞。建议每个冷冻管冷冻约1-2 × 106个细胞。每个冷冻管使用1 mL冷冻保护剂-细胞混合液。
8. 立即将冷冻管放入预冷(2-8 °C)的Mr. Frosty水浴中,然后立即将Mr. Frosty水浴转移到-80 °C的冰箱中。让细胞在-80 °C过夜(16-36小时)。冷冻后,将细胞置于干冰上转移至超低温储存容器(液氮或-150°C冰箱)。
 表1.人iPSC标记物汇总
表1.人iPSC标记物汇总
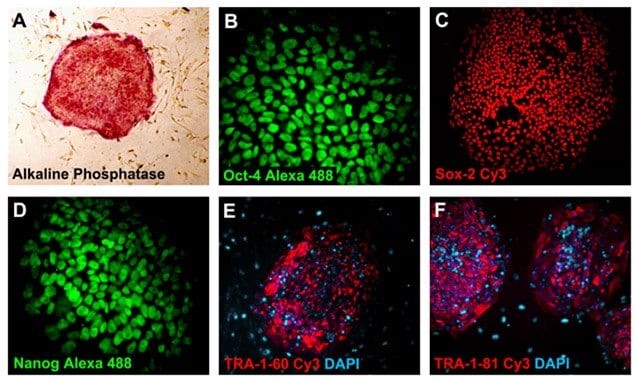
图 3.多能 iPS细胞表达多能性标志物。碱性磷酸酶 (40x) (A), Oct-4 Alexa 488 (MAB4401A4, 400x) (B), Sox-2 Cy3 (MAB4423C3, 100x) (C), Nanog Alexa 488 (MABD24A4, 400x) (D), TRA-1-60 Cy3 (MAB4360C3, 100x) (E), 以及TRA-1-81-Cy3 (MAB4381C3, 100x) (F)。细胞核用DAPI(蓝色)(D9542)复染。
故障排除提示

肺类器官是常用的三维(3D)细胞培养模型,用于研究人类肺部发育和呼吸道疾病,包括病毒感染(SARS-CoV、H1N1、MERS)、囊性纤维化、哮喘/COPD、空气污染暴露和吸烟的影响。与传统的永生化肺细胞系和原代细胞不同,肺类器官包含各种分化的细胞类型,具有复杂的组织结构,更接近于体内组织和功能。 此外,肺类器官可以从少量患者组织或多能干细胞中提取,以创建有助于个性化生物医学研究的活体生物库。
3dGRO™ 人肺类器官培养系统是一种无血清、多阶段培养系统,常用于将人诱导多能干细胞(iPS)有效分化为结构类似于体内分支气道和早期肺泡结构的成熟肺类器官。 使用 3dGRO™ 人肺类器官培养系统,可以生成大量成熟的肺类器官,这些类器官表达适当的标志物,标志着成熟肺和气道中发现的多种细胞类型,包括在中发现的 SFTPB 和 SFTPC(表面活性物质相关蛋白B 和表面活性物质相关蛋白C) II 型肺泡上皮 (ATII) 细胞、MUC5AC(气道杯状细胞)、EpCAM、Sox9 和 Nkx2.1(肺内胚层)、乙酰-α-微管蛋白(纤毛细胞)和间充质标记波形纤维蛋白。
此外,肺类器官还表达血管紧张素转换酶 2 (ACE2),它是导致 COVID-19 的新型 SARS-CoV-2 病毒的受体,以及 TMPRSS2,一种协助SARS-CoV-2 病毒入侵的丝氨酸蛋白酶。

图 1. 人肺类器官分化实验流程。
使用诱导培养基(SCM302)在4天内将人多能干细胞分化成定型内胚层细胞。 在第4-8天,诱导培养基 (SCM305、SCM306) 将人定型内胚层细胞分化为前肠内胚层 (AFE)。 AFE细胞可以冷冻保存 (商业化产品货号SCC301) 或使用 3dGRO™ 肺类器官分支培养基 (SCM307) 进一步分化成分支肺芽型类器官,并使用 3dGRO™ 肺类器官成熟培养基 (SCM308) 进一步成熟为分支型和肺泡型类器官。
肺类器官分化方案
第 1 步:人 iPS 细胞分化为定型内胚层(第 0-4 天)
注意:从高品质未分化的人 ES/iPS 细胞 (SCC271) 开始,这些细胞汇合度约为 70-80%,且含有 <5% 的分化细胞。以下方案用于六孔组织培养处理板中的一孔。 指示的体积针对单孔。请根据需要调整用量。
1. 准备单细胞传代培养基。 将 ROCK 抑制剂 (ROCKi) Y-27632 (SCM075) 添加到 7-10 mL 人 ES/iPS 细胞扩增培养基 (SCM130) 中,最终浓度为 10μM。
2. 用 ECM 凝胶 (CC131) 涂层 6 孔板。
3. 吸出培养基。用 2 mL 的 DMEM/F12 或 1X PBS 清洗孔。吸出 1 mL Accumax™ 溶液 (A7089) 并将其添加到孔中。在 37°C下孵育 5-6 分钟。手掌敲击板,以帮助解离细胞。
4. 向孔中加入 1 mL 单细胞传代培养基(来自步骤 1)。用 5 mL 移液器上下吹打 1-3 次以分离细胞。小心不要吸入任何气泡。
5. 将解离的细胞收集在 15 mL 锥形管中。将 1 mL 的单细胞传代培养基添加到孔中,并将收集的所有剩余细胞转移到含有细胞悬液的 15 mL 锥形管中。140 x g 离心试管5分钟并吸出上清液。
6. 将细胞沉淀重悬于 1 mL 单细胞传代培养基中。使用自动细胞计数器或Trypan blue (T8154) 和血细胞计数器计算活细胞总数。
7. 将每孔 1x106个细胞加入ECM Gel (CC131) 涂布后的6孔板中。使用单细胞传代培养基(来自步骤 1 )。总体积=每孔3 mL。在 37°C下孵育过夜。
8. 从孔中吸出培养基。将2 mL的定型内胚层诱导培养基 (SCM302) 添加到孔中,并在 37°C 下孵育过夜。
9. 在第 2 天和第 3 天重复第 8 步。在第 4 天通过流式细胞术分析细胞。在进行第 2 步之前,细胞的内胚层标志物 CXCR4、c-Kit、Sox-17 和 FOXA2 的阳性率应 >80% , PDGFR 应为阴性。
第 2 步:DE 细胞分化为前肠内胚层细胞(第 4-8 天)
注意:在定型内胚层细胞的第 4 天和分化为前肠内胚层 (AFE) 细胞后的第 8 天,应观察到较高细胞密度。下面的方案提供了 6 孔板型的参考接种密度。其他板型的接种密度需做调整
1. 从培养箱中取出含第4天定型内胚层培养物的6孔板。
2. 从每个孔中吸出培养基。用2ml 1X PBS (BSS-1006-B)洗净每孔。
3. 每孔加入1ml Accumax™溶液(A7089),分离定型内胚层细胞。37°C孵育6-8分钟。
4. 5分钟后,目测检查培养板。轻轻敲击培养板的边缘,使细胞进一步分离。大多数细胞应该分离开并悬浮于液体中。如果不是,再孵育2分钟。
5. 每孔加入2ml 1X PBS (BSS-1006-B)稀释AccuMax™溶液(A7089)。将细胞悬浮液置于50ml锥形管中。用1ml 1X PBS冲洗每孔,收集任何剩余的细胞,并加入到50ml锥形管中。移液器上下吹打几次以实现单细胞悬浮状态。
6. 室温下,细胞悬液130 x g离心5分钟。
7. 吸出上清液。 在 2 mL 的 AFE 诱导培养基 I (SCM305) 中重新悬浮细胞沉淀。 使用自动细胞计数器或血细胞计数器对细胞进行计数。 在 PBS 中配制4μg/mL的纤连蛋白 (F0895)涂布在6孔板上。 每个孔加入 1.5 mL 稀释的纤连蛋白。将涂有涂层的培养板放置在2-8°C下过夜。 吸出涂层溶液。 打开盖子,在超净台中风干 5 分钟。 当板干燥后,将板盖好盖子待用,直到细胞准备好。
8. 将1X106 个细胞铺板到纤连蛋白包被的 6 孔板的每个孔内。将适当体积的 AFE 诱导培养基I (SCM305) 添加到每个孔中,以达到每孔 2 mL 的总体积。
9. 将培养板置于 37 °C培养箱中。轻轻晃动板,以确保细胞均匀分布在每个孔的板底。在 37°C 下孵育过夜。
10. 第 5 天:每孔更换 2 mL AFE 诱导培养基II (SCM306)。在 37 °C 下孵育 24 小时。
11. 第 6 天:用每孔 2 mL 的 3dGRO™ 肺类器官分支培养基 (SCM307) 更换培养基。在 37 °C 下孵育 24 小时。
12. 第 7 天:用每孔 2 mL 的 3dGRO™ 肺类器官分支培养基 (SCM307) 更换培养基。在 37 °C 下孵育 24 小时。
13. 第 8 天:AFE 细胞应表现出形态变化,由细胞簇/聚集体散布组成汇合区域。按照方案将进一步分化为成熟的肺类器官。多余的 AFE 细胞可以使用 3dGRO™ 类器官冷冻培养基 (SCM301) 以每管3-6 x 106 个细胞进行冷冻保存。

图 2. 前肠内胚层 (AFE) 标记表达。 大约 95-100% 的 AFE 细胞对 Sox2(A、C、AB5603A4)和 Pax9(B、C)呈双阳性。 大约 20-30% 的 AFE 细胞对 EpCAM(D、F、MAB4444)和 Pax9(E、F)呈双阳性。
第 3 步:将 AFE 细胞分化为肺芽类器官(第 8-25 天)
1. 将 1 mL 新鲜的 3dGRO™ 肺类器官分支培养基 (SCM307) 吸出并添加到包含 AFE 细胞汇合层的 6 孔板的每个孔中。
2. 使用 5 mL 移液器,沿每个孔的表面轻轻刮擦,将细胞单层聚集并提取。 小心不要研磨成单细胞。 将细胞聚集体从 6 孔板的 1 孔转移到 Costar® 超低附着 24 孔板 (CLS3473) 的孔中。
3. 加入 0.5 mL 3dGRO™ 肺类器官分支培养基 (SCM307) 以收集所有剩余细胞并添加到低附着 24 孔板的细胞孔中。 总体积 = ~ 1.5 mL 细胞悬浮液。 在 37°C 下孵育。
4. 每隔一天更换一次培养基,直到第 20-25 天。
由于类器官处于悬浮培养中,因此请根据方案进行培养基更换:
1. 使用 1 mL 玻璃血清移液器将漂浮的类器官转移到无菌的 15 mL 锥形管中。等待 10 分钟,使类器官沉淀到试管底部。
2. 将 2 mL 吸液管连接真空泵。在 2 mL 吸气移液器上,连接一个无菌的 20 μL 非屏障移液器枪头。小心地吸出培养基。注意在类器官上方留下少量培养基作为缓冲液,以避免干扰类器官。
3. 将 0.5 mL 3dGRO™ 肺类器官分支培养基 (SCM307) 添加到含有类器官沉淀的 15 mL 管中。用 1 mL 玻璃移液器上下吹打两次。将类器官转移回超低附着24 孔板中的同一孔中。
4. 将 0.5 mL 3dGRO™ 肺类器官分支培养基 (SCM307) 添加到 15 mL 锥形管中,冲洗并收集所有剩余的类器官。将冲洗液添加到超低附着24 孔板的同一孔中。总体积 = 每孔 1 mL。

图3.悬浮培养的人肺芽类器官(LBO)。分化第23天未成熟人iPS细胞衍生LBO的形态学。
下图显示了具有折叠结构(箭头)的最佳类器官,可以选择这些类器官在使用 3dGRO™ 肺类器官成熟培养基(步骤 4)的 ECM基质胶包埋夹层培养中进一步成熟。
第 4 步:将肺芽类器官 (LBO) 分化为成熟的肺类器官(第 25-60 天)
1. 在冰上解冻降低生长因子浓度的ECM 基质胶 (E6909)。
2. 使用无菌镊子将无菌 24 孔细胞培养小室放到未经组织培养处理的 24 孔板中,每孔使用一个培养小室。
3. 将 50 µL 冷的含100% 减生长因子ECM基质胶分装到每个细胞培养小室中。 等待 5 分钟,让 ECM基质胶固化。
4. 同时,将一孔浮肺芽类器官 (LBO) 转移到 60 mm培养皿中。 在单独的 96 孔 U 型底板中,向每个孔中加入 60 µL 3dGRO™ 肺类器官成熟培养基 (SCM308)。
注意:培养至20-25 天,会有许多漂浮的肺类器官(图 3)。 每个 ECM基质胶 包埋夹层应包含大约 4-6 个类器官。根据您计划制作的 ECM基质胶包埋夹层的数量,计算96 孔板中制备类器官/ECM基质胶悬浮液所需的孔总数。
5. 在无菌解剖台中,使用体积设置为 10 µL的无菌 20 µL 移液器吸头从 60 mm 培养皿中6个较完整的类器官,并将其转移到 96 孔 U 型底板的 1 个孔中。
6. 将 96 孔板从解剖台转移到组织培养超净台中。
注意:为避免 ECM基质胶过早凝胶化,我们建议一次制备不超过 3 个细胞培养小室。
1. 将 60 µL 冷的 100%的减生长因子(GFR) ECM基质胶加入步骤 5 中的 96 孔板的每个孔中。通过移液器轻轻混合几次,避免产生任何气泡。 总体积 = 每孔130 µL。
2. 立即将类器官-GFR ECM基质胶混合物 (~130 µL) 转移到步骤 3 中制备的 24 孔板上每个细胞培养小室的中心。
3. 等待 5 分钟,让 ECM基质胶固化。
4. 重复以上步骤完成6 个包埋夹层的处理。
7. 将 75 µL 冷的 100%减生长因子(GFR) ECM基质胶添加到细胞培养小室顶部,形成 ECM基质胶夹层。将 24 孔板放入 37 °C 的培养箱中至少 30 分钟,以确保 ECM基质胶夹层已固化。如果要嵌入的夹层超过 6 个,请重复步骤 4-7。
8. 在每个培养小室顶部添加 500 µL 3dGRO™ 肺类器官成熟培养基 (SCM308),并在细胞培养小室下方的孔中加入 500 µL。
9. 每隔一天更换一次培养基。
1. 将 2 mL 吸液管连接到真空泵上。 在 2 mL 吸气移液器上,连接一个无菌的 20 μL 无滤膜的移液器枪头。 小心吸出 ECM基质胶夹层顶部和细胞培养小室下方的培养基。
2. 在每个细胞培养小室顶部和下方的孔中各加入 500 µL 3dGRO™ 肺类器官成熟培养基 (SCM308)。

图 4. 肺类器官成熟的时间过程。 在两个单独的孔中追踪人iPS 细胞衍生的肺类器官分化。在第 20-25 天,使用 3dGRO™ 肺类器官成熟培养基将大约 4-6 个未成熟 LBO 嵌入到 ECM基质胶中。 观察到各种形态,包括在顶端的分支结构和/或圆形扩张,在中心有类似于肺泡球的致密组织。 当持续培养超过 60-70 天时,一些大的圆形结构可能会破裂,释放出粘液样物质。

图 5. 肺类器官标记表达。 来自人外周血单核细胞 (PBMC) 和 HFF 人 iPS 细胞的成熟肺类器官在第70天表达产生表面活性物质相关蛋白的 II 型肺泡上皮细胞 (SFTPC 和 SFTPB)、气道杯状细胞 (Muc5AC)、肺内胚层(EPCAM、Sox9,NKX2.1) 和纤毛细胞 (Acetyl-α-Tubulin) 的标志物。 细胞核使用 DAPI 复染。

图 6. 肺类器官可用于研究 SARS-CoV-2 呼吸道病毒感染。
肺芽类器官表达 ACE2、SARS-CoV-2 结合受体 (A) 和丝氨酸蛋白酶 TMPRSS2 (B),可增加SARS-CoV-2 病毒入侵。
气道上皮肺类器官问题排除指南
问题 1:将 D20-25 的肺芽类器官 (LBO) 转移到 ECM基质胶夹层后,两周后未观察到分枝或肺泡结构。 1. 3dGRO™ 肺类器官分支培养基 (SCM307) 和 3dGRO™ 肺类器官成熟培养基 (SCM308) 含有对温度和光敏感的成分。 根据实验计划准备等分的试样,避免反复冻融。 请务必遵循手册中“存储和稳定性”部分中的说明。 解冻并使用新的 3dGRO™ 肺类器官分支培养基 (SCM307) 和/或 3dGRO™ 肺类器官成熟培养基 (SCM308)。
2. 选择具有折叠结构的 LBO 进行转移以制作 ECM基质胶夹层。 有关具有折叠结构的 LBO 的示例,请参见图 3。
3. 悬浮培养开始前第4天和第8天应观察到细胞密度高; 根据细胞类型调整接种密度。
问题 2:在悬浮培养过程中,悬浮 LBO 会附着在板的底部。
使用超低附着 24 孔板,而不是组织培养处理的 24 孔板或培养皿。
问题 3:更换 ECM基质胶夹层的培养基后,顶层显得柔软或塌陷。
将 75 µL 的 100%减生长因子(GFR) ECM基质胶添加到夹层的顶层,而不是 50 µL。将 24 孔板放入培养箱中 ≥ 30 分钟,以确保 ECM基质胶 夹层已固化。
问题4:第4天c-kit+/CXCR4+阳性细胞比例低于80%。
应在第 4 天观察到紧凑的 c-kit+/CXCR4+ 细胞群,其中阳性细胞为 80-90% 或更高。 不建议在第 4 天没有成功的定型内胚层诱导的情况下继续分化。使用高质量、未分化的人iPS细胞培养物重新开始实验。
问题5:在成熟的后期,培养基可能很快变黄。
在此期间,嵌入的类器官可能会扩大,有些可能会发展出复杂的过程(图 5)。 将 750 µL 的 3dGRO™ 肺类器官成熟培养基 (SCM308) 添加到细胞培养小室顶部,并在小室下方的孔中添加 500 µL。
材料:

附录:人iPSC操作指南
人iPSC的解冻1. 应将冷冻管放在设置维持在37 °C的水浴中快速融化细胞。在水浴中轻轻涡旋冷冻管,以确保快速解冻,但请勿浸没冷冻管的盖子。打开前用70%乙醇(793213)或等效消毒剂对冷冻管进行消毒。
2. 用5 mL无菌移液管,将冷冻保护剂 / 细胞混合物从冷冻管转移到15 mL离心管中。应注意不要对细胞造成物理损伤。
3. 在室温下,缓慢地逐滴向15 mL离心管中的细胞中加入10 ml适当的培养基。轻轻前后摇动该15 mL离心管,同时加入几滴培养基。这是一个非常关键的步骤,可最大限度地减小对细胞的渗透冲击压,并且有助于确保尽可能温和地处理细胞。
4. 检查试管以确保除去了所有细胞内容物。如果需要,用1 mL适用培养基冲洗。
5. 少量细胞可用于进行细胞计数。应使用胰蛋白酶或其他合适的细胞分离培养基制成单细胞悬浮液。作为一般指导原则,6孔板的一孔接种密度范围介于2×105 - 1×106个活细胞之间。对于任何特定批号的EBiSC细胞系,其相应的指南请参阅分析证书。
6. 将细胞以200 x g离心2分钟。去除并倒掉上清液。
7. 添加适量的培养基(例如,6孔板每孔1.5 - 2 mL)以准备培养容器。
8. 轻拍15 mL离心管,以使细胞沉淀脱离,然后轻轻加入1 mL适当的培养基,并接种到包被的6孔板的2个孔中(如果使用其他培养形式,或者如果分析证书另有说明,则相应加以调整)。请勿过度吸取细胞,否则会因为单细胞悬液的生成而造成细胞活力下降。
9. 轻轻左右和前后摇动板,以使细胞均匀铺展在整个孔中。
10. 建议在解冻后立即、48小时、以及约达到70-80%汇合时,记录细胞图像。
人iPSC的培养
1. 良好的作业规范是,在相差显微镜(4x、10x、20x和40x放大倍数)下每天观察iPSC细胞系,以检查iPSC样形态、分化细胞的存在和汇合。典型评分总结如下:


图 1.iPSC细胞集落的评分

图 2.iPSC培养基中的分化水平
2. 用吸移管从孔中除去约95%的培养基,以喂养细胞。请勿完全去除培养基,在细胞层上应覆盖薄薄一层培养基,以免细胞干燥。
3. 对6孔板的每个孔,顺着孔的侧面轻轻地无菌添加2 mL新鲜培养基。将细胞置于37 ℃、5% CO2培养箱中孵育。
4. 通常,七天当中有六天是每天更换培养基,但如果细胞需要更长的培养基更换间隔时间,则需要增加培养基的体积(正常量的1.5x - 2x,取决于细胞密度)。更换培养基的间隔时间请勿超过两天。
人iPSC的传代
EZ-LiFT™ 试剂传代实验方案1. 开始之前,将EZ-LiFT™试剂(SCM139)温热至37 °C。
2. 吸除培养基,用1.5 mL EZ-LiFT™试剂(SCM139)洗涤孔两次。
3. 向每孔加入1 mL EZ-LiFT™试剂(SCM139)。 将板在37°C下孵育4分钟。
4. 4分钟后,快速拍打板底部(即在5秒内拍打20-25次)。
5. 将平板放回37 °C培养箱中再孵育4分钟。
6. 4分钟后,快速拍打板底部(即在5秒内拍打20-25次)。
7. 用显微镜快速检查孔。 1.如果可以看到大量脱落的团块,则继续执行步骤8。 2.如果没有观察到明显的脱落,则重复步骤4-7,除了在步骤5中,37 °C孵育 应该是2分钟而不是4分钟。 前往执行第8步。
8. 轻轻收集细胞悬液(~1 mL),并转移至15 mL锥形管中。 将5 mL培养基轻轻地加入细胞悬液中以中和。 请勿上下移液,否则可能会将细胞团块破碎成单细胞悬液。
9. 以800 rpm离心3分钟。吸除上清液。
10. 轻轻地将细胞沉淀重悬于1 mL支持多能性的培养基中,例如PluriSTEM®(SCM130)。 请勿上下移液两次以上。 过度移液可能会造成分离成单细胞。
11. 将脱离的细胞团块传代至新包被的6孔板中。分割率应在1:6至1:30之间。每天监测细胞。取决于分割率,细胞通常在6-8天内达到60-80%汇合。
Accutase传代实验方案
1. 等分足够的PluriSTEM®(SCM130)、Accutase(A6964)和DMEM/F12(D6421),以传代细胞。将试剂温热至室温。
2. 在细胞传代前一小时,将ROCK抑制剂(ROCKi)Y-27632(SCM075)加入到6孔板的每个孔中,终浓度为10 μM。
3. 1小时后,用解剖显微镜目视检查含有要传代的人多能细胞的平板。去除自发分化的区域。
4. 从孔的刮擦区域吸出含有细胞的培养基。用2 mL DMEM/F-12(D6421)培养基或1X PBS(D8537)冲洗每个孔。
5. 吸干净6孔板的每个孔,然后每孔替换为1 mL Accutase(A6964)。在37 °C孵育8-10分钟。
6. 对所使用的每mL Accutase,添加1 mL PluriSTEM®培养基(SCM130),以淬灭Accutase反应。使用无菌1000 μL移液器吸头轻轻分离细胞。
7. 将脱离后的细胞收集到15 mL锥形管中。用另外2 mL PluriSTEM® 培养基(SCM130)冲洗孔,以收集任何残留的细胞。将冲洗液加入到15 mL锥形管中。
8. 在室温下,将含有细胞悬液的15 mL锥形管以300 × g离心5分钟。
9. 吸除上清液。将细胞重悬于含有10 μM ROCK抑制剂Y-27632(SCM075)的新鲜PluriSTEM® 培养基(SCM130)中。
10. 用Scepter™细胞计数仪或血细胞计数仪计数细胞数。确保细胞处于单细胞悬液中。使用台盼蓝(T8154)排除法确定细胞活力。
11. 设置不同细胞密度的滴定,范围为0.5-1×104个细胞/cm2。这相当于含有10 μM ROCK抑制剂的PluriSTEM®培养基中,ECM基质胶包被的6孔板每孔50,000 - 100,000个细胞。
12. 第二天,更换新鲜的PluriSTEM®培养基(SCM130)。每2天更换一次新鲜的PluriSTEM®培养基(SCM130)(每孔3 mL)。细胞可以每5-7天传代一次。
分散酶传代实验方案
1. 等分足够的分散酶II 1 mg/mL(CC130)和DMEM/F12(D6421),以传代细胞。将试剂温热至室温。
2. 用解剖显微镜目视检查含有要传代的人多能细胞的平板。检查自发分化区域的细胞集落。
3. 使用连接到p200自动移液器的无菌p200移液器吸头刮掉自发分化区域。
4. 从孔的刮擦区域吸出含有细胞的培养基。用2 mL DMEM/F-12(D6421)培养基或1X PBS(D8537)冲洗每个孔。
5. 在含有要传代的多能人ES或iPS细胞的6孔板的每孔中,加入1mL分散酶II 1 mg/mL(CC130)。
6. 在37 °C孵育6-7分钟。孵育后,在显微镜下目视检查细胞集落。细胞集落的边缘可能看起来远离板表面略微上翘和/或上翻,但是大部分细胞集落仍应附着在板上。
7. 吸除分散酶II(CC130),并用2 mL 1X PBS(D8537)或DMEM/F12(D6421)培养基轻轻冲洗每个孔两次。
8. 向每个孔中加入1.5-2 mL PluriSTEM®培养基(SCM130)。用细胞刮刀轻轻地分开细胞集落。
9. 用5 mL血清移液管将细胞团收集到15 mL锥形管中。尽量减少上下移液,否则可能会将细胞集落破碎为不理想的小块。
10. 用另外2 mL PluriSTEM®培养基(SCM130)冲洗每个孔,以收集任何残留的细胞团。将冲洗液加入到15 mL锥形管中。
11. 在室温下,将含有细胞团的15 mL锥形管以300 × g离心5分钟。
12. 吸除上清液。将细胞团重悬于适当体积的PluriSTEM®培养基(SCM130)中以进行传代。取决于细胞团的数量,将细胞分割成1:3至1:6。
13. 将平板置于37oC培养箱中。轻轻地来回和左右摇动平板,以确保细胞团均匀地分布在孔的表面上。
14. 第二天,每孔用3 mL新鲜的PluriSTEM®培养基(SCM130)更换。细胞可以每5-7天传代一次。
人IPSC的深低温保存
2. 细胞必须在其生长的对数期进行深低温保存,以提高解冻后的存活率。收获的最佳时间通常是细胞达到约70-80%汇合时。
3. 所使用的冷冻保护剂类型取决于培养条件和实验室偏好。使用基于市售的Cryostor® CS10(C2874)或DMSO(D2650)的冷冻混合液(FBS和培养基中含10% DMSO)。Cryostor®培养基可直接使用并保存在2-8 °C。为制备基于DMSO的冷冻保护剂,将40% FBS与10% DMSO混合,然后与50%适当的培养基混合。
4. 从组织培养容器中取出用过的培养基,并根据培养条件用推荐体积的洗涤缓冲液洗涤容器两次( ECM基质胶的洗涤缓冲液是0.5 mM EDTA,玻连蛋白的洗涤缓冲液是PBS)。
5. 为了使细胞脱离组织培养塑料表面,将 1mL 0.5 mM EDTA(03690)加入到组织培养容器中。根据所使用的基质,在建议的温度下,将细胞孵育建议的时间长度。从孔中吸除EDTA。必须小心,因为细胞集落非常松地附着在塑料上。
6. 在每孔中加入1 mL冷冻保护剂。用1 mL无菌移液管轻轻冲洗容器上的冷冻保护剂,使细胞脱离塑料表面。请勿吸移超过3次,以免细胞团破碎成单个细胞。将冷冻保护剂和细胞混合液放入适当标记的冷冻管中。
7. 如果需要深低温保存更多的孔,应将来自相同传代数和培养条件的细胞合并在一起。然后等分混合后的细胞,可用于细胞计数。将收获的细胞以200 x g离心2分钟,吸除用过的培养基,并将细胞沉淀轻轻地重悬于适当体积的冷冻保护剂中。6孔板的一个孔产生约1-2 × 106个细胞。建议每个冷冻管冷冻约1-2 × 106个细胞。每个冷冻管使用1 mL冷冻保护剂-细胞混合液。
8. 立即将冷冻管放入预冷(2-8 °C)的Mr. Frosty水浴中,然后立即将Mr. Frosty水浴转移到-80 °C的冰箱中。让细胞在-80 °C过夜(16-36小时)。冷冻后,将细胞置于干冰上转移至超低温储存容器(液氮或-150°C冰箱)。
人iPSC的表征
iPSC未分化状态的特征在于碱性磷酸酶(SCR004)和干细胞转录因子Nanog、Oct-4和Sox-2的高度表达。这些细胞在其阶段特异性胚胎抗原(SSEA1、3、4)和足细胞标记蛋白(TRA-1-60,TRA-1-81)标记物的表达方面,也显示出与它们的鼠对应物的显著差异。可以使用高细胞表征试剂盒(SCR001、SCR002、SCR078)进行抗体ICC染色或通过PCR分析方法来分析细胞。 表1.人iPSC标记物汇总
表1.人iPSC标记物汇总
图 3.多能 iPS细胞表达多能性标志物。碱性磷酸酶 (40x) (A), Oct-4 Alexa 488 (MAB4401A4, 400x) (B), Sox-2 Cy3 (MAB4423C3, 100x) (C), Nanog Alexa 488 (MABD24A4, 400x) (D), TRA-1-60 Cy3 (MAB4360C3, 100x) (E), 以及TRA-1-81-Cy3 (MAB4381C3, 100x) (F)。细胞核用DAPI(蓝色)(D9542)复染。
故障排除提示
