肿瘤成球实验以及肿瘤球体增殖/活力检测方案
默克生命科学
12148
简介
实体瘤以三维(3D)空间构象生长,导致氧和营养物质以及其他物理和化学应力的异质性暴露。为了模拟三维空间构象,在肿瘤研究中普遍使用三 维体外培养模型。肿瘤干细胞 (CSC) 是指肿瘤内具有自我更新能力的那一小部分细胞,常常在化疗治疗后驱动肿瘤恶变和复发。传统上,肿瘤干细胞会从癌细胞系和肿瘤活检组织中分离出来,并在三维肿瘤球状体悬浮培养物中生长。
本实验方案描述了一种以 96 孔球形微孔板制备和培养肿瘤球状体的基本方法。这种基础培养和测定实验方案适用于所有球形微孔板。表 2 提供了将 96 孔培养体积缩小为 384 孔和 1536 孔形式的建议体积。由于接种体积和密度可能因细胞类型和下游应用而异,因此建议针对检测方案优化条件。
方法和材料
实验可以是贴壁生长癌细胞系的肿瘤干细胞,亦可是McCoy's 5a 培养基中培养的 T-29 人结肠癌细胞、F-12K (Kaighn's Mod.) 培养基中培养的 A549 人肺癌细胞,MCF7 人乳腺癌细胞。
另外,HTB-22™ 和 DU 145 人前列腺癌细胞均在杜氏改良 Eagle 培养基 (DMEM) 中培养。所有生长培养基均含有 10% 胎牛血清。细胞培养物均根据 ATCC 的建议使用标准细胞培养方法维持和收获。
球状体形成的初始接种密度取决于细胞类型、球状体形式的生长期持续时间以及分析时球状体所需尺寸等因素。为更好地评估球状体的形成和生长,使用 96 孔球形微孔板在每孔 100 µL 生长培养基中以 40、200、1,000、5,000 和 10,000 个细胞的密度进行接种。通过CellTiter-Glo® 3D细胞活力测定法在 0、24、48 和 72 小时分别对球状体培养物进行分析。上述所有细胞系采用同一接种方法。
以300 x g离心细胞悬液 5分钟并吸出上清液。将细胞重悬于少量培养物中,例如 3-5 mL 的 3dGRO™ 球状体培养基 ( S3077 )
注:可让细胞穿过40 µM细胞过滤器或带细胞过滤器卡扣盖的5 mL 圆底聚苯乙烯试管,以实现单细胞悬浮。
表1.接种密度制备
培养24小时,细胞形成松散聚集的多细胞球状体。培养48小时,所有细胞(除了MCF7)均形成紧密实在的球状体。培养72小时,低密度接种(<5,000 cells/孔)的HT-29和A549球状体略有变大,但DU 145和MCF7球状体在培养48小时后没有变大。
观察成像
通过倒置显微镜进行显微镜检查,并在每个时间点对所有五个接种密度的球状体进行拍照,采用图像分析软件对图像进行分析以测量结构在面积上的改变,以评估3D球状体的形成和生长。
注:图像可采用ImageJ 等免费软件进行分析,如下所示。其他图像分析软件也可通过配置以达到同样的测量目的;请向相应的软件供应商咨询相应的功能和使用方法
1.采用4X物镜对已知尺寸(如1mm)进行拍摄并在ImageJ中进行像素测量
图 1.用于球状体扩张分析的处理。A) 捕获图像并转换成8字节;B) 设置阈值以捕获整体的结构;C) 选择结果以计算总面积。
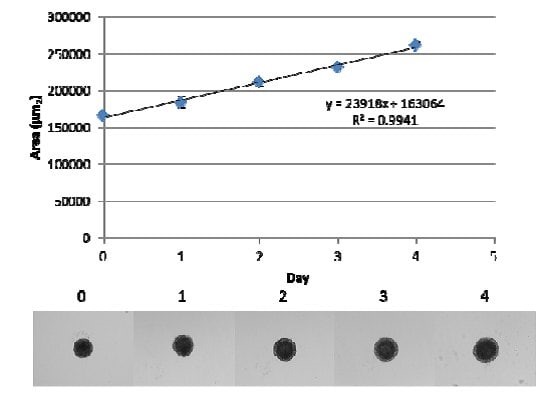
图 2.MDA-MB-231乳腺癌细胞的球状体生长。在球状体形成EMC的存在下每孔接种3,000个细胞并在37 °C, 5% CO2条件下培养72小时。此时,加入50ul的完全培养基至每孔中,并将球状体置于37 °C、5% CO2孵育。每隔24小时对球状体进行拍照并使用ImageJ软件对图像进行分析面积的变化。
荧光分析
1.每孔中加入十分之一体积(每100 ul加入10 ul)的刃天青并将培养板返还至37 °C细胞培养箱中。
2.在第1至4小时内每1小时用激发波长530-560 nm/散射波长590 nm进行荧光读取。最佳的读取可提供最大的动态范围、最佳的线性度以及最小的标准偏差。
3.对数据进行作图。
细胞增殖检测
用MTT细胞生长检测试剂盒(CT01)检测增殖情况,用AldeRed ALDH检测试剂盒(SCR150)分析醛脱氢酶 (ALDH)表达情况。
肿瘤干细胞表达醛脱氢酶(ALDH)水平升高。AldeRed™ ALDH检测试剂盒可使用ALDH红移荧光底物基于醛脱氢酶(ALDH)表达进行活肿瘤干细胞鉴定和分离,允许同时使用包括GFP细胞系在内的绿色荧光报告物。
1. 干燥AldeRed 588-A试剂重悬在DMSO中,通过添加2N HCl活化。
2. 将每个细胞样本悬浮在分析缓冲液中,并添加AldeRed 588-A试剂。
3. 立即将样品分成两管,其中一管含有DEAB,一种ALDH抑制剂。在37℃下进行反应30分钟,然后在检测缓冲液中洗涤一轮。
4. 在配有蓝和/或绿激光的血细胞计数仪器上使用PE和/或PE-TexasRed检测器(Guava, Muse, ACEA Novocyte, Beckman)执行AldeRed 588-A检测。
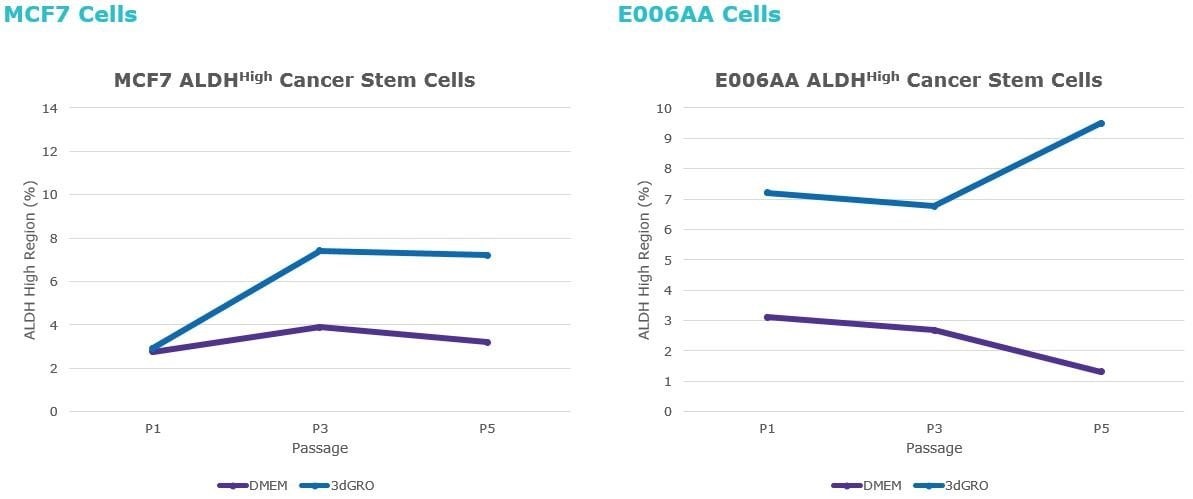
图3。当肿瘤细胞在3D肿瘤球培养5代后,在3dGRO™球体培养基中生长时,A ALDHhigh肿瘤干细胞群的富集发生。
细胞活力检测
按照CellTiter-Glo® 3D细胞活力检测方案进行。简要来说,解冻CellTiter-Glo® 3D试剂,花30分钟时间让试剂和检测板平衡到室温。
按1:1稀释比例(表2)将CellTiter-Glo® 3D试剂加到孔中。将微孔板在轨道微孔板振荡器上振荡5分钟混匀溶液,接着在室温孵育,总耗时30分钟。孵育后,用微孔板检测仪读取发光信号。
注意:对于0时间点(细胞为悬液形式),微孔板振荡时间设为2分钟,读取信号前的总孵育时间设为10分钟。
球形微孔板规格
 表2.推荐检测体积
表2.推荐检测体积
细胞活性测定:
· 观察到HT-29和A549球状体的持续生长。
· 观察到MCF7和DU 145球状体的生长抑制。
· 大球状体(初始接种密度为5000和10000)没有出现小球状体的线性连续生长。
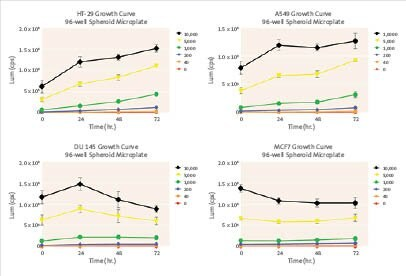
图4. 细胞活性测定
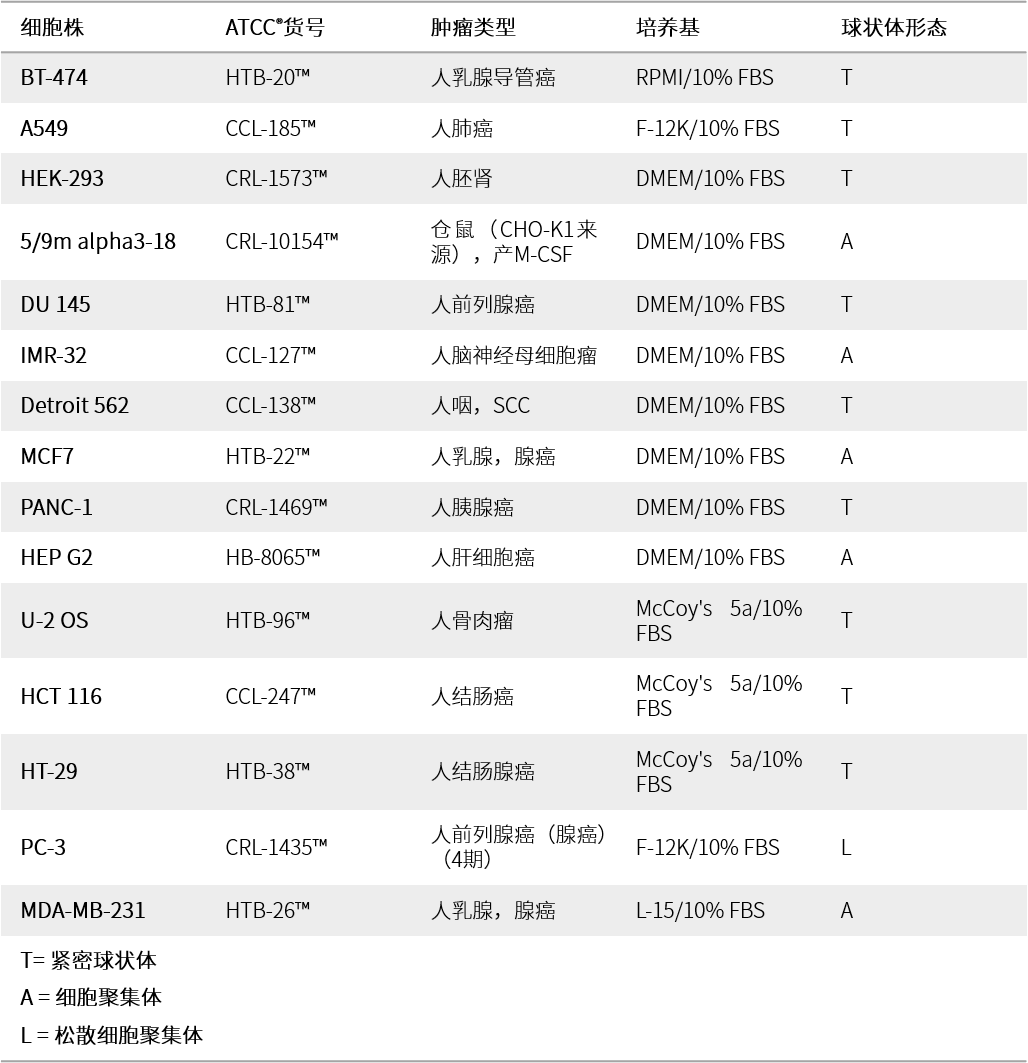
表3.球形微孔板生成的多细胞球状体
提示和技巧
一些细胞,例如 E3006AA 细胞,在未传代或者在前几次传代中表现出生长抑制或附着于三维培养板上,但后期将适应三维培养环境并在约第 3 次传代后再次增殖。所以对于这些细胞,在以上肿瘤成球实验方案基础上,应额外增加传代步骤。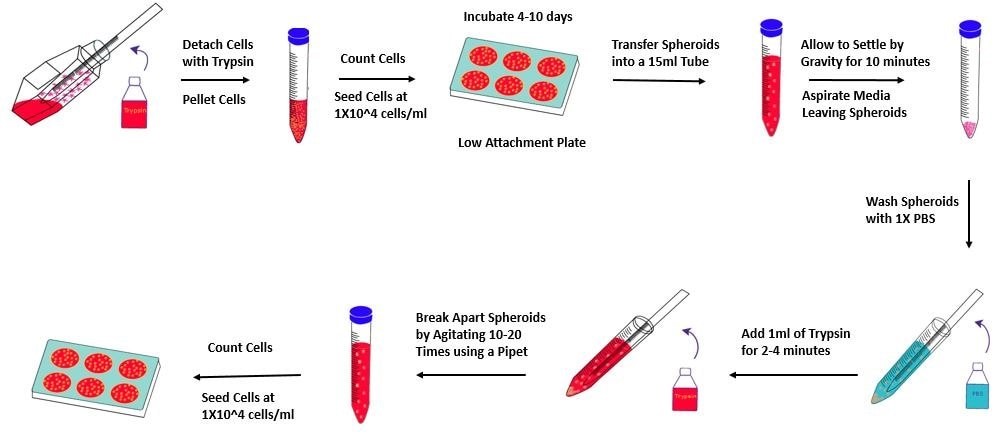
图 5.肿瘤成球实验方案概述
材料

实体瘤以三维(3D)空间构象生长,导致氧和营养物质以及其他物理和化学应力的异质性暴露。为了模拟三维空间构象,在肿瘤研究中普遍使用三 维体外培养模型。肿瘤干细胞 (CSC) 是指肿瘤内具有自我更新能力的那一小部分细胞,常常在化疗治疗后驱动肿瘤恶变和复发。传统上,肿瘤干细胞会从癌细胞系和肿瘤活检组织中分离出来,并在三维肿瘤球状体悬浮培养物中生长。
本实验方案描述了一种以 96 孔球形微孔板制备和培养肿瘤球状体的基本方法。这种基础培养和测定实验方案适用于所有球形微孔板。表 2 提供了将 96 孔培养体积缩小为 384 孔和 1536 孔形式的建议体积。由于接种体积和密度可能因细胞类型和下游应用而异,因此建议针对检测方案优化条件。
方法和材料
实验可以是贴壁生长癌细胞系的肿瘤干细胞,亦可是McCoy's 5a 培养基中培养的 T-29 人结肠癌细胞、F-12K (Kaighn's Mod.) 培养基中培养的 A549 人肺癌细胞,MCF7 人乳腺癌细胞。
另外,HTB-22™ 和 DU 145 人前列腺癌细胞均在杜氏改良 Eagle 培养基 (DMEM) 中培养。所有生长培养基均含有 10% 胎牛血清。细胞培养物均根据 ATCC 的建议使用标准细胞培养方法维持和收获。
球状体形成的初始接种密度取决于细胞类型、球状体形式的生长期持续时间以及分析时球状体所需尺寸等因素。为更好地评估球状体的形成和生长,使用 96 孔球形微孔板在每孔 100 µL 生长培养基中以 40、200、1,000、5,000 和 10,000 个细胞的密度进行接种。通过CellTiter-Glo® 3D细胞活力测定法在 0、24、48 和 72 小时分别对球状体培养物进行分析。上述所有细胞系采用同一接种方法。
- 收获细胞(保证健康的单细胞悬液)。
以300 x g离心细胞悬液 5分钟并吸出上清液。将细胞重悬于少量培养物中,例如 3-5 mL 的 3dGRO™ 球状体培养基 ( S3077 )
注:可让细胞穿过40 µM细胞过滤器或带细胞过滤器卡扣盖的5 mL 圆底聚苯乙烯试管,以实现单细胞悬浮。
- 计数细胞 (PHCC360KIT),并用 3dGRO™ 球状体培养基调节其体积,为每个接种密度(表 1)准备 5 mL 稀释液,以便每个时间点的每个接种密度可接种 8 个孔(四个 96 孔球形微孔板)。

表1.接种密度制备
- 将 100 µL 细胞悬液分装至孔中,每个浓度的8 个孔。对照孔分别加入 100 μL 的无细胞3dGRO™ 球状体培养基。
注:球形微孔板可以使用多通道移液管手动接种,或使用液体进样针自动接种*。对于 96 孔和 384 孔球形微孔板,仅需手动添加液体。1536 孔球形微孔板建议采用自动液体进样。
~undefined 在手动接种过程中,请确保移液管吸头不会刮伤孔的底部或侧面,以免损坏 Corning® 超低附着表面涂层。
~undefined如果使用自动液体进样器,请增加稀释体积以考虑灌注仪器体积和管道的长度 (10 mL)。 - 将球形微孔板置于设置为 37 °C 和 5% CO2 的加湿培养箱中。
- 观察评估 0、24、48 和 72 小时时间点的球状体形成和生长,并进行细胞活力测定。如实验设计时间更长,每 3-4 天更换一半培养体积的新鲜 3dGRO™ 球状体培养基。不要像传统二维细胞培养一样一次性更换所有培养基。
培养24小时,细胞形成松散聚集的多细胞球状体。培养48小时,所有细胞(除了MCF7)均形成紧密实在的球状体。培养72小时,低密度接种(<5,000 cells/孔)的HT-29和A549球状体略有变大,但DU 145和MCF7球状体在培养48小时后没有变大。
观察成像
通过倒置显微镜进行显微镜检查,并在每个时间点对所有五个接种密度的球状体进行拍照,采用图像分析软件对图像进行分析以测量结构在面积上的改变,以评估3D球状体的形成和生长。
注:图像可采用ImageJ 等免费软件进行分析,如下所示。其他图像分析软件也可通过配置以达到同样的测量目的;请向相应的软件供应商咨询相应的功能和使用方法
1.采用4X物镜对已知尺寸(如1mm)进行拍摄并在ImageJ中进行像素测量
- 打开图片。进入File/Open并选择图片。
- 选择线工具。
- 画一条线长度的对象。
- 进入Analyze/Measure并记录像素数。
- 计算每mm的像素数(如600像素/mm)。记录结果------- 像素/mm。
- 进入Analyze/Set Scale。
- 在“Distance in pixels”中输入步骤1.4中的值(上方)。
- 在“Know distance”中输入"1,000"。
- 在“Unit of Length”中输入“um”。
- 勾选“Globa”l并选择“OK”。
- 打开图片。进入File/Open并选择图片。
- 转换成8字节图片: 进入Image/Type/8 bit(勾选)。
- 调整图片阈值。进入Image/Adjust/Threshold(勾选)。该程序将会对暗和明像素进行区分,而阈值则会通过滑动标尺而在柱状图上发生调整。相似的调整可同样适用于相同条件下拍摄的照片。暗像素的区域将会被红色覆盖。调整阈值使得仅有球状体图像被覆盖。
- 选择球状体。选择圆形工具并对图像进行环绕。这会使得球状体之外的任何暗像素从测量中去除。
- 进入Analyze/Measure。这会在表格中对球状体结构的面积(μm2)进行测量。在一张表中更可进行多重测量。保存表格。
- 将表格转换至Excel工作表中。打开Excel并“另存为”.xls或.xlsx文件。

图 1.用于球状体扩张分析的处理。A) 捕获图像并转换成8字节;B) 设置阈值以捕获整体的结构;C) 选择结果以计算总面积。

图 2.MDA-MB-231乳腺癌细胞的球状体生长。在球状体形成EMC的存在下每孔接种3,000个细胞并在37 °C, 5% CO2条件下培养72小时。此时,加入50ul的完全培养基至每孔中,并将球状体置于37 °C、5% CO2孵育。每隔24小时对球状体进行拍照并使用ImageJ软件对图像进行分析面积的变化。
荧光分析
1.每孔中加入十分之一体积(每100 ul加入10 ul)的刃天青并将培养板返还至37 °C细胞培养箱中。
2.在第1至4小时内每1小时用激发波长530-560 nm/散射波长590 nm进行荧光读取。最佳的读取可提供最大的动态范围、最佳的线性度以及最小的标准偏差。
3.对数据进行作图。
细胞增殖检测
用MTT细胞生长检测试剂盒(CT01)检测增殖情况,用AldeRed ALDH检测试剂盒(SCR150)分析醛脱氢酶 (ALDH)表达情况。
肿瘤干细胞表达醛脱氢酶(ALDH)水平升高。AldeRed™ ALDH检测试剂盒可使用ALDH红移荧光底物基于醛脱氢酶(ALDH)表达进行活肿瘤干细胞鉴定和分离,允许同时使用包括GFP细胞系在内的绿色荧光报告物。
1. 干燥AldeRed 588-A试剂重悬在DMSO中,通过添加2N HCl活化。
2. 将每个细胞样本悬浮在分析缓冲液中,并添加AldeRed 588-A试剂。
3. 立即将样品分成两管,其中一管含有DEAB,一种ALDH抑制剂。在37℃下进行反应30分钟,然后在检测缓冲液中洗涤一轮。
4. 在配有蓝和/或绿激光的血细胞计数仪器上使用PE和/或PE-TexasRed检测器(Guava, Muse, ACEA Novocyte, Beckman)执行AldeRed 588-A检测。

图3。当肿瘤细胞在3D肿瘤球培养5代后,在3dGRO™球体培养基中生长时,A ALDHhigh肿瘤干细胞群的富集发生。
细胞活力检测
按照CellTiter-Glo® 3D细胞活力检测方案进行。简要来说,解冻CellTiter-Glo® 3D试剂,花30分钟时间让试剂和检测板平衡到室温。
按1:1稀释比例(表2)将CellTiter-Glo® 3D试剂加到孔中。将微孔板在轨道微孔板振荡器上振荡5分钟混匀溶液,接着在室温孵育,总耗时30分钟。孵育后,用微孔板检测仪读取发光信号。
注意:对于0时间点(细胞为悬液形式),微孔板振荡时间设为2分钟,读取信号前的总孵育时间设为10分钟。
球形微孔板规格
 表2.推荐检测体积
表2.推荐检测体积细胞活性测定:
· 观察到HT-29和A549球状体的持续生长。
· 观察到MCF7和DU 145球状体的生长抑制。
· 大球状体(初始接种密度为5000和10000)没有出现小球状体的线性连续生长。

图4. 细胞活性测定

表3.球形微孔板生成的多细胞球状体
提示和技巧
一些细胞,例如 E3006AA 细胞,在未传代或者在前几次传代中表现出生长抑制或附着于三维培养板上,但后期将适应三维培养环境并在约第 3 次传代后再次增殖。所以对于这些细胞,在以上肿瘤成球实验方案基础上,应额外增加传代步骤。
- 在肿瘤球状体培养基开始形成深色中央区之前将其传代。根据所使用的细胞类型,最佳传代应在 4-10 天后完成。
- 用血清移液管将细胞和培养基转移到 15 mL 锥形管,采集肿瘤球状体。
- 让肿瘤球状体在室温下重力沉降 10分钟。吸出上清液,但在锥形管中保留约 200μl。注意不要吸出肿瘤球状体。
- 用等体积PBS ( D8662 ) 重复步骤 7-8。轻轻吸出 PBS,在锥形管中留下约 200μl。
- 向肿瘤球状体中加入 1 mL 胰蛋白酶-EDTA ( T3924 ) 溶液,室温反应 2–4分钟。每 30 秒上下移液一次,使肿瘤球状体重悬于胰蛋白酶溶液中。避免肿瘤球状体沉降。
注意:用户必须根据经验确定完全解离每种细胞所需的最佳反应时间。虽然在大多数情况下 2-3分钟最佳,但某类细胞的肿瘤球状体,例如 MCF-7,可能需要更长的反应时间——特别是在传代多次以后。如果您青睐完全明确的解离过程,可根据供应商的说明使用重组胰蛋白酶 ( T3449 ) 溶液作为替代解离试剂。 - 用 1000μl 移液管上下吹打肿瘤球状体 10-20 次,以生成单细胞悬液。正常吸出细胞悬液,但在排出细胞时,将吸管尖端在管底略微倾斜。产生的剪切力可促进所有残余细胞聚集体分解。进行肉眼检查,确认无大细胞聚集体残留。研磨后立即加入两倍体积的胰蛋白酶中和溶液 ( T6414 ) 或培养基。
注意:不要过度研磨,以免影响细胞活力。通过 40 μm 细胞过滤器过滤细胞悬液,可以除去未解离的细胞聚集体。 - 测定细胞数量和活力。以300 xg 离心细胞 5分钟。弃去上清液,将细胞以1X106个细胞/ml的密度重悬于新鲜的 3dGRO™ 球状体培养基中。
- 在全新的 Corning® 超低吸附多孔板上以 1X104 个细胞/ml 的密度重新接种细胞。

图 5.肿瘤成球实验方案概述
TROUBLESHOOTING GUIDE
| 问题 | 可能原因 | 建议解决方案 |
| 细胞未形成球状体 | 细胞健康状况不佳 | 在球状体形成之前评估细胞倍增率并检查细胞活力。 |
| 细胞系不能形成球状体 | 可能存在某些上皮来源的癌细胞系可能不形成球状体。该方法学可能与该细胞系不兼容。 |
材料