超微量外泌体蛋白质组突破用量极限和检测上限-低至200μL血浆!高达4000+ EV蛋白!
北京恩泽康泰生物科技有限公司
PART.1 外泌体蛋白质功能
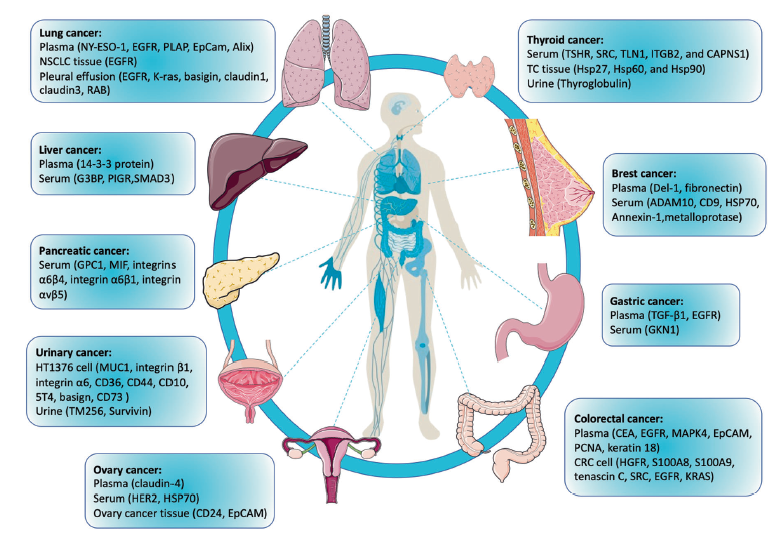
多种肿瘤中外泌体蛋白作为标志分子
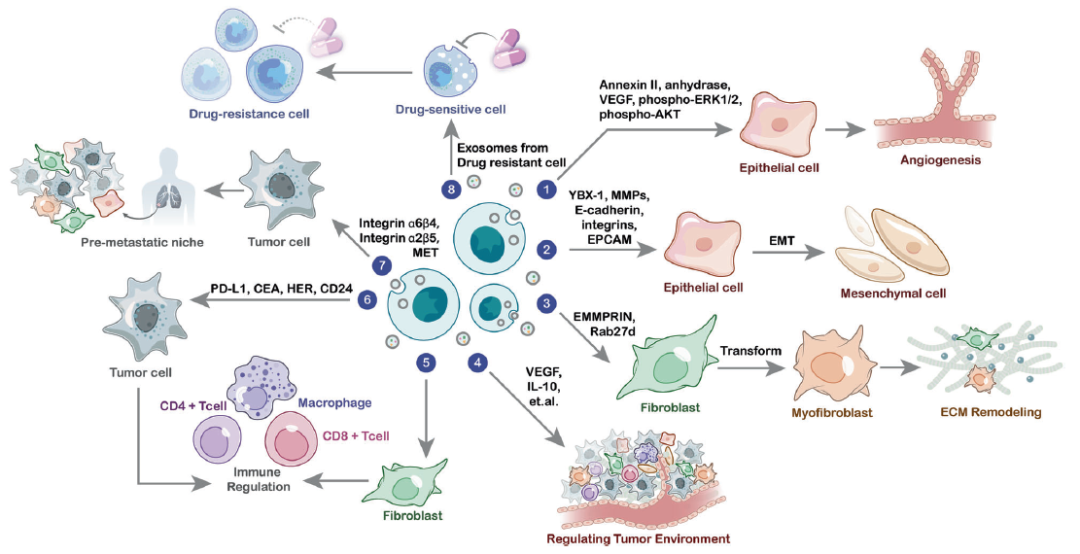
外泌体蛋白在癌症中发挥的生物学功能
参考文献:
为了聚焦于特定细胞/疾病的sEV,鉴定该细胞/疾病特征的sEV表面蛋白至关重要。基于质谱的蛋白质组学被广泛用于sEV蛋白的鉴定和定量。用于分离sEV的方法、sEV蛋白质组学的制样方法和质谱检测分析方法可能对结果产生强烈影响,需要仔细考虑。

外泌体蛋白质组技术流程

一系列分泌型纳米颗粒的大小与密度图
共分离的蛋白质(例如,血液中的高丰度蛋白质或脂蛋白颗粒)会限制sEV蛋白质的检测灵敏度,并使数据解释复杂化,sEV纯度是决定sEV蛋白质组学实验成功的最重要因素,因此需要额外关注sEV的分离方法。分离sEV通常利用其物理特性,包括大小和密度,或其生物特性,如表达的抗原。最常见的sEV分离方法包括差速超速离心dUC、密度梯度离心DGC、尺寸排阻色谱SEC、聚合物沉淀、免疫亲和捕获IAC,以及最近的不对称流场分级AF4和微流控。一个关键的考虑因素是样本类型,比如血清/血浆中含有许多与sEV尺寸相似的辅因子,如极低密度脂蛋白VLDL和中密度脂蛋白IDL,以及丰富的蛋白质。单纯基于尺寸的分离方法不足以从其他血浆/血清颗粒和分子中分离出高纯度的sEV。据报道,通过组合方法,特别是差速超速离心和密度梯度离心可提高sEV纯度,但这种组合通常需要更大的样品体积和更多的处理时间,这2个特征与临床研究不太兼容,在临床研究中,每个患者的血浆/血清体积有限。

外泌体分离方法
基于质谱的蛋白质组学是研究sEV蛋白质含量的首选方法,因为它具有极高的灵敏度和同时量化许多蛋白质的能力。蛋白质组学是一个不断发展的领域,其特点是仪器、方法和生物信息学方法的方法学快速发展。sEV蛋白质组学最广泛使用的工作流程是基于sEV蛋白质提取物的蛋白水解消化,然后使用纳米级液相色谱(nLC)结合串联质谱(MS/MS)分析蛋白水解肽,称为LC-MS/MS。随着样品量的减少,表面吸附损失是一个非常严重的限制微量样本蛋白质组研究的挑战。近来以极低蛋白质量为特征的样品蛋白质组学研究取得了许多进展,已经开发了几种能够针对有限样品量的质谱前处理制备方法,如phase-enhanced sample preparation (SP3)、in-stage Tip (iST) 、FASP、suspension trapping (STrap)和nanoPOTS等,目的在于:使许多/所有样品处理步骤都在单个局部空间内进行,从而避免了样品转移及导致的相关多肽/蛋白质损失。

质谱前处理样本制备方法
直到几年前,大多数蛋白质组学实验都是使用数据依赖性采集(data-dependent acquisition,DDA)方式进行的,其中在MS1中检测到的更强的肽离子在MS2中被自动选择、片段化和分析。肽电离的随机性导致离子强度的可变性,从而导致选择离子用于MS/MS的可变性以及MS/MS谱图的质量(信息含量)的可变性。最终结果是,来自不同生物样本的数据集没有识别和量化同一组蛋白质;或者换句话说,DDA模式的lable-free定量蛋白质组学数据集将包含很多缺失值,并且这主要影响较低丰度的蛋白质。近年来,数据非依赖性采集(data-independent acquisition,DIA)技术出现,指定m/z范围内的所有前体离子都同时进行MS碎片化,复杂的MS2谱图与包含碎片离子谱图、前体离子精确质量及其归一化保留时间的谱图库搜库比对。DIA在增加已鉴定肽的数量、提高定量精度和增加重现性方面具有显著优势,因此是目前深入蛋白质组学分析的首选方法。

质谱数据采集方法
参考文献:
针对上述难点与挑战,恩泽康泰自有妙计,3招制敌,突破血浆等微量样本用量极限,提升血浆等复杂样本外泌体蛋白检出数目上限!
如前所述,sEV纯度是决定sEV蛋白质组学实验成功的最重要因素,因此需要额外关注sEV的分离方法。恩泽康泰针对微量外泌体蛋白质谱研究,打造了多元外泌体分离平台:SEC+UF、UC、SEC+UC、磁珠法等。
1)针对复杂的血浆样本的外泌体蛋白质组学研究,恩泽康泰采用排阻色谱(SEC)联合超速离心(UC)的分离方法,与常规UC或SEC分离血浆sEV进行质谱研究头对头对比,相关研究发表在《Biological Procedures Online》,结果表明SEC+UC从血浆中分离出高纯度的外泌体,进而可检出更多的外泌体蛋白,不仅包含了之前鉴定到的sEV相关蛋白,还包含了一些之前没有检测到的与基因转录、mRNA剪接、血小板激活相关的蛋白。因此,SEC和UC的结合可以极大地改善血浆sEV的蛋白质组学分析。参考文献: Biol Proced Online. 2020 Jun 23;22:12.

SEC+UC有效提升血浆外泌体分离纯度及质谱检出数目
2)恩泽康泰适配于下游蛋白质谱,引入磁珠法外泌体分离方案:利用功能性修饰的磁珠特性以捕获总外泌体;针对复杂的血浆样本,在磁珠捕获法的基础上进行改良优化,添加抗体特异性捕获EVs表面标志性蛋白阳性的囊泡;磁珠法分离外泌体适合超微量样本direct-DIA蛋白质谱。
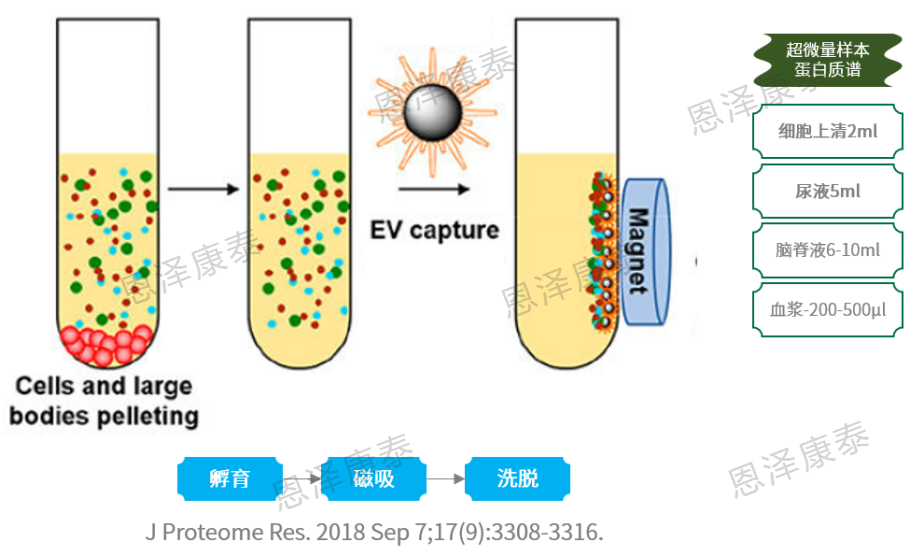
磁珠法分离外泌体原理
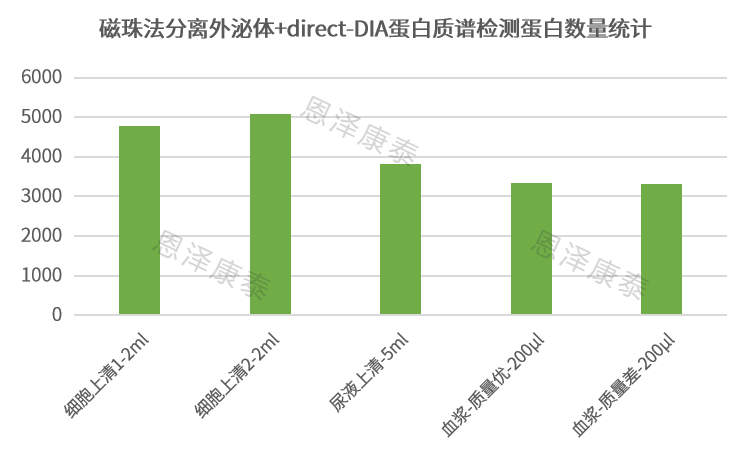
磁珠法分离外泌体+direct-DIA蛋白质组检出3000+血浆外泌体蛋白!
随着样品量的减少,表面吸附损失是一个非常严重的限制微量样本蛋白质组研究的挑战。因此基于使许多/所有样品处理步骤都在单个局部空间内进行的方法,可避免样品转移及导致的相关多肽/蛋白质损失。恩泽康泰引入集成化设计色谱小柱,蛋白质在上层离子交换填料中实现预富集,去除污染物及快速酶解为多肽;多肽经高浓度盐溶液转移至下层反相色谱填料中进行除盐及洗脱;预富集促进快速酶解,集成化设计可有效减少样品损失,多种溶剂清洗可保证获得干净的多肽。通过该方法将外泌体裂解蛋白起始量降低至5μg,质谱前处理后采用布鲁克timsTOF平台进行direct-DIA,可稳定检出2500-3500+血浆EV蛋白!!!

微量蛋白质谱前处理样本制备方案
DDA模式的lable-free定量蛋白质组学(LFQ)数据集将包含很多缺失值,影响较低丰度的蛋白质的检出。因此近年来DIA技术飞速发展与应用,其鉴定的蛋白总数多于LFQ,能鉴定到更多的低丰度蛋白,重复性高,一般来说在后续进行PRM验证,成功率也高于LFQ。目前DIA技术基本已经可以取代传统基于DDA模式的LFQ,direct-DIA是利用机器深度学习实现直接通过搜索DIA原始文件谱图生成库,深度学习打分寻找谱峰碎裂规律,预测保留时间,去除假阳性结果,更经济且蛋白检出数目优于LFQ。恩泽康泰引入了基于布鲁克和赛默飞平台的4D direct-DIA和普通direct-DIA蛋白质组平台,以期为广大临床科研工作者提供更好的大队列样本外泌体蛋白质组研究服务体验,血浆外泌体蛋白检测数目达2500-3500+!
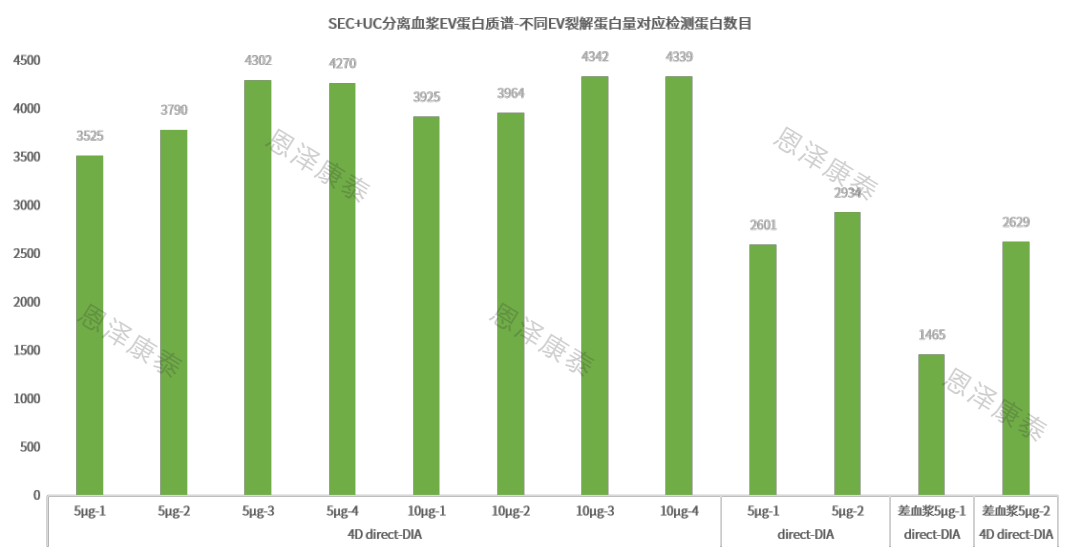
血浆样本direct-DIA检测结果展示
1)SEC+UC分离血浆外泌体后,取5μg EV裂解蛋白经微量质谱前处理后,direct-DIA蛋白质组检出1500-4300个血浆EV蛋白!
2)布鲁克平台4D direct-DIA结合了4D和DIA的优势,其检测效果优于塞默飞direct-DIA检测蛋白数量:优质血浆EV 3500+ vs 2600+!
3)血浆质量也是决定质谱检测效果的关键因素,对于4D direct-DIA检测差血浆EV 2600个蛋白 vs 优质血浆EV 3500+蛋白;对于普通direct-DIA检测,质量较差血浆EV检测到1400个蛋白 vs 优质血浆EV 2600+蛋白。一定要注意血浆样本的采集与保存!
您可能会有疑问,只是检测到蛋白数目多了,是不是外泌体相关蛋白呢?我们来看一下外泌体标志蛋白丰度排名对比!下图表明恩泽康泰微量外泌体蛋白质谱检测结果,外泌体标志蛋白整体排名和数量远远优于常规lable-free蛋白质组检测结果,质量可靠!
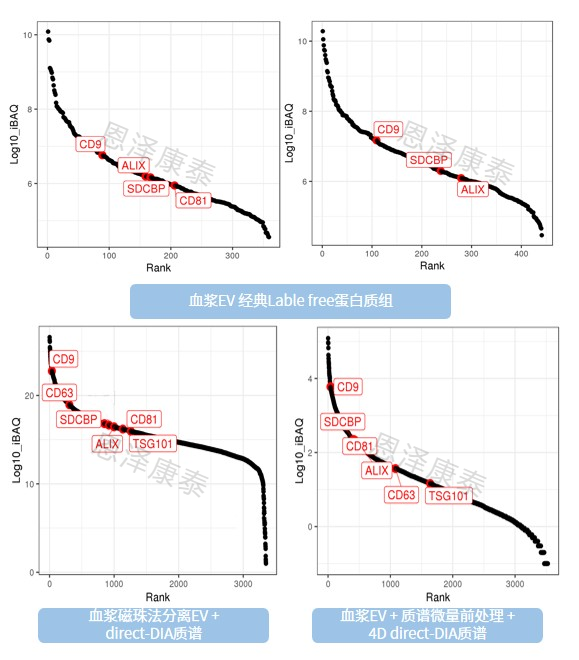
不同外泌体蛋白质组结果外泌体标志蛋白排名展示
总之,常规血浆外泌体lable free蛋白质组,采用不同的外泌体分离方案大约可检测到200-1000个蛋白左右,恩泽康泰微量外泌体蛋白质谱平台,在血浆外泌体蛋白质组检测方面实现了量的突破和质的飞跃,5μg EV裂解蛋白检出2600-4000+蛋白,仅需要0.2-0.5ml血浆!细胞上清、尿液等恩泽康泰也进行了相关测试,更多数据,以及想尝鲜的老师请咨询恩泽康泰!
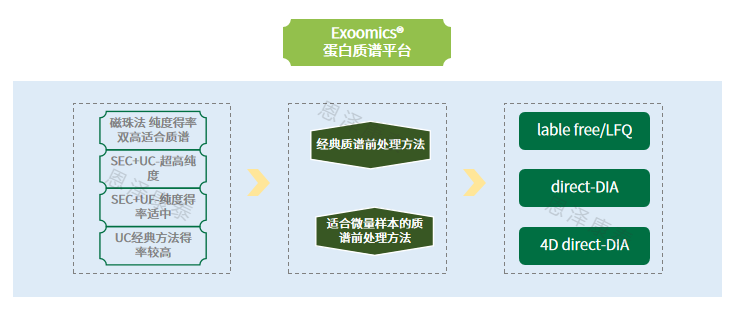
恩泽康泰Exoomics®蛋白质组学平台