文献解读:一个表格让你全懂 PKH 标记外泌体!
天九再生医学(天津)科技有限公司
PKH标记外泌体过程中形成了大量PKH纳米颗粒,在大小,表面积和荧光强度方面与标记的外泌体几乎没有区别。同时,PKH26纳米颗粒会被原代星形胶质细胞吞噬到与PKH26标记的外泌体相似的亚细胞区室。总之,PKH类染料用于外泌体标记会导致假阳性信号,并严重影响外泌体的鉴定和细胞摄取实验的真实性。
- 常用方法不能有效去除PKH纳米颗粒,且外泌体损耗大
- 残留的PKH颗粒会造成细胞摄取假阳性结果
PKH染料,如PKH67和PKH26,是高荧光、亲脂性的长链羰花青染料,目前被应用于细胞外囊泡(EVs)及其功能的研究,有研究评估了PKH在研究EV摄取时的适用性,发现PKH标记会显著影响外泌体细胞摄取结果的真实性,引入假阳性结果[1]。
不同纯化方法去除PKH
已有共识的是,PKH标记EV会引入PKH颗粒杂质,Lai等人[2]首先发现非EV的PKH阳性结构的存在,他们表明用仅PKH67对照组比PKH67染色的EV样品具有更大的荧光信号。在上篇文章中,我们论证了PKH标记外泌体后对外泌体粒径分布的影响,以及引入了大量非外泌体PKH荧光颗粒,那么这种PKH纳米颗粒,可能经过纯化去除吗?
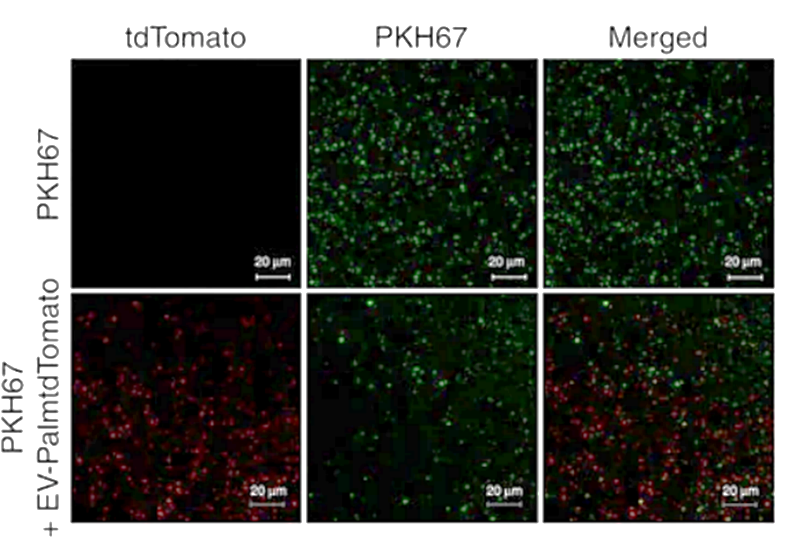
Fig.1 PKH67和tdTomato标记的EV共定位
无论使用何种纯化手段,PKH26标记的无外泌体对照中均检测到了不同程度的PKH26阳性颗粒。文章设置了“PKH26标记外泌体”和“PKH26+无颗粒DPBS”(对照)两组实验,分别使用了超速离心法、超滤法、蔗糖垫超离法、蔗糖垫密度梯度离心法对PKH标记外泌体后进行纯化,并经过共聚焦显微镜、AF4-MALS、DLS、NTA多维度表征纯化后的PKH颗粒残留及其荧光影响,结论如下:
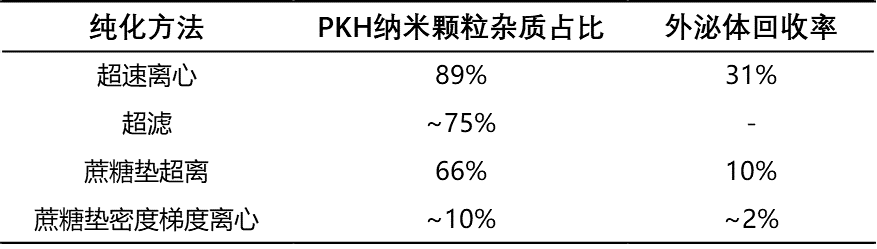
表一:不同纯化方法的PKH杂质占比与外泌体回收率
以下是各方法详细信息:
超速离心
过程和结果:
-
纯化操作:4°C ,100,000 ×g离心1h。
-
纯化后PKH颗粒/总颗粒:89%
-
PKH颗粒组与被PKH标记外泌体组荧光颗粒表面积:相似
-
PKH颗粒组与被PKH标记外泌体组荧光强度:相似
-
外泌体回收率:31%
结论:超速离心完全无法用于PKH标记外泌体后PKH颗粒杂质的去除,标记后的超离纯化引入了远超纯PKH对照的非外泌体颗粒,标记后颗粒数浓度从3.85 × 1010 particles/mL 上升到10.7 × 1010 particles/mL(表1),而未添加外泌体的PKH纳米颗粒为0.75 × 1010 particles/mL。简言之,超离本身会使PKH聚集成纳米颗粒,而“PKH+外泌体”混合物的超离,会引入远超过纯PKH超离的纳米颗粒,具体原因不明确,或许与超离过程中破裂的外泌体膜与PKH形成了更多难分离的纳米颗粒有关。
表2:超离与蔗糖垫超离的AF4-MALS参数
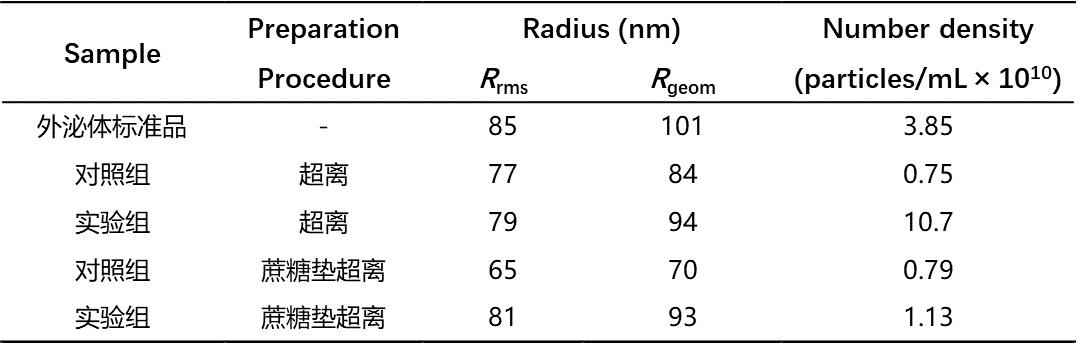
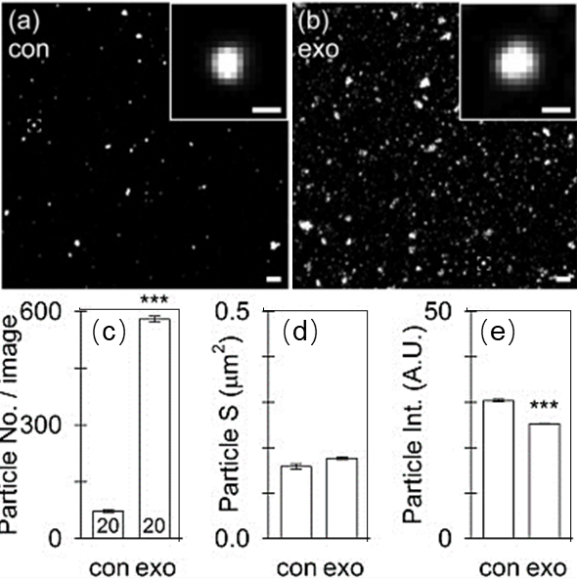
Fig.2 超离纯化后荧光颗粒的共聚焦成像(a)、荧光颗粒数(b)、表面积(c)和荧光强度(d)
超滤
过程和结果:
-
纯化操作:300 kD超滤,3次。
-
纯化后PKH颗粒/总颗粒:约75%(基于共聚焦)
-
PKH颗粒组与被PKH标记外泌体组荧光颗粒表面积:含外泌体组高
-
PKH颗粒组与被PKH标记外泌体组荧光强度:含外泌体组高
-
外泌体回收率:颗粒数过低,难以评价
结论:超滤法同样无法作为PKH标记外泌体后的纯化手段,由于超滤对外泌体的损耗过大,纯化后外泌体无法达到AF4-MALS检测限,因此无法得到纯化后PKH颗粒/总颗粒以及外泌体回收率的相关数据。
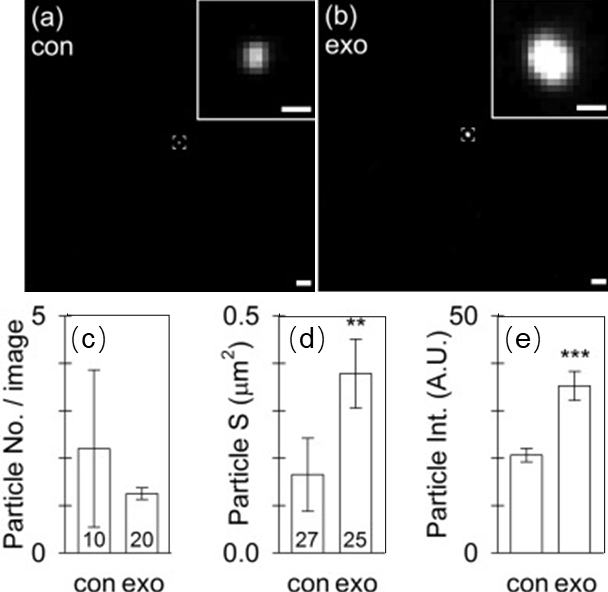
Fig.3 超滤纯化后荧光颗粒的共聚焦成像(a)、荧光颗粒数(b)、表面积(c)和荧光强度(d)
蔗糖垫超速离心
过程和结果:
-
纯化操作:20%蔗糖, 4°C,100,000 ×g离心1h。
-
纯化后PKH颗粒/总颗粒:66%
-
PKH颗粒组与被PKH标记外泌体组荧光颗粒表面积:相似
-
PKH颗粒组与被PKH标记外泌体组荧光强度:相似
-
外泌体回收率:10%
结论:蔗糖垫超速离心对PKH的去除效率高于普通超速离心,然而外泌体的回收率仅10%,仍然不适合作为标记后染料的去除手段。
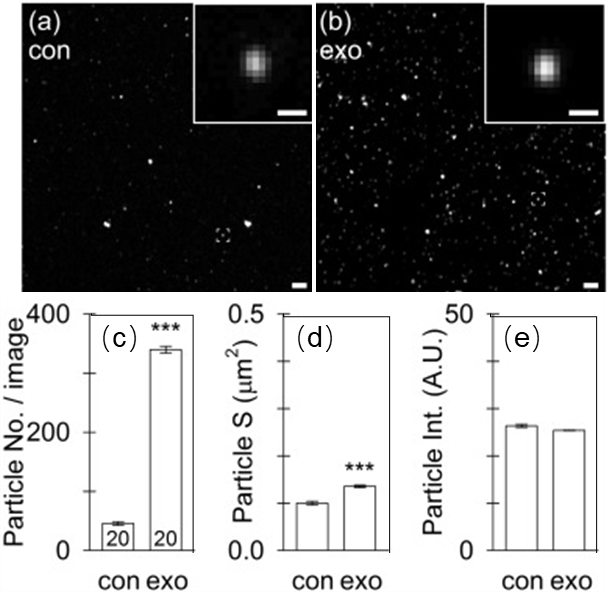
Fig.4 蔗糖垫超离纯化后荧光颗粒的共聚焦成像(a)、荧光颗粒数(b)、表面积(c)和荧光强度(d)
对比超速离心法和蔗糖垫超速离心法,AF4-MALS显示后者更高的分离效率可能是源于经过此方法纯化的PKH纳米颗粒和外泌体颗粒存在相对明显的粒径差异。
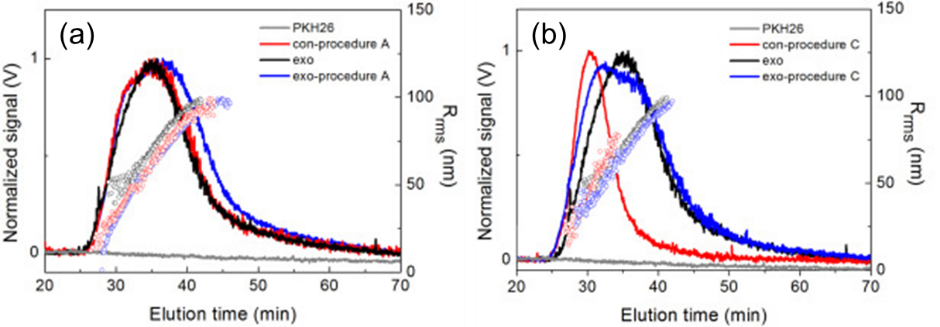
Fig.5 超离(a)和蔗糖垫超离(b)纯化后AF4-MALS分析
蔗糖垫密度梯度离心
过程和结果:
-
纯化操作:参考文献[3]
-
PKH颗粒/纯化后总颗粒:10%
-
PKH颗粒组与被PKH标记外泌体组荧光颗粒表面积:相似
-
PKH颗粒组与被PKH标记外泌体组荧光强度:相似
-
外泌体回收率:2%
结论:蔗糖垫密度梯度离心技术上可以实现体系中PKH纳米颗粒杂质的分离,但是极低的外泌体回收率(2%)以及复杂的操作流程大大限制了其应用。下图分别为组分3-6(a-g)与组分7-10(h-n)收集的样品共聚焦分析结果,轻组分为PKH纳米颗粒,重组分为PKH标记的外泌体,可以得到有效区分。
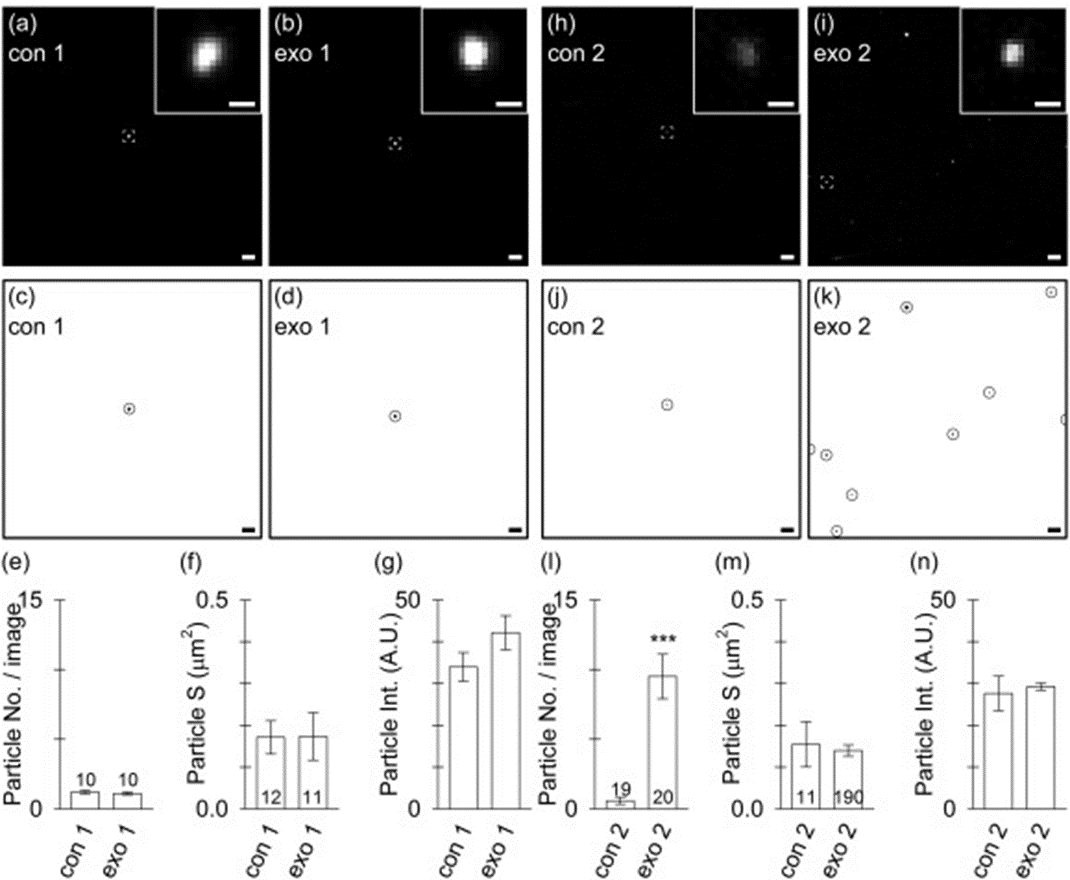
Fig.6 蔗糖垫密度梯度离心纯化后组分3-6(a-g)与组分7-10(h-n)收集的样品共聚焦分析
未除尽的PKH颗粒在细胞摄取时的影响
为了研究残留的PKH26纳米颗粒对外泌体细胞摄取实验的影响,选择蔗糖垫超速离心为纯化方法,以星形胶质细胞为模型测试其摄取PKH26纳米颗粒的能力。结果发现,被PKH标记的外泌体与PKH26纳米颗粒都定位在相似的亚细胞区室中,并且在细胞质中可见为许多荧光点。
为了验证被标记的PKH外泌体与PKH纳米颗粒均是通过内吞方式进入细胞,实验设计了荧光葡聚糖(Dex)与PKH荧光共定位,证实了由于体系中难以除尽的PKH纳米颗粒干扰,会带来虚假的非外泌体荧光信号,并在外泌体的细胞摄取实验中引入与真实外泌体极为相似的摄取结果。
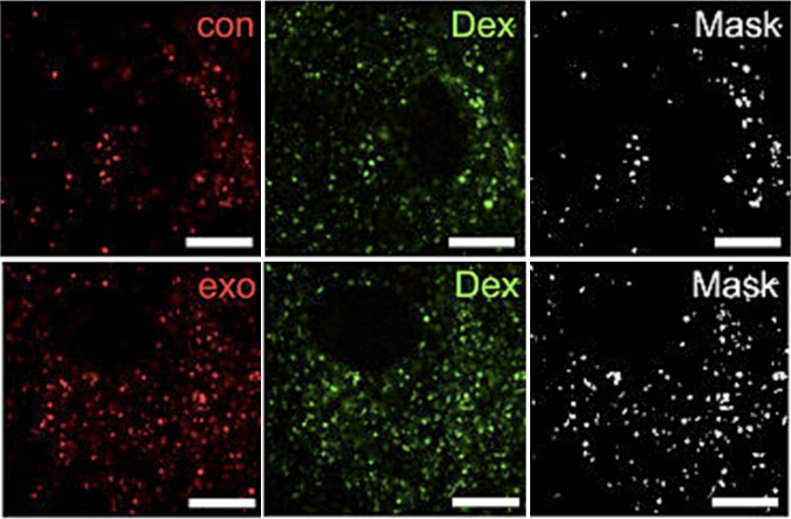
Fig.7 PKH与Dex双标记被标记星形胶质细胞的共聚焦显微照
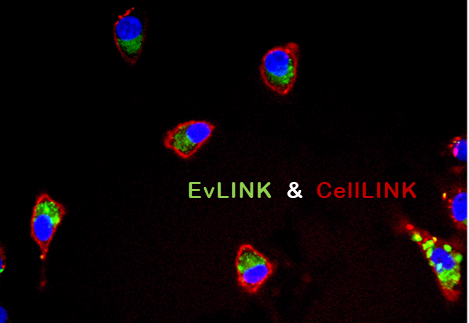
EvLINK是天津外泌体研发的膜特异性外泌体荧光探针,该探针具有不聚集、不弥散、不二次标记、易去除的特点,完美解决PKH等亲脂性染料带来的假阳性问题,现已经广泛应用于各种场景的外泌体标记。
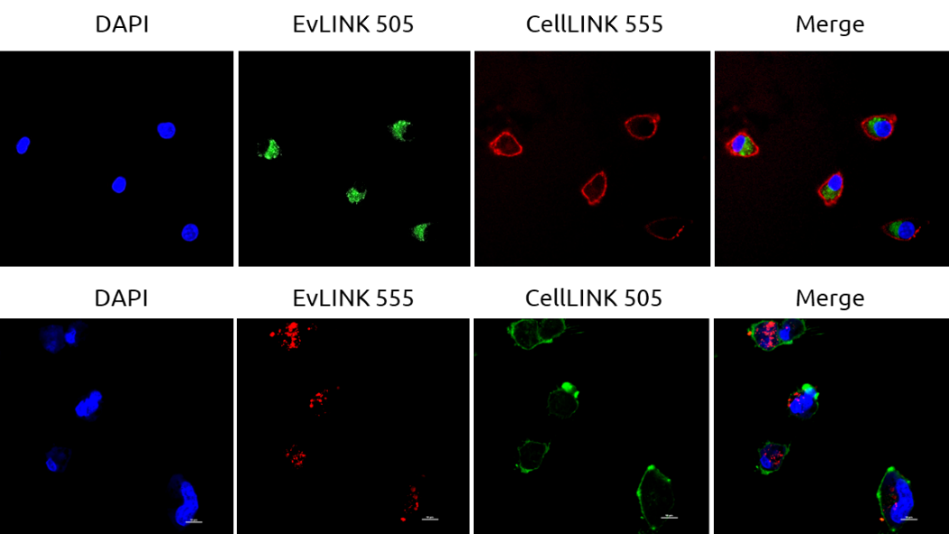
Fig.8 EvLINK 505标记的牛奶外泌体被CellLINK 555标记的A549细胞摄取