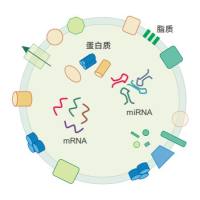
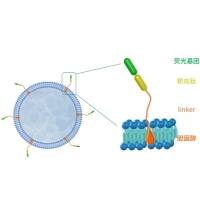
1、如何增加外泌体试剂盒的提取效率?
答:首先,样品准备阶段确保样品的质量和数量充足;在提取阶段,加入 ECS 试剂后可以通过增加静置时间来提高提取效率,但同时也可能影响到纯度,因此静置时间也需要适当控制,初次实验可以考虑静置过夜。
2、离心后无法看到沉淀如何处理?
答:样品中的外泌体是微量的存在,离心后无法看到沉淀属于正常现象。建议离心后用 PBS重悬沉淀时不仅洗脱肉眼可见的沉淀部位,还要吹洗离心管外侧靠近底部的狭长区域,具体位置根据离心机倾斜角度决定。建议在下次样品准备阶段确保样品的质量和数量充足,干细胞/原代细胞上清可在提取前采用超滤管(100KD)浓缩 3~5 倍后再提取。
3、使用EPF柱时堵塞如何处理?
答:过滤柱的孔径在 220nm 左右。如果出现堵塞情况,可以将柱子旋转 180 度再次离心。若上室还有残留液体,需要使用新的 EPF 柱,该柱子可以单独购买(货号 UR90102)。
4、沉淀法的具体原理是什么?
答:将高亲水性聚合物(聚乙二醇等)添加到含外泌体的溶液中后,外泌体周围的水分子被聚合物束缚,降低了外泌体的溶解度并诱导其随后的沉淀,使外泌体在低速离心下可以很容易沉淀。
5、开封后的 ECS 试剂有沉淀出现是否可以继续使用?
答:沉淀物如果是结晶状,建议 56 度水浴摇晃混匀。如果结晶消失,则可以继续使用,少量沉淀不影响提取效果。
6、乳液提取试剂盒加 solution B 之后无豆花状固体,此时是否可以继续实验?
答:不可以,必须在明确看到豆花状沉淀,溶液变透明后才可进行下一步操作。此时需要继续加入适量 solution B,并在 37 度水浴加热,直至看到豆花状沉淀。
7、如何选择血清和血浆样本来进行外泌体研究?
答:血清和血浆都是常见的外泌体样本来源。由于血液在凝血过程中血小板会受到刺激会产生大量外泌体,因此若需要排除血小板外泌体的影响应采用血浆进行外泌体提取检测。
8、出现溶血现象的血清/血浆样本对外泌体提取有什么影响?
答:破碎的细胞会释放一些杂质影响下游实验,尤其是电镜鉴定。溶血样品里的外泌体也会降解。溶血样品不建议用于外泌体提取。

9、试剂盒可以提取多少血清/血浆样本的外泌体?
答:UR52151/UR52150 试剂盒一共可以提取 20 个样本的外泌体,每个样本最大体积为1mL。建议使用 0.5mL 体系进行实验,在 EPF 柱纯化外泌体阶段再进行样本合并。
10、组织提取试剂盒如何提高得率?
答:加入 solutionA2 后可以增加消化时间,不超过 1 小时;加入 solutionB2 后可以增加静置时间,不超过 1 小时。
11、Western Blot 报告中 PC 条带是何种蛋白?
答:PC 是系统样品,用于指示本次Western Blot检测系统是否正常工作。如果 PC 有条带,目的样品无条带,说明目的样品的目的蛋白丰度很低;如果 PC 也无条带,则说明本次实验体系存在问。
12、跨膜蛋白应该使用哪种类型的 loading buffer?
答:跨膜蛋白不建议使用还原性的 loading buffer。
13、外泌体蛋白质标记物为何会有两条条带?
答:在不同的样品中检测到的蛋白条带大小和带数存在差异是正常现象。膜蛋白由于修饰剪切等缘故,可能会出现多条带的状况;不同细胞中修饰剪切等情况不一定相同,因此相同蛋白在不同样品中检出的条带表现可能不同属于正常情况。
14、CD63 是一个多次跨膜蛋白,煮样可能导致蛋白聚集,应该如何判断是否煮样?
答:建议 CD63 进行煮样,温度控制在 70 度,时间为 10min。
15、外泌体 miRNA qPCR 实验选用哪个基因做内参?
答:外泌体 qPCR 目前没有公认内参基因,本公司检测 miRNA 做的是外参。外参可以最大限度降低对定量实验造成的干扰,适用于内参表达不稳定的外泌体或暂未发现合适内参的其他样品,对目的 microRNA 进行相对定量,替代内参作用。部分文献也会选取U6等作为内参。
16、下游 qPCR 检测时 CT 值过高如何处理?
答:外泌体 RNA 是微量的存在,首先样品准备阶段确保样品的质量和数量充足(例如血清建议新鲜样本准备 2ml 以上)。有实验表明,2ml 血清样本提取的外泌体,qPCR 检测 U6(细胞样本 microRNA 内参)的 CT 值只有 30+,目标基因 CT 值在 30+~40+。CT值通常 qPCR 结果在 30 以上默认为不表达,但外泌体比较特殊,可适当放宽标准。
17、外泌体 qPCR 实验如何使用内参?
答:外泌体没有公认内参,常规内参基因在外泌体中表达量甚至可能比目标基因还低。外参是在没有合适内参的情况下的替代物。microRNA 检测外参是化学合成的线虫短片段单链 RNA (cel-miR-39-3p) mimics,经检测在人类、小鼠、大鼠中均无同源片段,最大限度降低了对定量实验造成的干扰,适用于内参表达不稳定的外泌体或暂未发现合适内参的其他样品,对目的 microRNA 进行相对定量。外参序列:ucaccggguguaaaucagcuug。cel-miR-39-3p外参正序列为 AACACGCTCACCGGGTGTAA。
18、外泌体专用培养基是否可用于重悬、接种以及继续培养细胞?
A:不可以。外泌体专用培养基不含促细胞贴壁的因子,可以维持已贴壁的细胞一定时间内的生长,无法替代完全培养基长期培养细胞。
19、干细胞在更换外泌体专用间充质干细胞培养基的过程中,遇到干细胞生长缓慢,甚至死亡的现象,该如何处理?
答:干细胞在更换培养基的过程中,对于培养环境比较敏感,尤其是从高营养环境(血清/HPL添加培养基)更换到低营养环境(化学成分确定培养基)的过程中会遇到干细胞生长缓慢,甚至死亡的现象,这些都是更换培养体系过程中经常遇到的问题。
解决方案 1:提高更换培养基时干细胞的融合度。细胞融合度从说明书中 20% 提高到50%-60% 时,然后更换外泌体专用间充质干细胞培养基,然后在细胞融合度 70%-80% 以上时收集细胞上清液。
解决方案 2:采用的是培养基逐步替换的方法。逐步减少原干细胞培养基的用量和逐步增加外泌体专用间充质干细胞培养基的用量,在干细胞融合度 20% 时,吸取一半的原始培养基,加入一半的外泌体专用间充质干细胞培养基,细胞培养 24 小时后,再替换为完全的外泌体专用间充质干细胞培养基的进行培养。
20、关于外泌体红色荧光标记染料(PKH26/PKH67)相关实验注意事项
a、建议用于染料标记的外泌体原始浓度达到 0.5~1μg/μL。外泌体浓度过低实验失败风险较高。
b、外泌体染色步骤中去除游离染料的第 4、5 步必不可少,以避免游离染料对后期实验的干扰。这一步相当于重新提取外泌体,所有外泌体提取纯化方式都适用。
c、去除游离染料的方法推荐选择 3~10KD 的超滤管,利用其置换溶剂功能去除游离染料。具体步骤和实验参数请咨询超滤管厂商。
d、染料标记外泌体与细胞共孵育的培养条件尽可能使用无血清培养基,以提高细胞对染料标记外泌体的摄取效率,共孵育参考时长为 2 小时。
e、本染料也可用于细胞膜染色,参考剂量染料浓度为 2X10–6 M,细胞浓度为 1X107 cells/mL。
f、基于以下两个原因,建议准备2倍于正常共孵育实验所需外泌体的量来进行染料标记。一是使用过量染料进行标记,外泌体的染色效率仍无法达到 100%;二是去除游离染料的过程中存在外泌体回收率的损失。
21、关于外泌体荧光染料(DIR)相关实验注意事项
a、活体成像对外泌体浓度要求较高,建议用于染料标记的外泌体原始浓度达到 0.5~1.5μg/μL,外泌体浓度过低实验失败风险较高。
b、外泌体染色步骤中去除游离染料的第 4、5 步必不可少,以避免游离染料对后期实验的干扰。这一步相当于重新提取外泌体,所有外泌体提取纯化方式都适用。
c、去除游离染料的方法推荐选择 3~10KD 的超滤管,利用其置换溶剂功能去除游离染料。具体步骤和实验参数请咨询超滤管厂商。
d、DiR 碘化物(DiR 染料)的发射波长肉眼不可见,需要使用配备 CCD 镜头或其他设备的近红外检测仪器,建议使用活体成像仪。
e、建议染料标记的外泌体注在射后 24h 内设置梯度时间进行观测,多数情况注射后 2-8小时荧光强度达到峰值。为保证观察结果,小动物需要做剃毛处理。
f、基于以下两个原因,建议准备 2 倍于正常活体成像和示踪实验所需外泌体的量来进行染料标记。一是使用过量染料进行标记,外泌体的染色效率仍无法达到 100%;二是去除游离染料的过程中存在外泌体回收率的损失。
文章来源:宇玫博生物