施一公团队再获新进展!解析人类 pre-tRNA 剪接机制,完善剪接体结构「地图」
丁香学术
长久以来,剪接体的调控机理是怎样的,它们在细胞内部的动态组合和变化是怎样的,深深地吸引着科学家们的研究兴趣,但其神秘的面纱一直未被揭开。
2023 年 4 月 6 日,西湖大学施一公团队在 Molecular Cell 杂志发表研究论文 Structural basis of pre-tRNA intron removal by human tRNA splicing endonuclease,该研究首次解析了人类 tRNA 剪接内切核酸酶(TSEN)在催化前和催化后状态下与全长 tRNA 前体 (pre-tRNA) 结合的低温电子显微镜结构,显示了 TSEN 如何识别 pre-tRNA,并将 3' 剪接位点和 5' 剪接位点定位到其切割位点,综合利用结构生物学和生化工作解释了人类 TSEN 去除 pre-tRNA 内含子的分子机制。

图 1:来源 Molecular Cell
研究内容
转运 RNA(tRNA)对生物遗传信息的传递至关重要,它通过核糖体将信使 RNA(mRNA)翻译成蛋白质。成熟的 tRNAs 由前体 tRNAs(pre-tRNAs)通过一系列的转录后加工和修饰步骤产生,从 pre-tRNA 中去除内含子对于生物遗传进化是必不可少的。
在人类中,去除 pre-tRNA 中内含子的过程是由 tRNA 剪接内切核酸酶(TSEN)介导的,该亚酶包括四个亚基:TSEN2、TSEN15、TSEN34 和 TSEN54。值得一提的是,尽管多核苷酸激酶 CLP1 在体外对前 tRNA 切割是可有可无的,但 CLP1 中的突变和所有 TSEN 亚基都与 tRNA 代谢和神经病理学的改变有关。
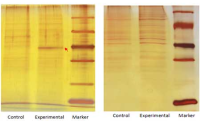
为回答 pre-tRNA 是如何被 TSEN 识别的,以及 5' 剪接位点和 3' 剪接位点是如何被加载到 TSEN2/ TSEN34 的活性位点这两个困扰科研界多年的谜题,本研究通过纯化人 TSEN/CLP1 复合物、pre-tRNA 切割试验、TSEN/CLP1/前 pre-tRNA 复合体的组装、冷冻电镜样品制备和数据采集以及竞争性结合测定生化实验,对其进行深入探索。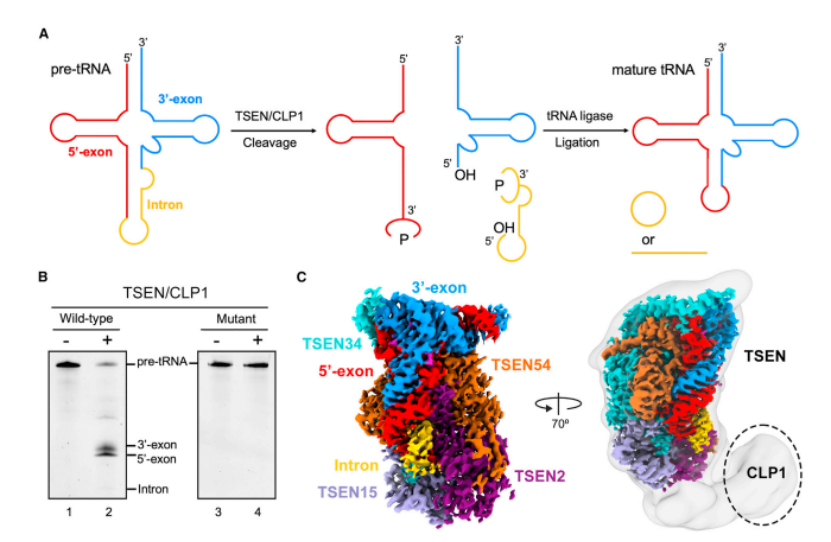
图 2:来源 Molecular Cell
研究结果
本研究首次报道了两种人类 TSEN 与全长 pre-tRNA 结合、高分辨率低温电子显微镜结构:一种在催化前状态,另一种在催化后状态,平均分辨率分别高达 2.94 Å 和 2.88 Å。
研究结果显示人类 TSEN 的结构特征是一个延伸的表面凹槽,容纳了 l 形的 pre-tRNA,pre-tRNA 的成熟结构域被 TSEN34、TSEN54 和 TSEN2 的保守结构元件所识别,这种识别定位了 pre-tRNA 的反密码子茎。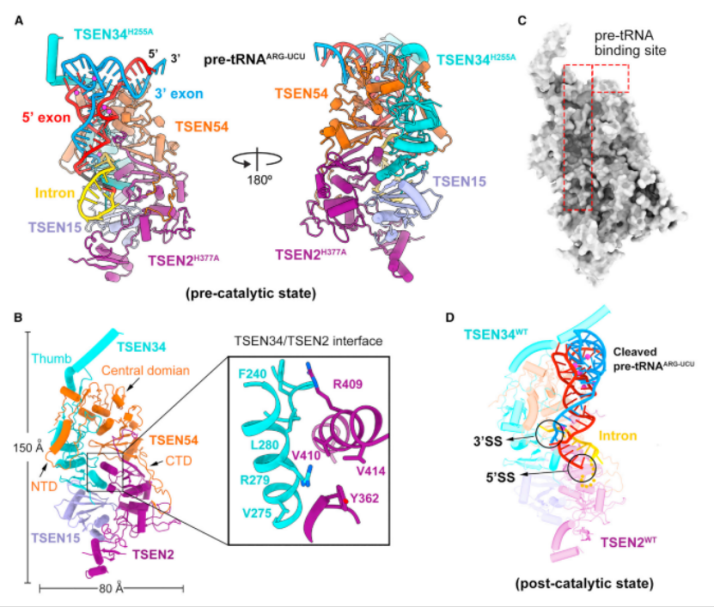
图 3:来源 Molecular Cell
令人惊喜的是,5' 剪接位点和 3' 剪接位点周围的核苷酸主要被 TSEN2 和 TSEN34 识别,这些相互作用可以确保 5' 剪接位点和 3' 剪接位点分别精确地放置在 TSEN2 和 TSEN34 的催化中心中。
此外,为了捕获预催化状态,研究人员在 TSEN 中引入了两个错义突变:TSEN34 中的 H255A 和 TSNE2 中的 H377A,进而研究其结构信息以及结构引导的生化分析,为成功解析人类 TSEN 前 tRNA 识别和切割的机制提供了基础。
考虑到 pre-tRNA 和 tRNA 结构的相似性,TSEN 延伸的扩展表面凹槽也应该识别 tRNA。为证实该分析,tRNAARG-UCU 与 TSEN/CLP1 形成了一个稳定的复合物。与 tRNA 相比,pre-tRNA 可以被 TSEN 识别,其更具体的相互作用指向其独特的 BHL 基序。
上述结果充分地解释了为什么大部分的内含子序列与 TSEN 没有直接的相互作用,而不同内含子的 pre-tRNA 可以被容纳和裂解,解析了人类 TSEN 去除 pre-tRNA 内含子的分子机制。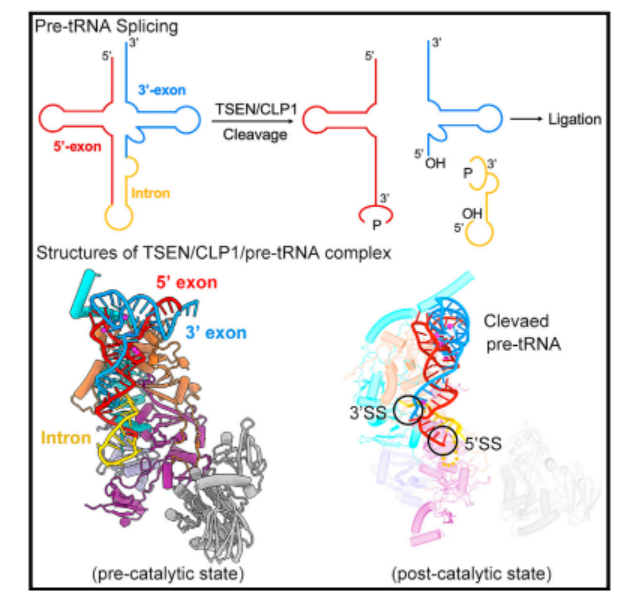
图 4:来源 Molecular Cell
研究展望
值得一提的是,施一公及张晓峰团队于两个月前发表研究论文 Mechanisms of the RNA helicases DDX42 and DDX46 in human U2 snRNP assembly,揭秘三种 RNA 解旋酶作用机制——人 U2 snRNP 组装中 RNA 解旋酶 DDX42 和 DDX46 的作用机制,为癌症突变机制提供新见解!
施一公院士团队是世界上首个、也是唯一一个成功捕获并解析了 RNA 剪接过程中所有完全组装剪接体高分辨率三维结构系列成果的团队。从组装到被激活,从两步转酯反应发生到剪接体的解聚,各种各样状态的剪接体完整覆盖了剪接通路,首次将剪接体介导的 RNA 剪接过程完整地串联起来,为理解 RNA 剪接的分子机理提供了最清晰、最全面的结构信息,成功获取剪接体这颗分子生物学皇冠上的明珠。
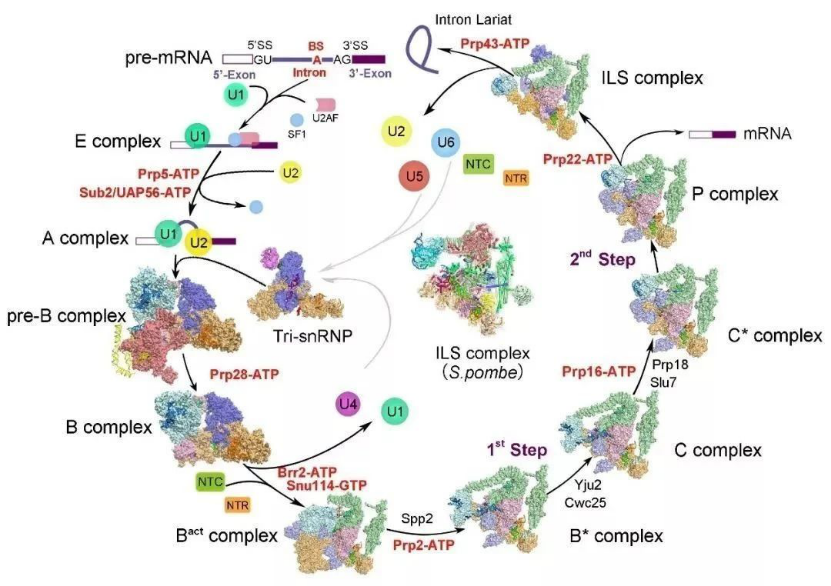
图 5:剪接体结构汇总(来源:https://ygshi.org/research)
目前,施一公团队克服巨大的技术障碍,深入探索生命细节,获得人类 TSEN/CLP1/pretRNA 复合物在催化前和催化后状态下的结构,为理解 pre-tRNA 剪接的机制提供了一个全新的框架。如此振奋人心的研究结果令人看到了科学家们孜孜不倦的努力,从基础科学的研究到临床应用,再到治疗疾病,未来可期!
题图来源:站酷海洛
参考文献:
1. Zhang et al., Structural basis of pre-tRNA intron removal by human tRNA splicing endonuclease, Molecular Cell (2023), https://doi.org/10.1016/j.molcel.2023.03.015
2.Yang F, Bian T, Zhan X, et al. Mechanisms of the RNA helicases DDX42 and DDX46 in human U2 snRNP assembly. Nat Commun. 2023;14(1):897. Published 2023 Feb 17. doi:10.1038/s41467-023-36489-x
长久以来,剪接体的调控机理是怎样的,它们在细胞内部的动态组合和变化是怎样的,深深地吸引着科学家们的研究兴趣,但其神秘的面纱一直未被揭开。
2023 年 4 月 6 日,西湖大学施一公团队在 Molecular Cell 杂志发表研究论文 Structural basis of pre-tRNA intron removal by human tRNA splicing endonuclease,该研究首次解析了人类 tRNA 剪接内切核酸酶(TSEN)在催化前和催化后状态下与全长 tRNA 前体 (pre-tRNA) 结合的低温电子显微镜结构,显示了 TSEN 如何识别 pre-tRNA,并将 3' 剪接位点和 5' 剪接位点定位到其切割位点,综合利用结构生物学和生化工作解释了人类 TSEN 去除 pre-tRNA 内含子的分子机制。
图 1:来源 Molecular Cell
研究内容
转运 RNA(tRNA)对生物遗传信息的传递至关重要,它通过核糖体将信使 RNA(mRNA)翻译成蛋白质。成熟的 tRNAs 由前体 tRNAs(pre-tRNAs)通过一系列的转录后加工和修饰步骤产生,从 pre-tRNA 中去除内含子对于生物遗传进化是必不可少的。
在人类中,去除 pre-tRNA 中内含子的过程是由 tRNA 剪接内切核酸酶(TSEN)介导的,该亚酶包括四个亚基:TSEN2、TSEN15、TSEN34 和 TSEN54。值得一提的是,尽管多核苷酸激酶 CLP1 在体外对前 tRNA 切割是可有可无的,但 CLP1 中的突变和所有 TSEN 亚基都与 tRNA 代谢和神经病理学的改变有关。
为回答 pre-tRNA 是如何被 TSEN 识别的,以及 5' 剪接位点和 3' 剪接位点是如何被加载到 TSEN2/ TSEN34 的活性位点这两个困扰科研界多年的谜题,本研究通过纯化人 TSEN/CLP1 复合物、pre-tRNA 切割试验、TSEN/CLP1/前 pre-tRNA 复合体的组装、冷冻电镜样品制备和数据采集以及竞争性结合测定生化实验,对其进行深入探索。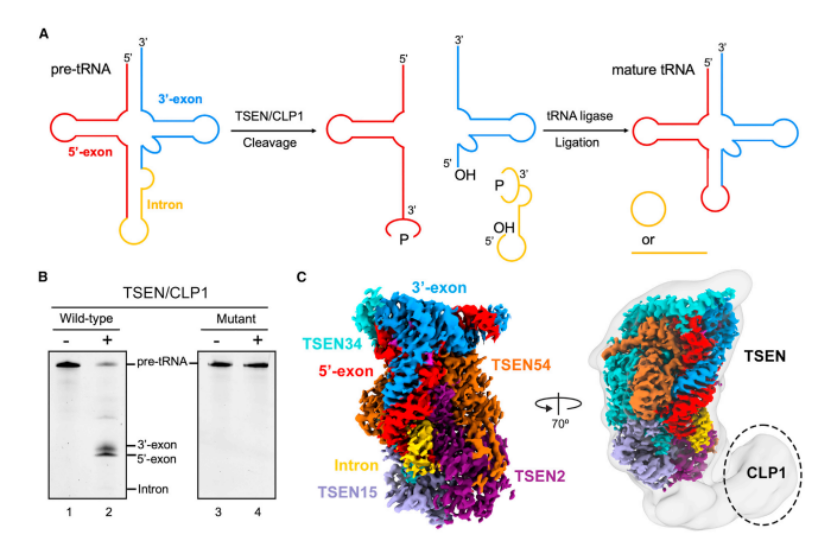
图 2:来源 Molecular Cell
研究结果
本研究首次报道了两种人类 TSEN 与全长 pre-tRNA 结合、高分辨率低温电子显微镜结构:一种在催化前状态,另一种在催化后状态,平均分辨率分别高达 2.94 Å 和 2.88 Å。
研究结果显示人类 TSEN 的结构特征是一个延伸的表面凹槽,容纳了 l 形的 pre-tRNA,pre-tRNA 的成熟结构域被 TSEN34、TSEN54 和 TSEN2 的保守结构元件所识别,这种识别定位了 pre-tRNA 的反密码子茎。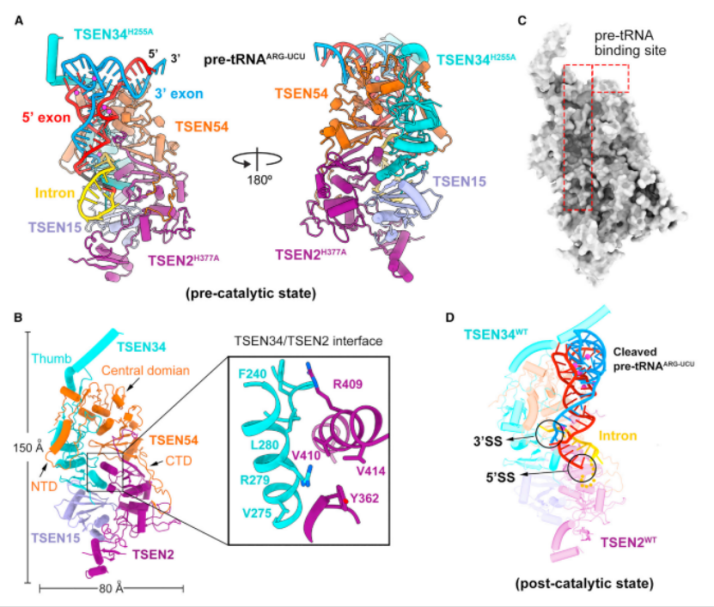
图 3:来源 Molecular Cell
令人惊喜的是,5' 剪接位点和 3' 剪接位点周围的核苷酸主要被 TSEN2 和 TSEN34 识别,这些相互作用可以确保 5' 剪接位点和 3' 剪接位点分别精确地放置在 TSEN2 和 TSEN34 的催化中心中。
此外,为了捕获预催化状态,研究人员在 TSEN 中引入了两个错义突变:TSEN34 中的 H255A 和 TSNE2 中的 H377A,进而研究其结构信息以及结构引导的生化分析,为成功解析人类 TSEN 前 tRNA 识别和切割的机制提供了基础。
考虑到 pre-tRNA 和 tRNA 结构的相似性,TSEN 延伸的扩展表面凹槽也应该识别 tRNA。为证实该分析,tRNAARG-UCU 与 TSEN/CLP1 形成了一个稳定的复合物。与 tRNA 相比,pre-tRNA 可以被 TSEN 识别,其更具体的相互作用指向其独特的 BHL 基序。
上述结果充分地解释了为什么大部分的内含子序列与 TSEN 没有直接的相互作用,而不同内含子的 pre-tRNA 可以被容纳和裂解,解析了人类 TSEN 去除 pre-tRNA 内含子的分子机制。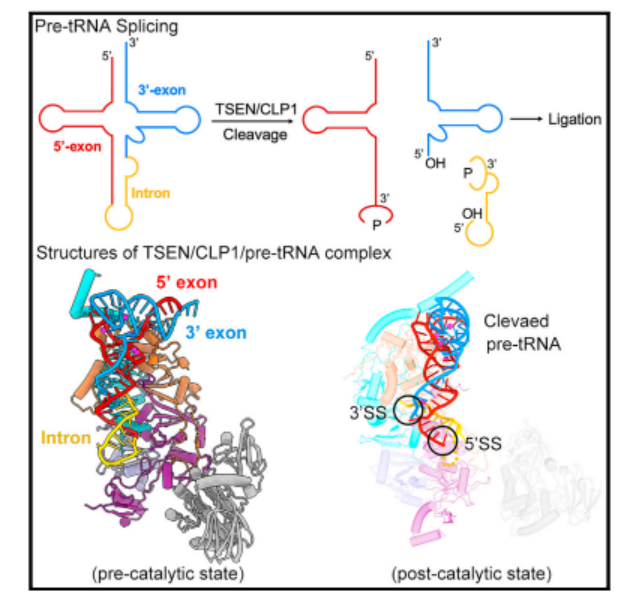
图 4:来源 Molecular Cell
研究展望
值得一提的是,施一公及张晓峰团队于两个月前发表研究论文 Mechanisms of the RNA helicases DDX42 and DDX46 in human U2 snRNP assembly,揭秘三种 RNA 解旋酶作用机制——人 U2 snRNP 组装中 RNA 解旋酶 DDX42 和 DDX46 的作用机制,为癌症突变机制提供新见解!
施一公院士团队是世界上首个、也是唯一一个成功捕获并解析了 RNA 剪接过程中所有完全组装剪接体高分辨率三维结构系列成果的团队。从组装到被激活,从两步转酯反应发生到剪接体的解聚,各种各样状态的剪接体完整覆盖了剪接通路,首次将剪接体介导的 RNA 剪接过程完整地串联起来,为理解 RNA 剪接的分子机理提供了最清晰、最全面的结构信息,成功获取剪接体这颗分子生物学皇冠上的明珠。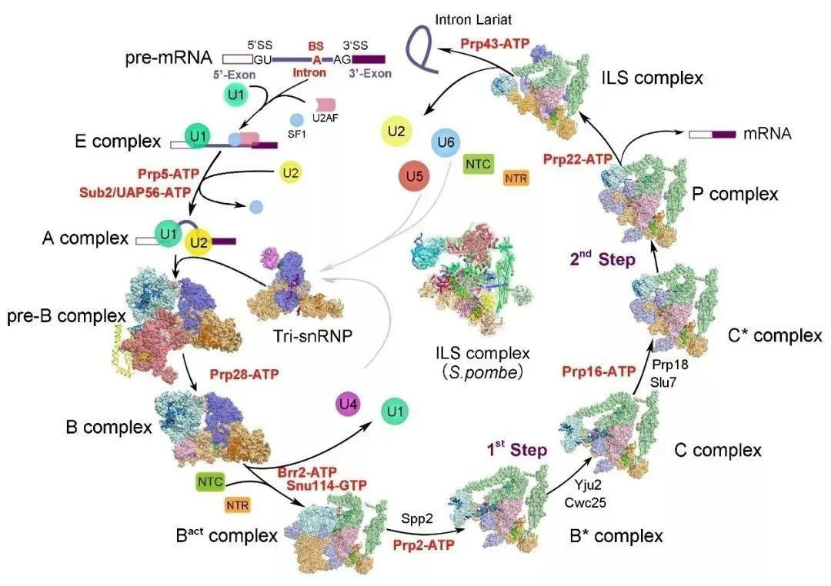
图 5:剪接体结构汇总(来源:https://ygshi.org/research)
目前,施一公团队克服巨大的技术障碍,深入探索生命细节,获得人类 TSEN/CLP1/pretRNA 复合物在催化前和催化后状态下的结构,为理解 pre-tRNA 剪接的机制提供了一个全新的框架。如此振奋人心的研究结果令人看到了科学家们孜孜不倦的努力,从基础科学的研究到临床应用,再到治疗疾病,未来可期!
题图来源:站酷海洛
参考文献:
1. Zhang et al., Structural basis of pre-tRNA intron removal by human tRNA splicing endonuclease, Molecular Cell (2023), https://doi.org/10.1016/j.molcel.2023.03.015
2.Yang F, Bian T, Zhan X, et al. Mechanisms of the RNA helicases DDX42 and DDX46 in human U2 snRNP assembly. Nat Commun. 2023;14(1):897. Published 2023 Feb 17. doi:10.1038/s41467-023-36489-x