Sci Transl Med:治疗 Angelman 综合征,反义寡核苷酸疗法展现积极效果
丁香学术
研究背景
Angelman 综合征是一种神经遗传性疾病,患者通常会出现智力障碍、运动障碍和语言障碍等症状。该疾病又被称为「天使综合症」、「快乐木偶综合征」,因为临床表现为智力低下及全面的发育延迟,小头畸形、多动,存在运动障碍,常有频繁无诱因的暴发性笑或微笑、表情愉悦、拍手等行为。美国食品和药物管理局(FDA)于去年授予 Ionis 公司的 ION582 用于治疗 Angelman 综合征的孤儿药和儿科罕见病资格认定。但是目前尚未有能治愈 Angelman 综合征的上市药物。
Angelman 综合征是由于母系基因组中 UBE3A 基因的缺陷或功能突变导致的,而父系基因组中的 UBE3A 基因则被非编码 RNA UBE3A-AS 转录本所抑制。UBE3A-AS 转录本是一个非编码 RNA,会抑制父系基因组中 UBE3A 基因表达。因此可以通过针对 UBE3A-AS 的转录起始区域进行干预,以恢复父亲基因组中 UBE3A 基因的表达。
在这篇题目为:An ASO therapy for Angelman syndrome that targets an evolutionarily conserved region at the start of the UBE3A-AS transcript 的论文中,来自美国得克萨斯农工大学的研究团队设计了化学优化的 ASO(反义寡核苷酸药物)靶向 UBE3A 反义转录本起点的进化保守区域来抑制其转录,从而重新激活父系 UBE3A 等位基因在神经元中的表达。本文设计的 ASO 能够成功抑制 UBE3A-AS 的转录并重新激活多能干细胞诱导衍生的 Angelman 综合征神经元父系 UBE3A 等位基因的表达。
图片来源:Science Translational Medicine
课题设计
该研究分为三个主要部分:
(1)了解和比较人类 SNHG14 / UBE3A-AS 和小鼠 Snhg14 / Ube3a-AS 转录本在大脑中的转录后加工的方式;
(2)确定能够有效地抑制人类 UBE3A-AS 转录本的表达的基因组区域;
(3)在人类神经元和动物模型中开发和测试潜在的 ASO 治疗方法。
本研究中提到的 ASO 是一种针对 Angelman 综合症的潜在治疗方法,其设计方法如下:首先,研究人员通过 RNA 测序技术确定了 UBE3A-AS 转录本的起始位点,并确定了一个特定区域,该区域可以有效地抑制人类 UBE3A-AS 转录本的表达。
然后,他们设计了一种称为 gapmer ASO 的分子,该分子由两个寡核苷酸序列和一个 DNA 序列组成。其中寡核苷酸序列与目标 RNA 互补配对,而 DNA 序列则用于增强 ASO 与 RNA 结合的稳定性。
最后,研究人员通过化学修饰来优化这些 ASO 分子的药代动力学和生物稳定性,并使用它们来测试其在神经元和大动物模型中的效果。
实验结果
研究人员首先通过 RNA 测序技术对人类大脑组织中的 SNHG14 / UBE3A-AS 和小鼠大脑组织中的 Snhg14 / Ube3a-AS 转录本进行分析,并比较它们在不同类型细胞中的表达情况。研究人员发现,人类 SNHG14 / UBE3A-AS 和小鼠 Snhg14 / Ube3a-AS 转录本在大脑中的处理方式存在差异。具体来说,它们在不同类型细胞中的表达模式不同,并且它们的起始位点也存在差异。
这些结果表明,针对 Angelman 综合症的治疗方法需要针对人类 SNHG14 / UBE3A-AS 转录本进行设计,并且需要考虑其特定区域以确保治疗效果。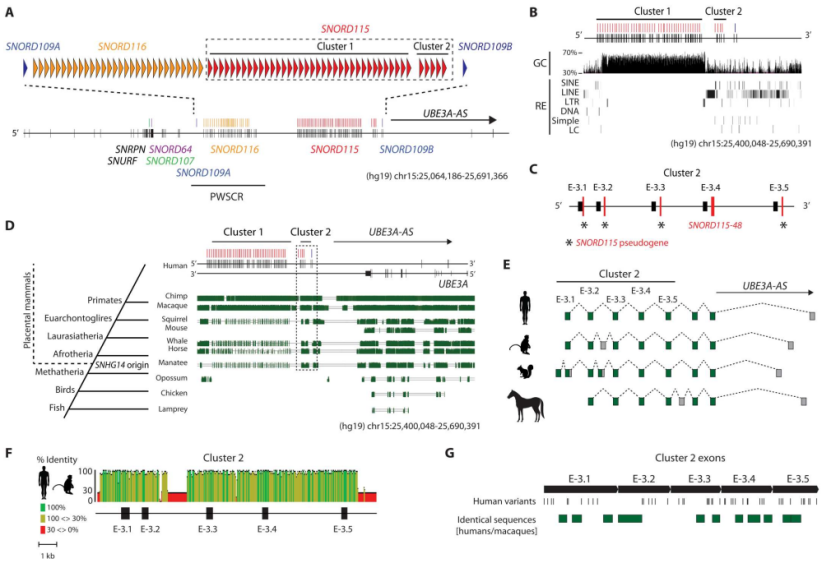
图 1. 比较不同物种 SNHG14 / UBE3A-AS 转录本的表达模式
接下来,研究人员进一步尝试设计并化学优化 gapmer ASO 分子,该分子可以与 UBE3A-AS 转录本的起始区域互补配对,从而抑制其表达。然后,研究者们在神经元和动物模型中测试该治疗方法的效果。研究人员发现,针对 UBE3A-AS 转录本开头特定区域的 ASO 治疗方法可以有效地抑制人类 UBE3A-AS 转录本的表达,并恢复父亲基因组中 UBE3A 基因的表达。此外,在猕猴模型中,该治疗方法也能够通过临床相关的给药途径进行输送,并且可以在不同类型的细胞中产生作用。
这些结果表明,针对 UBE3A-AS 转录起始区域的 ASO 治疗方法可能成为一种新的 Angelman 综合症治疗选择。然而,需要进行更多实验和临床试验来验证其有效性和安全性,并进一步优化该治疗方法以提高其临床应用前景。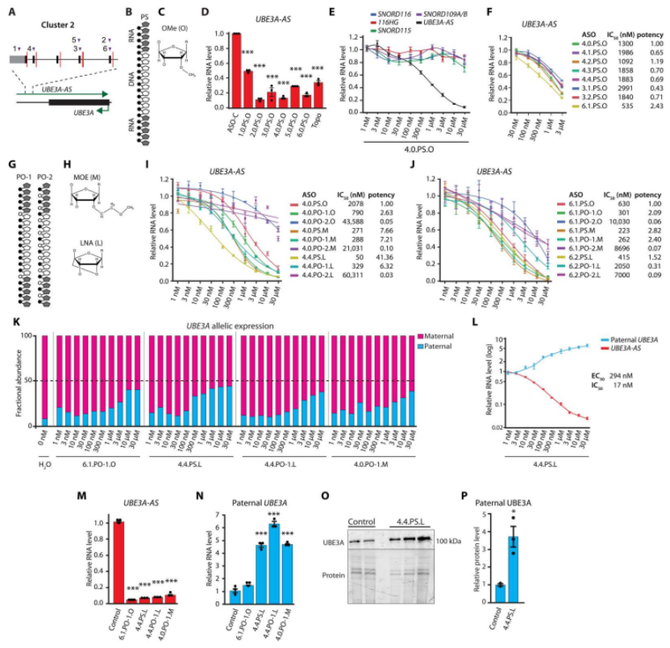
图 2. ASO 靶向 UBE3A-AS 在人类 iPSC 神经元中的应用
值得一提的是,研究人员还通过比较人类 SNHG14 / UBE3A-AS 和小鼠 Snhg14 / Ube3a-AS 转录本序列,确定了一个高度保守的区域,可能是 UBE3A-AS 转录本的进化保守起始位点。这些结果为进一步优化针对 UBE3A-AS 转录本起始区域区域的 ASO 治疗方法提供了新思路,并有助于深入理解 Angelman 综合征发生机制。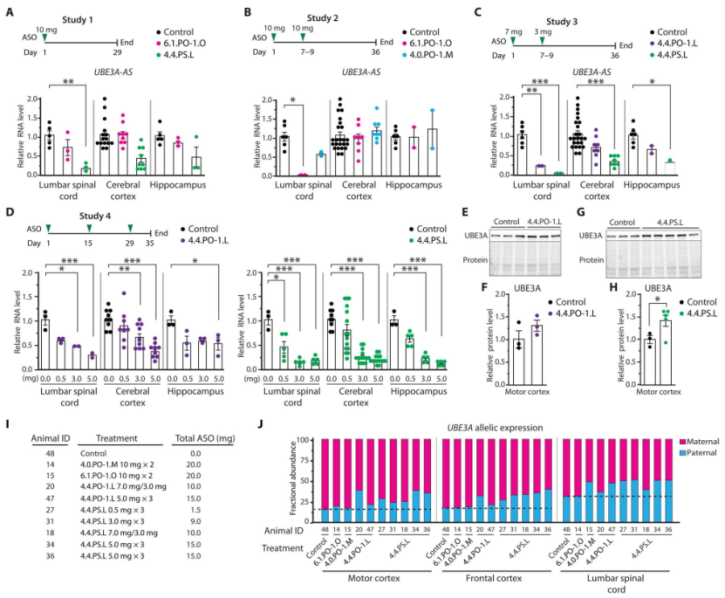
图 3. ASO 治疗抑制 UBE3A-AS 转录本并重新激活父系 UBE3A 在猕猴中枢神经系统的表达
研究结论
在这篇文章中,研究人员针对 UBE3A-AS 转录起始区域设计了化学优化的 gapmer ASO 治疗方法,针对 UBE3A 反义转录本的反义寡核苷酸 (ASO) 疗法精确且有效地抑制了 UBE3A-AS 的转录,重新激活了多能干细胞诱导衍生的 Angelman 综合征神经元中父系 UBE3A 等位基因的表达。通过腰椎鞘内注射 gapmer ASO 至猕猴中枢神经系统的实验结果显示 UBE3A-AS 的转录受到抑制,且整个中枢神经系统父系 UBE3A 等位基因的表达重新得到了激活。此外,该实验还发现了一个高度保守的区域,可能是 UBE3A-AS 转录本的进化保守起始位点。
这些结果表明,针对 UBE3A-AS 转录本开头特定区域的 ASO 治疗方法可能成为一种新的 Angelman 综合症治疗选择。然而,需要进行更多实验和临床试验来验证其有效性和安全性,并进一步优化该治疗方法以提高其临床应用前景。
讨论展望
Angelman 综合征是作为一种神经遗传性疾病,目前尚无有效的治疗方法。本文探讨了针对 Angelman 综合症的 ASO 治疗方法的潜在临床应用前景,迈出了开发 Angelman 综合征治疗方法的重要一步。作者指出,该治疗方法具有多种优点,如高度特异性、可逆性和可调节性等。此外,该治疗方法还可以通过不同的给药途径进行输送,并且可以在不同类型的细胞中产生作用。
然而,作者也指出了一些潜在的挑战和限制因素,如 ASO 分子的药代动力学和生物稳定性、剂量效应关系以及可能存在的免疫反应等。因此,需要进一步开展更多实验和临床试验来验证该治疗方法的有效性和安全性,并进一步优化其设计以提高其临床应用前景。最后,研究人员指出,未来的工作应侧重于优化 Angelman 综合征的 ASO 疗法,包括确定最佳剂量、频率和治疗持续时间。此外,该论文表明,需要进行进一步的研究,以评估 ASO 疗法在动物模型和临床试验中的安全性和有效性。最后,该论文建议,未来的工作应探索将 ASO 疗法与 Angelman 综合征的其他治疗方法相结合的可能性。
值得注意的是,这项研究的结果基于在培养的人类神经元和大型动物模型中进行的实验,因此仍需要进一步的研究来评估临床试验中 ASO 疗法的安全性和有效性。此外,ASO 疗法对中枢神经系统中 UBE3A 和其他基因表达的长期影响尚不清楚,需要进一步研究。总之,目前还需要进行更多实验和临床试验来验证这种潜在治疗方法是否有效和安全。如果结果积极,那么可能需要几年时间将其推向市场并为患者提供治疗。
图片来源 & 文献出处:
Dindot, S. V. et al. An ASO therapy for Angelman syndrome that targets an evolutionarily conserved region at the start of the UBE3A-AS transcript. Science Translational Medicine 15, eabf4077, doi:10.1126/scitranslmed.abf4077 (2023).



![[精选]SCI论文写作投稿资料包:100+资料& 投稿答疑30问](https://img1.dxycdn.com/p/s14/2023/1105/569/6102685706544601271.jpg!wh200)



