Nat Commun:肖东/孙妍课题组合作揭示 m6A 修饰调节细胞自噬的新机制
丁香学术
2022 年 10 月 4 日,南方医科大学肖东研究员、广东省人民医院孙妍研究员和南方医科大学汪佳宏助理研究员合作在 Nature Communications 期刊上发表了题为 Autophagy induction promoted by m6A reader YTHDF3 through translation upregulation of FOXO3 mRNA 的研究论文。
该研究揭示了 m6A 阅读器 YTHDF3 作为营养反应器调节自噬诱导的作用和机制,为 RNA 转录后修饰通过调控自噬应对营养缺乏应激的范式提供了见解。
自噬是维持细胞内稳态和更新的重要进化机制。自噬的调节对于生命过程至关重要,如自噬参与干细胞行为、胚胎发育、天然免疫和寿命等的调控,而自噬功能障碍可以导致肿瘤发生发展、神经退行性疾病、代谢紊乱和寿命缩短等。尽管调节细胞自噬的营养传感器已有报道,然而诸如 m6A 等表观转录修饰在调控饥饿诱导的自噬中的作用尚不清楚。已有的一系列研究揭示营养缺乏和其它应激反应中表观转录组学的明显动态变化,这提示这种变化与自噬调节高度相关的可能性。因此,本文研究者推测动态可逆的 RNA 修饰可响应不断变化的营养信号实现迅速的基因表达调控,对自噬发挥重要影响,并且一些表观转录组成员在此过程中可能发挥关键作用。
该研究首先基于原代分离的小鼠胚胎成纤维细胞 (mouse embryonic fibroblasts, MEFs),通过蛋白组学检测,发现在营养缺乏期间,m6A 阅读器 YTHDF3 表达显著上调(图 1a)。进一步的分子和细胞功能实验表明,YTHDF3 对自噬诱导至关重要,YTHDF3 过表达促进营养缺乏时自噬体形成和溶酶体降解(图 1c-l)。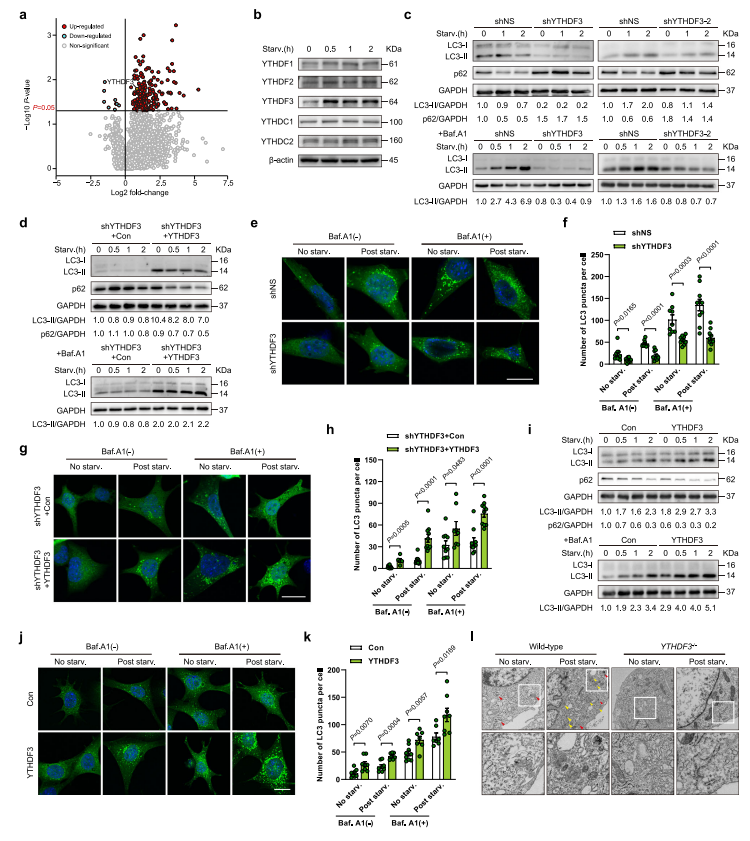
图 1 YTHDF3 上调对诱导自噬至关重要
(图源:Hao WC, et al., Nat Commun, 2022)
METTL3 是 mRNA 的 m6A 甲基化修饰酶。研究表明,METTL3 表达与其 m6A 修饰酶活性在营养缺乏时均明显上调(图 2a-f),而 METTL3 功能缺失可引起饥饿诱导的功能性 m6A 甲基化修饰抑制并降低 YTHDF3 介导的自噬流(图 2 h-m)。接着,研究者探讨了饥饿导致 METTL3 m6A 修饰酶活性及其表达升高的分子机制,发现泛素-核糖体蛋白融合蛋白 RPS27a 与 METTL3 结合减弱显著抑制 METTL3 泛素化降解,是导致饥饿时 METTL3 蛋白稳定性和丰度增加的主要原因。
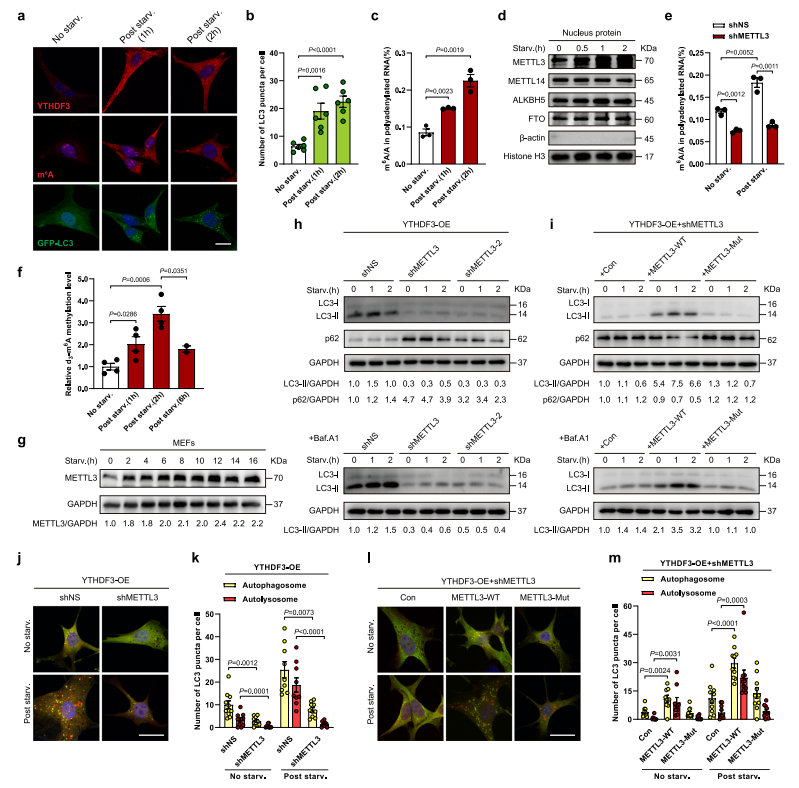
图 2 YTHDF3 需要 METTL3 介导的 m6A 修饰来促进自噬
(图源:Hao WC, et al., Nat Commun, 2022)
为探究 YTHDF3 识别 mRNA m6A 修饰诱导自噬的具体机制,研究者运用饥饿诱导的 MEFs 细胞模型通过 RIP 和 MeRIP 测序(图 3a-f),并运用 RNA EMSA 等实验(图 3 g-k),证实 METTL3 介导的 m6A 高甲基化在营养缺乏期间介导了 YTHDF3-FOXO3 mRNA 的相互作用。接着,作者在 YTHDF3 过表达或敲低的 MEFs 中进行 METTL3 或 FOXO3 表达的干预,并开展相关分子和细胞功能实验。数据表明,YTHDF3 以 METTL3 依赖的方式调节 FOXO3 表达和改变 FOXO3 下游多种关键自噬相关基因表达,且 FOXO3 对 YTHDF3 诱导自噬至关重要。机制上,YTHDF3 可识别 FOXO3 mRNA 终止密码周围 CDS 区和 3' UTR 区的 m6A 修饰位点,促进 FOXO3 翻译。另外,YTHDF3 还可募集翻译起始因子 eIF3a 和 eIF4B 以促进 FOXO3 翻译,进而启动自噬。
图 3 YTHDF3 识别饥饿诱导的 FOXO3 mRNA 的 m6A 超甲基化
(图源:Hao WC, et al., Nat Commun, 2022)
综上,该研究揭示了表观转录修饰和自噬调节之间的重要联系。所提供的研究证据表明,m6A 阅读器 YTHDF3 可通过识别 METTL3 介导的 m6A 高甲基化发挥营养反应器的作用来诱导自噬,其识别 FOXO3 mRNA 终止密码周围的高 m6A 修饰,并募集 eIFs 以促进 FOXO3 翻译,进一步转录激活自噬相关基因表达,进而启动自噬(图 4)。此研究揭示 RNA 甲基化修饰可以作为潜在靶点,通过其调控自噬干预某些疾病的进展,例如癌症发生发展或者衰老相关疾病的进程。
图 4 营养应激状态下 YTHDF3 调控自噬过程的工作模式图
(图源:Hao WC, et al., Nat Commun, 2022)
该研究由南方医科大学肖东研究员和广东省人民医院/广东省医学科学院孙妍研究员联合指导完成,广东药科大学附属第一医院暨南方医科大学郝伟超博士和南方医科大学奠梅娟博士为本文的共同第一作者,南方医科大学基础医学院肿瘤研究所暨实验动物管理中心肖东研究员、广东省人民医院/广东省医学科学院孙妍研究员和南方医科大学基础医学院肿瘤研究所汪佳宏助理研究员为本文的共同通讯作者。该研究得到国家自然科学基金、广东省自然科学基金和广东省科技计划项目等基金的资助。