Cell Metab:南京大学毕艳团队首次发现外泌体介导脂肪-大脑间通讯
丁香学术
糖尿病会显著增加认知障碍(包括轻度认知损伤和痴呆)的风险,严重威胁老年健康生存。然而,临床研究表明,控制血糖不能保护认知功能。因此,迫切需要进一步揭示糖尿病认知功能障碍的机制,寻找能够治疗糖尿病认知障碍的新策略。
脂肪组织功能异常在认知障碍发生发展过程中起着重要作用。脂肪组织产生的细胞因子如瘦素、脂联素等与大脑认知记忆功能的维持相关;同时,脂肪产生的炎症因子可通过诱导慢性中枢炎症反应,损伤海马神经功能,促进认知障碍发生。然而,目前针对这些脂肪组织相关机制的干预方法尚未能逆转认知障碍的进程。
除了可溶性的脂肪因子外,最新研究发现,脂肪组织也可分泌细胞外囊泡(EVs)作为新型脂肪因子在器官间通讯中发挥重要作用,如肝脏和骨骼肌,并参与了非酒精性脂肪性肝病和 2 型糖尿病的发展。然而,EVs 能否介导脂肪组织-大脑间通讯,尚不得而知。
2022 年 9 月 6 日,南京大学医学院附属鼓楼医院内分泌科毕艳教授团队和南京大学生命科学院张辰宇教授、李靓副教授团队合作,在 Cell Metabolism 期刊发表了题为:Extracellular vesicles mediate the communication of adipose tissue with brain and promote cognitive impairment associated with insulin resistance 的研究论文,首次发现外泌体介导脂肪-大脑间通讯并促进糖尿病认知功能障碍的发生。
研究团队首先利用脂肪移植来研究脂肪组织在糖尿病认知功能损伤中的作用。结果发现,正常小鼠在移植糖尿病小鼠的脂肪组织后出现认知功能损伤,海马突触密度降低。进一步通过细胞实验发现,糖尿病脂肪组织分泌的脂肪因子可造成神经元突触损伤,而去除外泌体可显著减轻此效应。
为进一步研究脂肪组织来源的 EVs 是否直接参与糖尿病认知功能障碍的发生,研究人员通过尾静脉注射、海马立体定位注射的方式,分别用高脂小鼠和糖尿病患者脂肪组织来源的 EVs 处理正常小鼠,结果发现正常小鼠出现显著的突触丢失和认知功能损伤。进一步通过 EVs 示踪技术发现,脂肪组织来源的 EVs 可被运输到脑中,并在海马神经元中富集。这些结果提示糖尿病中脂肪组织来源的 EVs 对认知功能具有有害影响。
既往研究表明,miRNAs 是脂肪组织 EVs 中发挥生物学功能的关键分子。随后,研究人员通过病毒介导的基因编辑技术,发现脂肪组织 EVs 可将 miRNAs 运输至海马脑区,而靶向清除脂肪组织 EVs 中的 miRNAs 则可减轻糖尿病小鼠的认知功能损伤。进一步,通过 RNAseq 分析脂肪组织 EVs 中可能导致认知损伤的 miRNAs,发现 miR-9-3p 在高脂小鼠的海马组织和脂肪组织 EVs 以及糖尿病患者脂肪组织 EVs 中均显著上调。
进一步验证发现,与正常受试者相比,肥胖糖尿病受试者脂肪组织、脂肪组织 EVs 和血清 EVs 中 miR-9-3p 水平显著上调;糖尿病及糖尿病伴轻度认知障碍患者血清 miR-9-3p 水平均显著上调,且与 MoCA 认知评分值呈负相关。
最后,他们研究了 miR-9-3p 与认知损伤的关系。抑制海马或者脂肪组织中的 miR-9-3p 可显著缓解糖尿病相关突触损伤和认知功能损伤。进一步,通过转录组测序等方法,发现 miR-9-3p 通过靶向 BDNF,诱导突触损伤。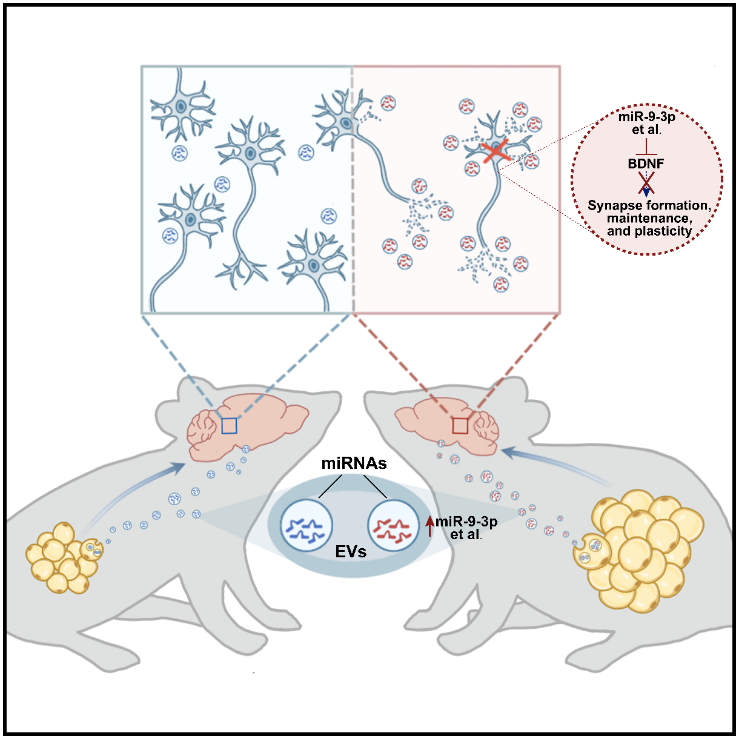
综上所述,研究的创新性体现在:
1)发现一条新的脂肪-大脑间信息交流的途径:脂肪组织 EVs;
2)发现一个糖尿病认知功能障碍发生的新机制:糖尿病脂肪组织 EVs 可造成突触丢失和认知功能损伤;
3)发现脂肪组织 EVs 及其中的 miRNAs 可作为潜在的糖尿病认知功能障碍治疗的新靶点。